miR-146a有望治疗老年痴呆
阿尔茨海默病(AD),即老年痴呆,是最常见的神经退行性疾病,目前尚无有效的治疗方法。关于AD的机制和治疗靶点的主流研究主要集中在两个最重要的特征,Aβ和Tau,但临床研究的结果并不令人鼓舞。小胶质细胞异常极化是AD进展过程中一个明显的典型病理特征。小胶质细胞通过降解和去除Aβ和Tau蛋白具有神经保护作用。然而,在AD条件下,小胶质细胞转化为促炎表型,降低小胶质细胞的吞噬活性,损伤神经元,促进AD的病理。作者之前报道miR-146a多态性与零星AD风险相关,鼻给药miR-146a模拟物可减少AD的认知障碍和主要病理特征。然而,miR-146a通过何种机制抵抗AD的病理过程尚不清楚。本研究发现在APP/PS1转基因小鼠中,小胶质细胞特异性miR-146a过表达可以减少学习和记忆的认知缺陷,减轻神经炎症,降低Aβ水平,改善斑块相关的神经炎病理,并防止神经元丢失。本文于2021年11月发表在《Theranostics》IF:11.556期刊上。
技术路线:

主要结果:
1、小胶质细胞特异性miR-146a过表达改善APP/PS1 Tg小鼠的学习和记忆认知缺陷
通过立体定位技术将腺相关病毒小胶质细胞miR-146a (AAV-M146a)注射至10月龄APP/PS1 Tg小鼠双侧海马,评价其对AD潜在的治疗作用(Figure 1A)。注射一个月之后检测miR-146a是否在小胶质细胞中特异性表达。IF结果显示APP/PS1-AAV-M146a组内源性miR-146a与Iba1共定位在海马但不与NeuN或GFAP发生共定位(Figure 1B),随后RT-qPCR显示miR-146a在小胶质细胞中高表达。以上表明miR-146a过表达AD小鼠构建成功。
随后用水迷宫(MWM)和物体识别测试(ORT)判断小鼠的认知能力。在ORT实验中,miR-146a过表达组小鼠具有更好的认知行为表现(Figure 1D-E),在MWM实验中,miR-146a过表达组小鼠也表现出显著增加运动轨迹和较短的逃避潜伏期(Figure 1F-G),穿越平台的次数和目标象限的游泳距离也显著增加(Figure 1H-J)。这些结果表明小胶质细胞特异性miR-146a减轻AD小鼠模型的学习和记忆认知缺陷。
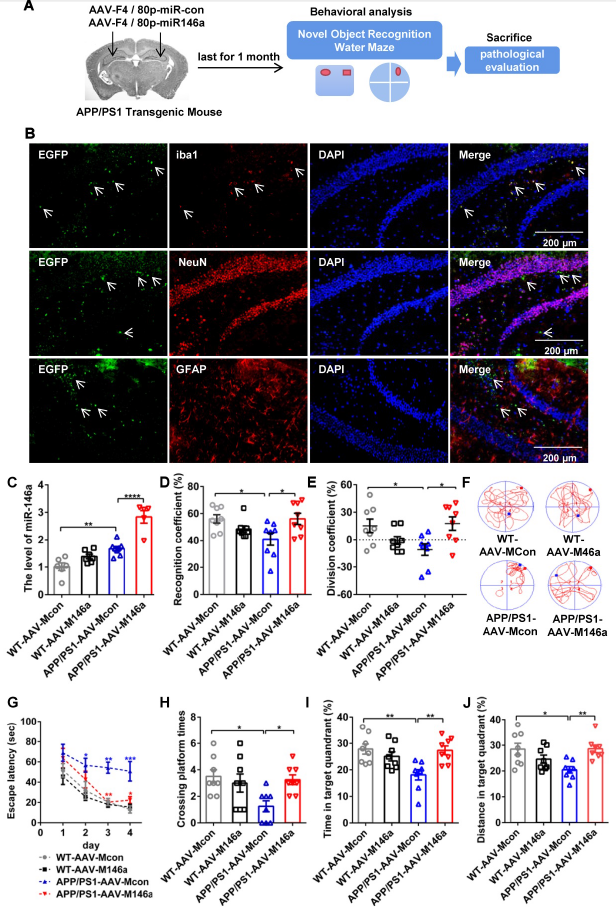
图1小胶质细胞特异性miR-146a过表达改善APP/PS1 Tg小鼠的学习和记忆认知缺陷
2、小胶质细胞特异性miR-146a过表达减缓APP/PS1 Tg小鼠的神经炎症和转换小胶质极化
作为小胶质细胞的神经免疫响应,神经炎症过程在AD发生发展过程中扮演着重要作用,因而检测了典型的炎症因子的水平。结果显示,miR-146a过表达显著减低了炎症因子的表达,包括IL-1β, TNF-α, and IL-6 (Figure 2A),并且显著增加了小胶质细胞M2标志物的表达Arg1, IL-10, CD206, and TGF-β (Figure 2B),而促炎因子和M1标志物则显著下调(Figure 2C);小胶质细胞标志物Iba1的蛋白表达显著增加(Figure 2D-E);MFG-E8蛋白表达水平无明显变化(Figure 2F),但其mRNA水平升高(Figure 2G)。还检测了斑块相关CD68的水平,这是小胶质细胞吞噬活性的标志,发现 miR-146a过表达后其表达显著增加。以上结果表明小胶质细胞特异性miR-146a过表达减缓APP/PS1 Tg小鼠的神经炎症和转换小胶质极化。
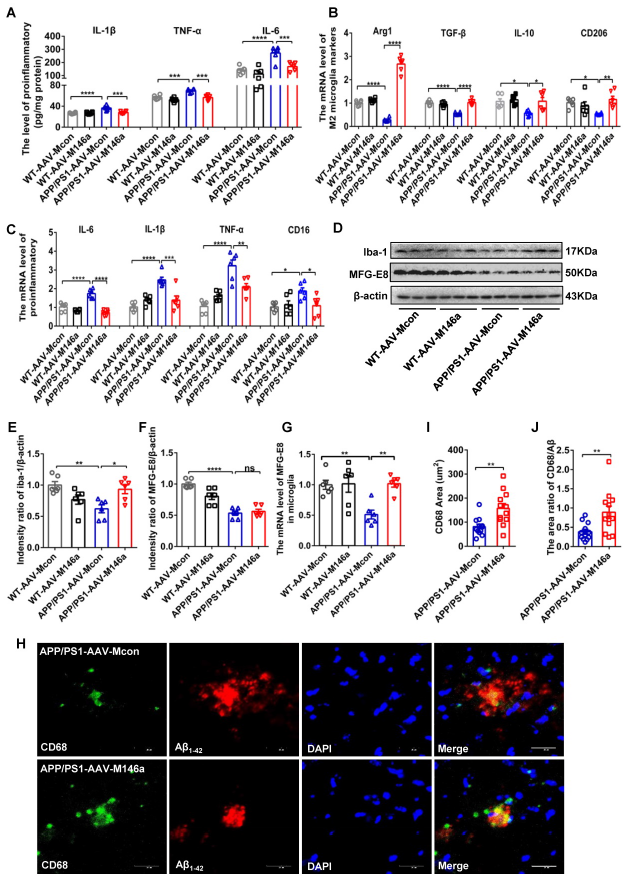
图2小胶质细胞特异性miR-146a过表达减缓APP/PS1 Tg小鼠的神经炎症和转换小胶质极化
3、小胶质细胞特异性miR-146a过表达降低AD小鼠的Aβ水平和amyloid斑块
Aβ是AD的经典病理特征之一,AD中小胶质细胞的极化与Aβ的吞噬作用密切相关。海马Aβ与Aβ42抗体染色显示APP/PS1-AAV-M146a组与APP/PS1-AAV-Mcon组相比,Aβ显著降低(Figure 3A)。然后用ELISA法检测全脑裂解液中可溶性和不可溶性Aβ的含量,发现不可溶性Aβ40和Aβ42都显著下降,而可溶性的则无明显改变(Figure 3B-E)。用Thios染色检测斑块形成,结果表明过表达miR-146a之后Thios的数量显著下降。以上结果提示小胶质细胞特异性miR-146a过表达降低AD小鼠的Aβ水平和amyloid斑块。
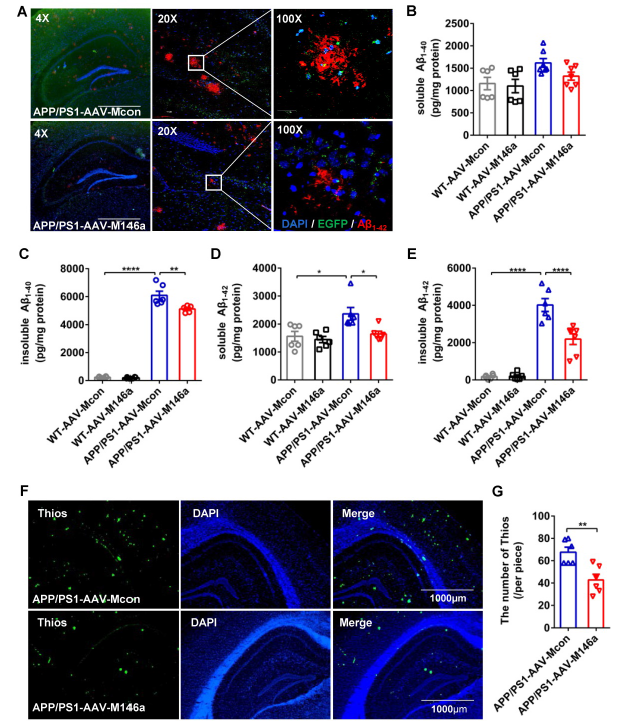
图3小胶质细胞特异性miR-146a过表达降低AD小鼠的Aβ水平和amyloid斑块
4、小胶质细胞特异性miR-146a过表达降低AD小鼠斑块相关神经炎病理和神经元丢失
此前有研究报道AD患者和小鼠模型中神经突营养不良与Aβ沉积密切相关,而AD小鼠模型中miR-146a过表达是否减轻了这一表型尚未被研究。发现与对照相比,过表达miR-146a后,抗APP的N末端抗体标记损伤的神经突,显示营养不良的神经突显著减少(Figure 4A–B);海马和皮质中神经元数量增加(Figure 4C–E);凋亡的神经元数量减少(Figure 4G–H)。以上结果表明小胶质细胞特异性miR-146a过表达降低AD小鼠斑块相关神经炎病理和神经元丢失。
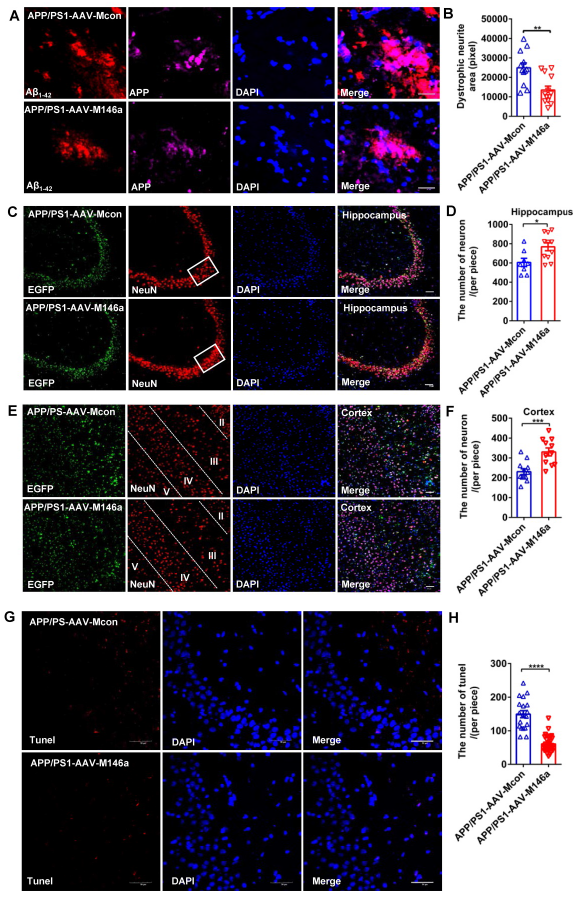
图4小胶质细胞特异性miR-146a过表达降低AD小鼠斑块相关神经炎病理和神经元丢失
5、在Aβ42诱导的细胞模型中,miR-146a水平升高触发小胶质细胞表型转换
在证实miR-146a过表达在体内将小胶质细胞从M1转化为M2后,进一步在体外证实这些结果,并试图确定miR-146a与小胶质细胞炎症反应之间的关系。结果发现,在Aβ42诱导下,过表达miR-146a后,由M1表型小胶质细胞产生的促炎因子TNF-α, IL-1β, and IL-6的水平都显著下降(Figure 5A–B);相反的,M2极化标志物和抗炎因子都显著升高(Figure 5C)。在Aβ42诱导下,与对照抑制剂组相比,miR-146a抑制剂组TNF-α、IL-1β和IL-6均未明显下降(Figure 5D–E)。Arg1 or TGF-β的水平也未观察到明显下降(Figure 5F)。这些结果表明miR-146a在Aβ42诱导下可触发小胶质细胞降低促炎表型,增强吞噬表型。
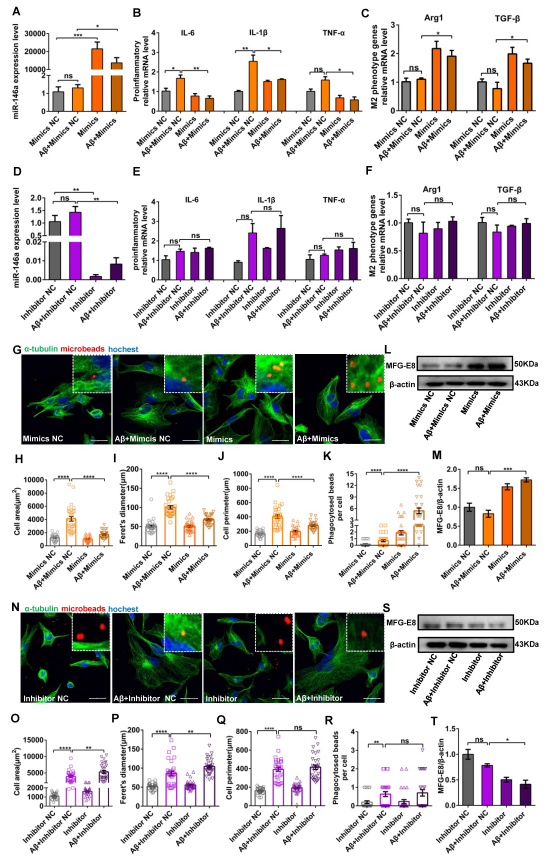
图5-1在Aβ42诱导的细胞模型中,miR-146a水平升高触发小胶质细胞表型开关
6、在Aβ42诱导的细胞模型中,miR-146a水平升高增强小胶质细胞吞噬作用
随后,探究miR-146a过表达能否提高小胶质细胞的吞噬作用。Aβ42处理的小胶质细胞表现出变形虫表型,其面积、Feret直径和周长均显著高于对照组,而Aβ42诱导前小胶质细胞内miR-146a水平过表达时,小胶质细胞呈圆形或梭形,面积、Feret直径和周长均较NC模拟组降低(Figure 5G–J)。相反,当在Aβ42诱导神经炎症前抑制miR-146a的表达,与模拟NC组相比,小胶质细胞面积、Feret直径和周长均无明显降低(Figure 5N–Q)。此外,使用聚苯乙烯微球来评估小胶质细胞的一般吞噬活性,并确保测量的是吞噬作用而不是胞饮作用,结果显示,与NC组相比,miR-146a过表达组的吞噬活性显著增强(Figure 5K),而miR-146a抑制剂的小胶质细胞在Aβ42诱导的吞噬活性下表现出不显著的吞噬活性(Figure 5R)。此外,还检测了MFG-E8,这是介导巨噬细胞吞噬凋亡细胞的关键因子,结果显示Aβ42刺激后MFG-E8水平无明显变化,但miR-146a模拟物使其水平升高(Figure 5L–M)。因此,这些结果表明在Aβ42诱导的细胞模型中,miR-146a水平升高增强小胶质细胞吞噬作用。
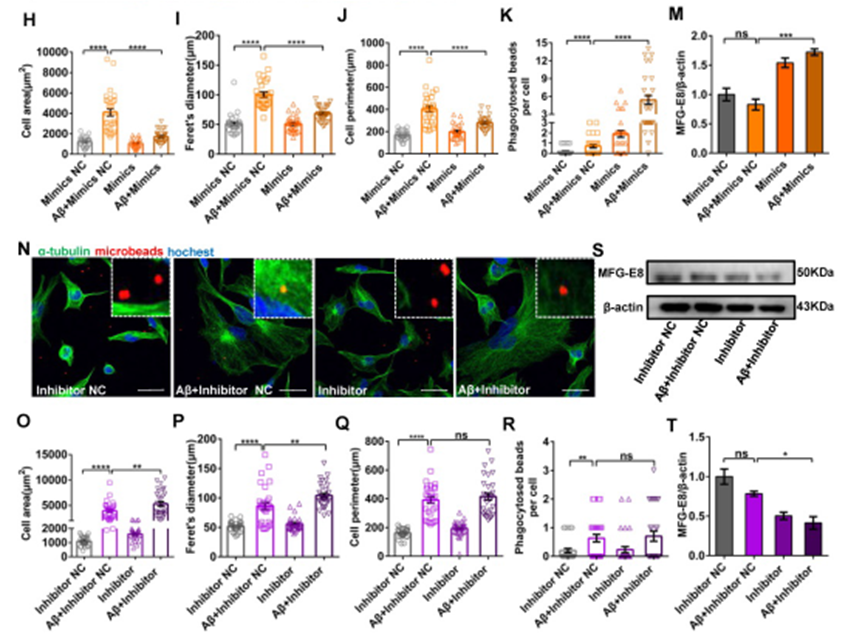
图5-2在Aβ42诱导的细胞模型中,miR-146a水平升高增强小胶质细胞吞噬作用
7、miR-146a水平升高阻碍Aβ42或LPS诱导的神经元凋亡
为了确定miR-146a是否能调节小胶质细胞的表型,从而减少神经元损伤,首先在体外用miR-146a模拟物或抑制剂处理HMC3细胞,然后加入Aβ42激活小胶质细胞。反过来,以1:1的比例直接共培养HMC3和SH-SY5Y细胞,以评估神经元凋亡(Figure 6A–B)。流式结果显示当Aβ42作用于HMC-3细胞时,SH-SY5Y细胞凋亡率升高(Figure 6C–D)。然而,miR-146a过表达SH-SY5Y细胞的凋亡率在Aβ42刺激下下降(Figure 6C,E);miR-146a抑制剂处理则相反(Figure 6D,F)。这些结果说明miR-146a水平升高阻碍Aβ42诱导的神经元凋亡。
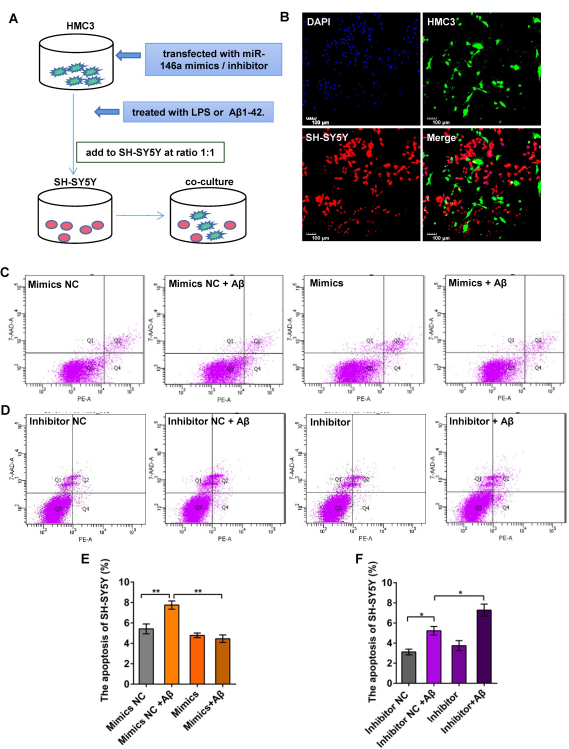
图6 miR-146a水平升高阻碍Aβ42或LPS诱导的神经元凋亡
8、鉴定到小胶质细胞过表达miR-146a的小鼠脑内神经炎症相关基因特征
为了探讨小胶质细胞miR-146a过表达对AD代谢通路的影响,特别是对神经炎症相关信号通路的影响,分析了APP/PS1-AAV-M146a和APP/PS1-AAV-Mcon小鼠的大脑样本的转录数据(Figure 7A)。如Figure 7B所示,几个炎症相关基因,如Oas1g、CD36和Cxcl10,均在上调量最高的基因中,表明miR-146a在神经炎症中起着中心作用。自组织映射(SOM)聚类也确定了参与神经炎症的基因(Figure 7C)。将这些基因按照APP/PS1-AAV-M146a和APP/PS1-AAV-Mcon小鼠组的表达水平进行分组。APP/PS1-AAVM146a小鼠组高表达基因的GSEA显示其在神经元凋亡过程和免疫系统过程负调控等生物学过程中富集(Figure 7E),而AD对照组小鼠组则表现为凋亡过程(Figure 7D)。KEGG显示差异表达基因主要富集在“immune response”, “immune system process”,“defense response”, and “cell response to interferon”通路(Figure 7G) ,提示miR-146a在AD的发展过程中对免疫应答具有重要作用。
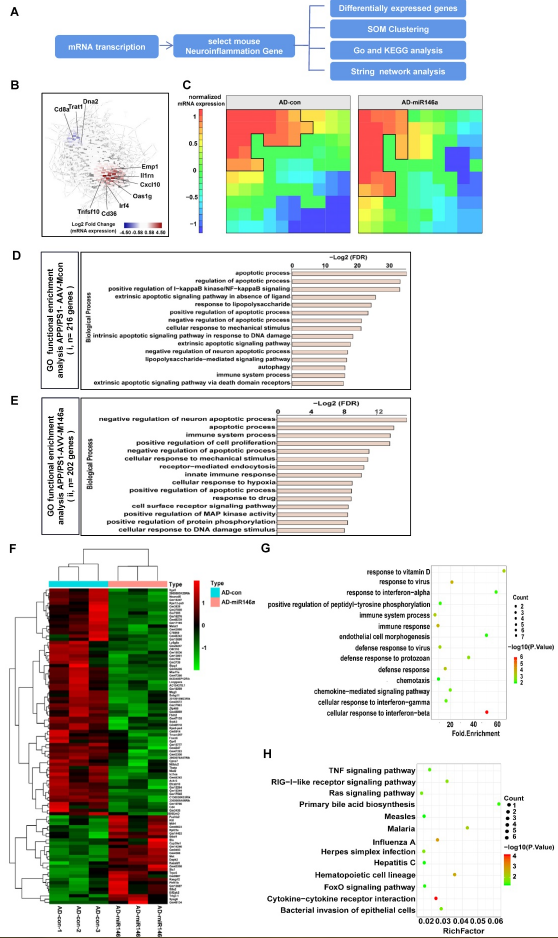
图7鉴定到小胶质细胞过表达miR-146a的小鼠脑内神经炎症相关基因特征
综上所述,本文报道了小胶质细胞特异性miR-146a过表达可能是一种新的有价值的AD治疗方法。在APP/PS1 Tg小鼠中,高水平的小胶质细胞特异性miR-146a表达可减少学习和记忆的认知障碍,减轻神经炎症,降低Aβ水平,并防止神经元丢失。值得注意的是,miR-146a已被证明能增加AD条件下的小胶质细胞转化,降低促炎表型,增加吞噬表型,并保护神经元。本文结果为miR-146a是AD和其他小胶质细胞相关疾病的一个有希望的靶点提供了证据。
参考文献:
Liang Chunmei., Zou Ting., Zhang Miaoping., Fan Weihao., Zhang Tianzhen., Jiang Yuling., Cai Yujie., Chen Feng., Chen Xiongjin., Sun Yuanhong., Zhao Bin., Wang Yan., Cui Lili.(2021). MicroRNA-146a switches microglial phenotypes to resist the pathological processes and cognitive degradation of Alzheimer's disease. Theranostics, 11(9), 4103-4121. doi:10.7150/thno.53418






