适配器SH3BGRL通过促进乳腺癌中PIK3翻译和ATG12稳定性来驱动自噬介导的化疗耐药
获得性化疗耐药是乳腺癌复发的主要原因之一,但化疗耐药的潜在机制仍不清楚。目前,有研究指出一种小接头蛋白SH3BGRL在乳腺癌患者中升高可能是通过自噬增强导致乳腺癌获得性化疗耐药的关键驱动因素,而靶向SH3BGRL可能是一种潜在的治疗策略。该研究于2021年12月发表在《Autophagy》,IF:16.016。
技术路线:

主要研究结果:
1. SH3BGRL上调与乳腺癌不良预后相关
与邻近的正常乳腺癌相比,SH3BGRL mRNA在大多数乳腺癌中上调(图1A,B),SH3BGRL mRNA水平升高的患者总体生存率和无复发生存率较差(图1C-E)。此外,Kaplan Meier Plotter分析显示,SH3BGRL蛋白含量高的乳腺癌患者的总生存期较差(图1F),并且SH3BGRL蛋白在乳腺癌细胞株(图1G)和乳腺癌组织中表达显著上调(图1H)。与正常乳腺细胞MCF-10A和配对的相邻非癌组织相比,差异有统计学意义(p < 0.05)。免疫组化(IHC)发现与相邻组织相比,SH3BGRL蛋白在乳腺癌组织中高表达(图1I, J),验证了SH3BGRL在乳腺癌中的表达上调。综上所述,这些结果提示SH3BGRL上调可能是导致乳腺癌患者预后不良的原因之一。

图1 SH3BGRL上调与乳腺癌预后不良相关
2. SH3BGRL通过自噬保护作用对阿霉素细胞毒性产生耐药性
为了了解SH3BGRL在乳腺癌进展和不良预后中的潜在生理作用,对来自各种公共数据集的乳腺癌患者队列进行了基因集富集分析(GSEA)。GSEA分析表明SH3BGRL表达与阿霉素耐药基因特征的富集呈正相关,但与阿霉素敏感基因特征呈负相关(图2A)。通过对更多乳腺癌患者队列(GSE45827和GSE15852)的分析,SH3BGRL表达也与自噬相关基因特征呈正相关(图2B)。细胞毒性分析显示,过表达SH3BGRL增加了细胞对阿霉素(Dox)的IC50,而敲低SH3BGRL则降低了IC50,而添加CQ抑制细胞自噬可有效中和这一效应(图2C)。流式细胞术和集落形成分析证实,过表达SH3BGRL使细胞对Dox产生耐药性,CQ或3-MA致敏细胞对Dox的细胞毒性阻断细胞自噬(图2D,E)。相比之下,抑制SH3BGRL使细胞凋亡对Dox处理敏感,降低了菌落形成能力,抑制自噬几乎消除了这些差异(图2D,E)。进一步评估了SH3BGRL过表达在皮下异种移植瘤模型中诱导的Dox耐药性,发现即使使用Dox治疗,SH3BGRL过表达也促进MCF-7细胞的肿瘤生长,而SH3BGRL沉默显著增加MDA-MB-453细胞诱导的肿瘤对Dox的敏感性(图2F-H)。因此,SH3BGRL可能具有自噬介导的乳腺癌化疗耐药性。
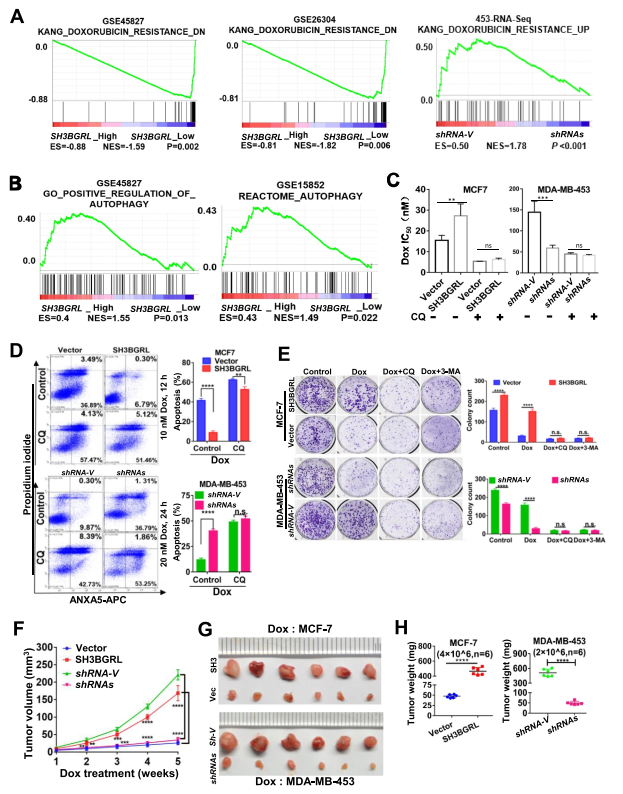
图2 SH3BGRL通过自噬对阿霉素(Dox)诱导的凋亡产生抗性
3. SH3BGRL触发乳腺癌细胞自噬
为了验证SH3BGRL对大细胞自噬的驱动作用,检测两种典型的自噬标志物LC3B和SQSTM1,结果表明,即使在DOX诱导的应激下,过表达SH3BGRL也会降低SQSTM1水平。而SH3BGRL基因敲除增加了乳腺癌细胞的自噬进展(图3A,B)以及相关的LC3B-I到LC3B-II的转变(图3C)。此外,当短时间抑制自噬体-溶酶体融合步骤与巴非霉素A1(Baf A1)以探测释放的自噬通量时,可以观察到在SH3BGRL过度表达的细胞中LC3B-II明显富集,相反,在SH3BGRL敲除的细胞中LC3B-II褪色(图3D,E),表明SH3BGRL诱导自噬通量。免疫荧光染色显示,在MCF-7细胞中,SH3BGRL过表达后LC3B聚集点明显增加,而在MDA-MB -453细胞中,在无血清或无氨基酸的EBSS饥饿条件下,SH3BGRL敲除后LC3B聚集点明显减少(图3F-H),也证实了溶酶体SQSTM1的显著降解(图4A),并且没有明确的MTOR激活与SH3BGRL诱导的自噬有关(图4B)。此外,IHC染色和统计分析表明,与配对的相邻正常组织相比,SH3BGRL高表达患者的总LC3B蛋白水平明显降低(图4C,D)。同时,患者的SH3BGRL蛋白水平与LC3B蛋白水平呈负相关(图4E)。总之,这些结果表明SH3BGRL升高促进乳腺癌细胞的自噬进展。
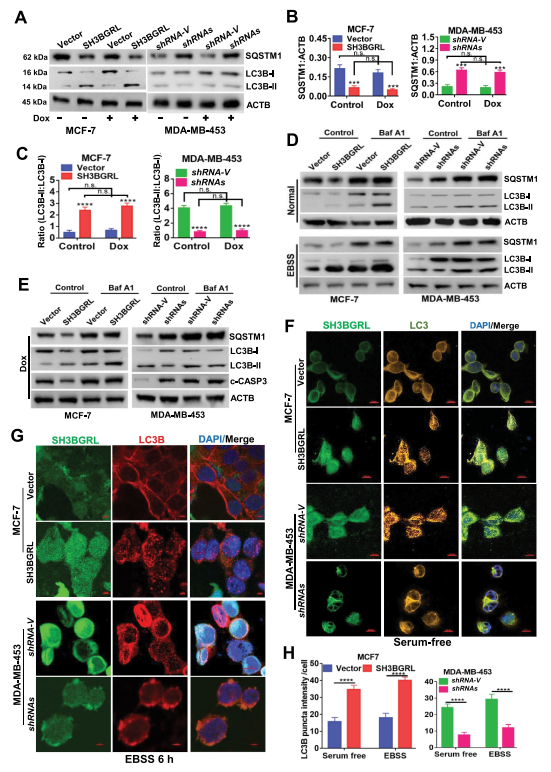
图3 SH3BGRL促进乳腺癌细胞的自噬通量
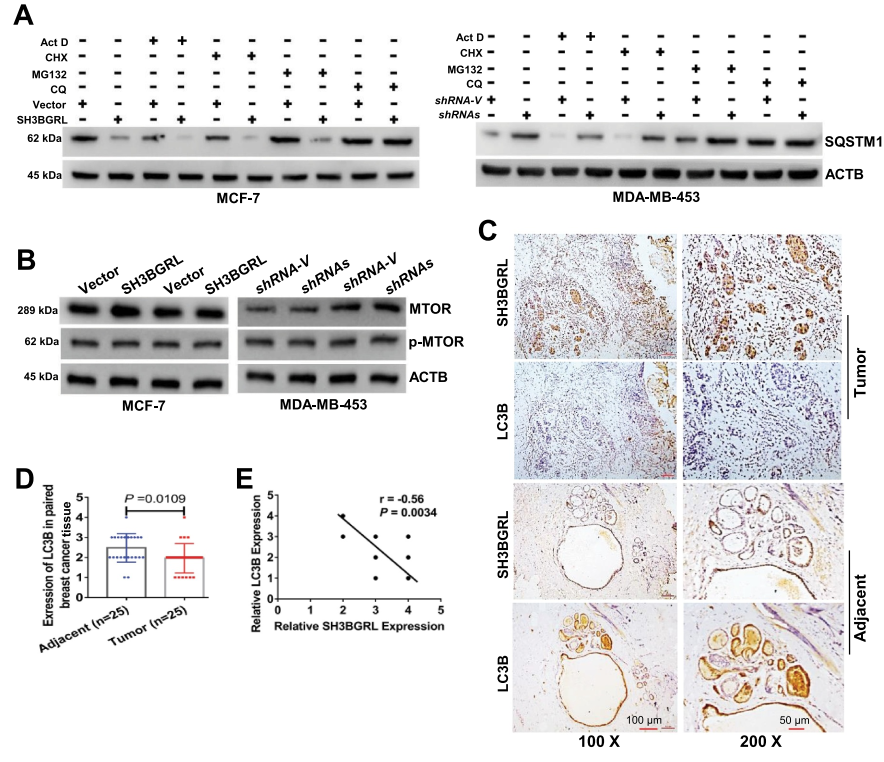
图4 SH3BGRL可使乳腺癌发生自噬
4. SH3BGRL通过与核糖体相互作用,通过PIK3C3翻译增强来驱动自噬
质谱分析法(MS)鉴定显示SH3BGRL与大量的翻译机制蛋白相互作用(图5A)。分析序列中自噬相关基因的翻译效率,发现自噬启动的PIK3C3 mRNA向较轻的部分平移约4次,表明其翻译衰减(图5B)。免疫印迹结果显示,PIK3C3在过表达SH3BGRL的细胞中明显升高,而在敲除SH3BGRL的细胞中明显降低(图5C)。当翻译抑制剂环己酰亚胺(CHX)阻断核糖体翻译后,过表达SH3BGRL的细胞PIK3C3蛋白水平明显恢复到亲本细胞水平(图5D)。进一步在细胞中进行了多核糖体分析,并观察到PIK3C3 mRNA在SH3BGRL高细胞中转移到较重的多核糖体部分(图5E),而在SH3BGRL敲除细胞中,PIK3C3 mRNA又转移到较轻的部分(图5F)。ATG12(图5G)和其他自噬基因的蛋白质变化(图5H)没有部分移位或转录表达变化。综上所述, SH3BGRL至少可以通过与核糖体的相互作用促进PIK3C3的翻译,从而促进乳腺癌细胞自噬。

图5 SH3BGRL通过核糖体相互作用,通过PIK3C3翻译,驱动自噬
5. SH3BGRL也通过维持ATG12的稳定性来促进自噬
SH3BGRL在蛋白质水平上有效地上调乳腺癌细胞中的ATG12 (图6A),但其mRNA水平和所述的翻译事件不起作用。CHX追踪实验表明,SH3BGRL充分降低了MCF-7细胞中ATG12的降解率,而SH3BGRL沉默则加速了MDA-MB-453细胞中ATG12的降解率(图6B)。免疫共沉淀(co-IP)显示SH3BGRL与ATG12和BECN相互作用,但在所有细胞中没有其他自噬相关蛋白(图6C)。为了进一步研究较少SH3BGRL突变体的ATG12可能的蛋白酶体降解,用蛋白酶体抑制剂MG132处理细胞,发现SH3BGRL中的α3螺旋或β3片对SH3BGRL与ATG12的结合仍然至关重要(图6D)。免疫印迹结果显示,阻断蛋白酶体过程、在亲本MCF-7细胞或MDA-MB-453 SH3BGRL敲除细胞中ATG12的表达水平与高SH3BGRL的对应细胞相似(图6E),表明原生体抑制对SH3BGRL的模拟效应。泛素化分析直接表明SH3BGRL过表达细胞中泛素结合的ATG12减少,而SH3BGRL沉默细胞中泛素结合的ATG12增加(图6F)。因此,这些结果表明SH3BGRL可以通过与ATG12相互作用阻止其降解或通过结合并削弱乳腺癌细胞中的ATG12 E3连接酶功能来稳定ATG12,从而平行增强自噬。

图6 SH3BGRL也通过维持ATG12的稳定性来增强自噬
6. PIK3C3和ATG12有助于SH3BGRL介导的阿霉素耐药
为了验证SH3BGRL-PIK3C3/ATG12轴所表征的自噬介导的Dox抗性,我们分别在SH3BGRL过表达细胞中敲除PIK3C3或ATG12(图7A),或在SH3BGRL敲除细胞中强制表达它们(图7B)。流式细胞术分析显示,在SH3BGRL-overexpressing MCF-7的细胞中,内源性PIK3C3或ATG12的额外沉默可显著促进细胞凋亡(图7C),自噬减少(图7D),同时在Dox作用下,PARP和CASP3切割导致细胞凋亡升高(图7E)。同时,这种PIK3C3或ATG12沉默导致细胞活力降低,Dox处理下菌落形成减少(图7F-J)。相反,在SH3BGRL敲低MDA-MB-453细胞中强制表达PIK3C3或ATG12可抑制细胞凋亡,增加自噬水平和Dox耐药(图7A-J),证实自噬在SH3BGRL诱导的化疗耐药中对PIK3C3或/和ATG12上调的重要作用。
通过皮下移植瘤模型进一步评价了SH3BGRL介导的自噬对乳腺癌Dox耐药的生理作用。乳腺癌细胞中,敲低SH3BGRL使肿瘤对Dox治疗显著敏感,导致肿瘤负荷降低,而过表达PIK3C3或ATG12则使肿瘤消退消失(图8A, B)。Dox与自噬抑制剂CQ联合使用可以有效地使MDA-MB-453细胞中SH3BGRL高肿瘤的消退(图8A,B)。去除SH3BGRL能充分抑制Dox作用下的细胞自噬和肿瘤细胞凋亡(图8C,D)。而在SH3BGRRL沉默的肿瘤中,过表达PIK3C3或ATG12可促进自噬,抑制肿瘤细胞凋亡,Dox与CQ联合使用可促进更多的肿瘤细胞凋亡(图8C,D)。此外,SH3BGRL对其他化疗耐药基因没有明显影响,表明SH3BGRL衍生的自噬是化疗的主要原因(图8E,F)。总之,这些结果表明SH3BGRL-PIK3C3-ATG12自噬轴赋予乳腺癌有效的Dox或其他化疗耐药。

图7 PIK3C3和ATG12参与了SH3BGRL介导的阿霉素耐药
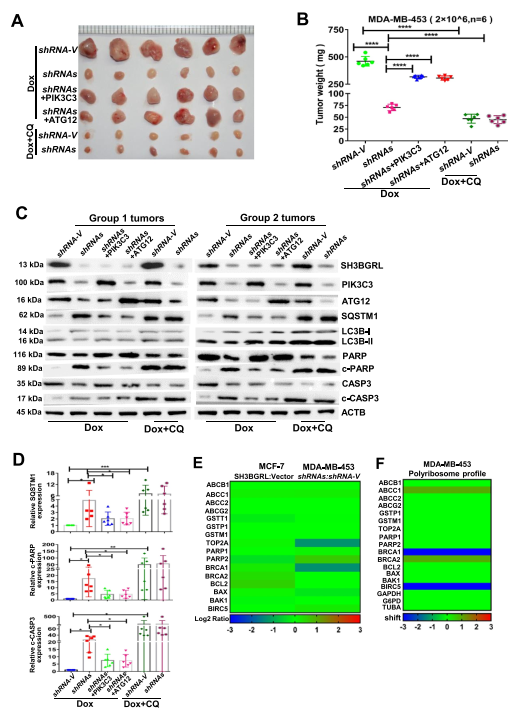
图8 PIK3C3和ATG12有助于致瘤性和Dox耐药
7. 乳腺癌患者SH3BGRL-PIK3C3/ATG12典型自噬的激活
接下来研究SH3BGRL-PIK3C3/ATG12自噬在乳腺癌中的临床意义。对乳腺癌标本进行SH3BGRL、PIK3C3、ATG12和LC3B的免疫组化染色。结果显示,与配对的相邻正常组织相比,SH3BGRL、ATG12和PIK3C3在乳腺癌中协同升高,而LC3B下调(图9A-C)。统计分析显示,SH3BGRL与PIK3C3、ATG12表达呈正相关,与LC3B表达呈负相关(图9D)。免疫印迹进一步验证, SH3BGRL表达与PIK3C3和ATG12呈正相关,与SQSTM1和LC3B呈负相关(图9E-G)。PIK3C3和ATG12 mRNA水平的小于1.2倍的边缘变化也通过其他乳腺癌队列(GSE45827、GSE26304和TCGA数据集)的分析来验证(图9H)。Kaplan Meier Plotter表明,PIK3C3或ATG12水平高的患者乳腺癌患者的5年总生存期、无复发生存期和无转移生存期明显较差(图9I)。以上所有结果通过乳腺癌转移复发和较差临床结果的转录后调节,验证了SH3BGRL-PIK3C3-ATG12自噬轴与乳腺癌Dox化疗耐药的相关性(图9J)。
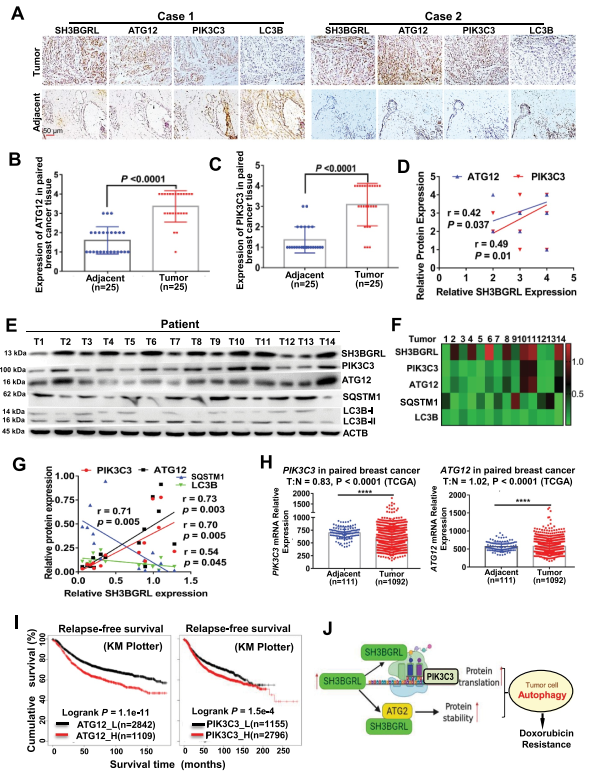
图9 乳腺癌患者SH3BGRL-PIK3C3/ATG12自噬轴的激活
主要结论:
该研究结果至少揭示了SH3BGRL是一种新型耐药基因,通过上调PIK3C3和ATG12,促进乳腺癌自噬介导的Dox耐药。因此,靶向SH3BGRL或其下游关键效应因子将是克服乳腺癌化疗耐药性的可能策略。






