lncRNA TINCR促进肝细胞癌进展,抑制对奥沙利铂的化疗敏感性
lncRNA在肝细胞癌(HCC)的进展和化疗耐药性中起重要作用。深入研究其具体的调控机制对于提供潜在的治疗靶点具有重要价值。本研究旨在探讨lncRNA TINCR在HCC进展和奥沙利铂反应中的调控作用及机制。我们的发现提示,存在一个TINCR/miR-195-3p/ST6GAL1/NF-κB信号转导轴调控肿瘤进展和奥沙利铂耐药,该信号转导轴可能用于肝癌的抗肿瘤治疗。本文于2022年1月发表于杂志“JOURNAL OF EXPERIMENTAL & CLINICAL CANCER RESEARCH”(IF=11.161)上。
技术路线

结果
1)TINCR在HCC中上调,并与患者不良预后相关
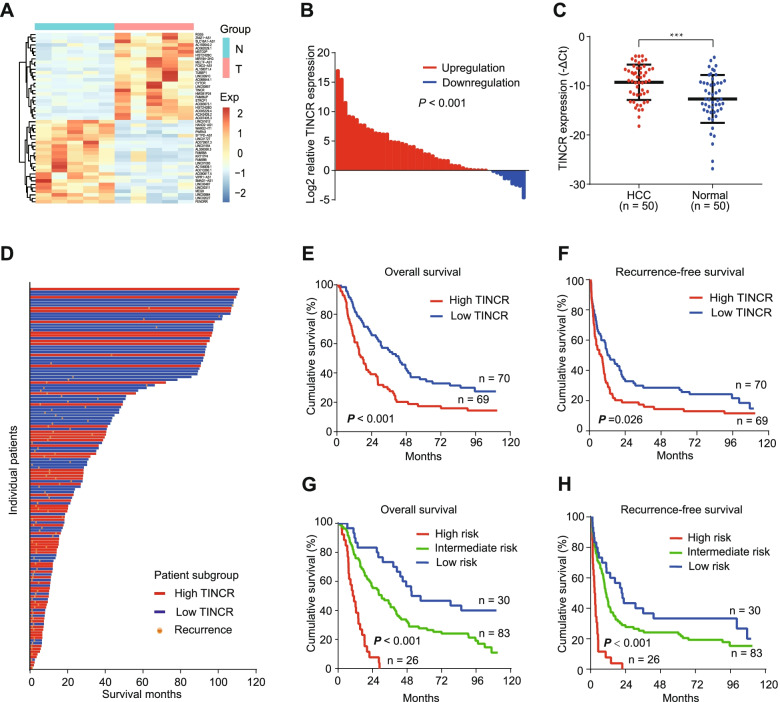
为了识别调控HCC进展的lncRNAs,我们对5例HCC患者的5对肿瘤和正常组织进行了完整的转录组序列。共发现49个不同表达的lncRNA (图1A),其中TINCR是HCC中显著上调的lncRNA之一。此外,我们通过qRT-PCR再次证实,与50个正常组织相比,50个HCC组织中TINCR的表达显著升高(图1B-C)。我们利用qRT-PCR进一步研究了TINCR对139例HCC冷冻HCC组织的预后价值。根据TINCR表达中位数将患者分为高表达组和低表达组。结果显示,TINCR高组患者的总生存期(图1D-E)和无复发生存期(图1F)较差。生存图显示三组患者的总体生存率和无复发生存率有显著的分层(图1G-H)。
2)TINCR促进肝癌细胞增殖、迁移、侵袭和对奥沙利铂的耐药性
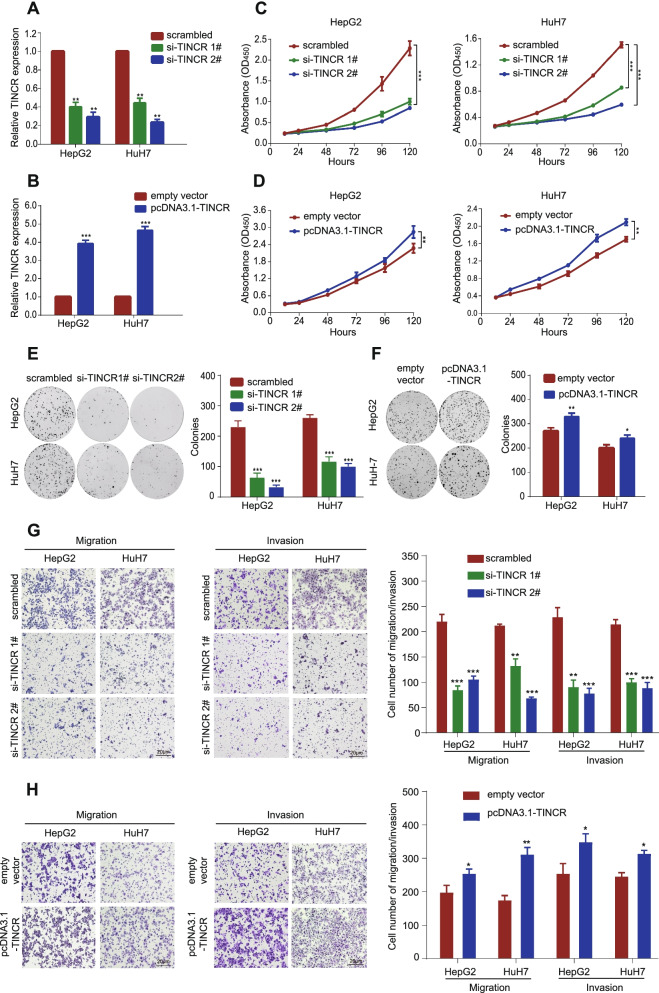
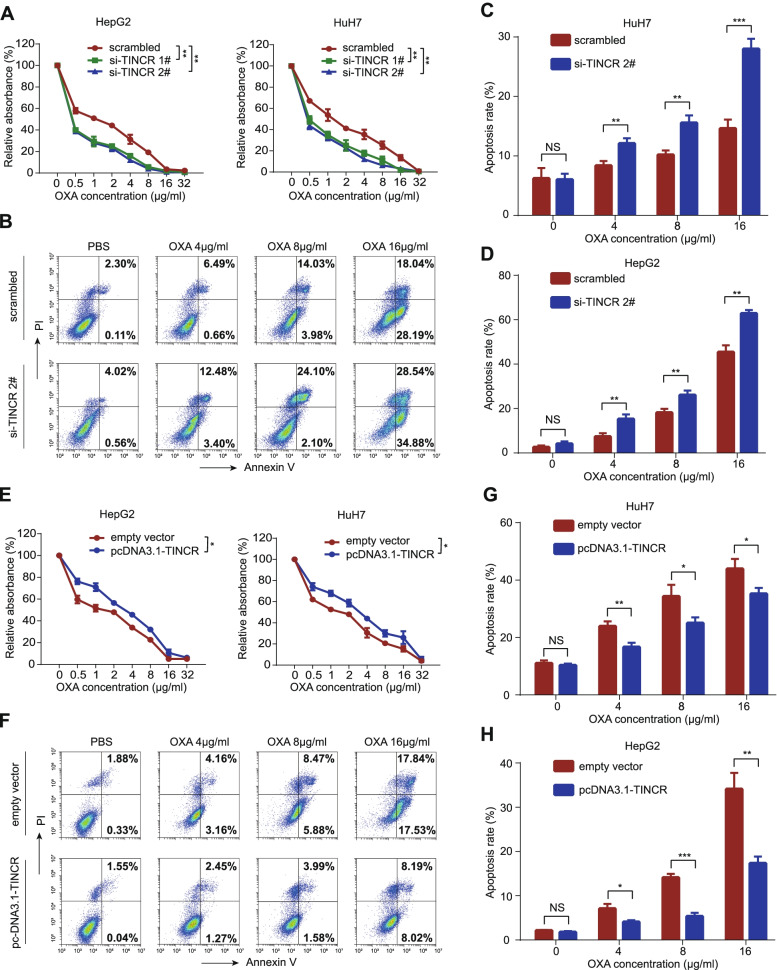
我们在HuH7和HepG2细胞中分别转染了si-TINCR (si-TINCR 1#和si-TINCR 2#)和TINCR过表达质粒(pcDNA3.1TINCR),并采用qRT-PCR检测转染效率(图2A-B)。CCK-8和集落形成实验显示,与对照组相比,转染si-TINCR的HCC细胞的增殖受到显著抑制(图2C和E)。同样,pcDNA3.1-TINCR转染的肝癌细胞与空载体转染的肝癌细胞效果相反(图2D和F)。沉默TINCR可抑制HCC细胞的迁移和侵袭(图2G),而过表达TINCR可增强这些细胞行为(图2H)。此外,我们研究了TINCR在奥沙利铂敏感性调节中的作用。在不同浓度梯度的奥沙利铂下,CCK-8和凋亡检测结果显示,沉默TINCR可显著提高肝癌细胞对奥沙利铂的敏感性(图3A-D)。在过表达的HCC细胞中证实了相反的效果(图3E-H)。这些结果表明,在HCC中,TINCR作为一种促癌lncRNA促进增殖、侵袭和迁移,并诱导对奥沙利铂的敏感性。
3)TINCR作为ceRNA,竞争性地吸收miR-195-3p
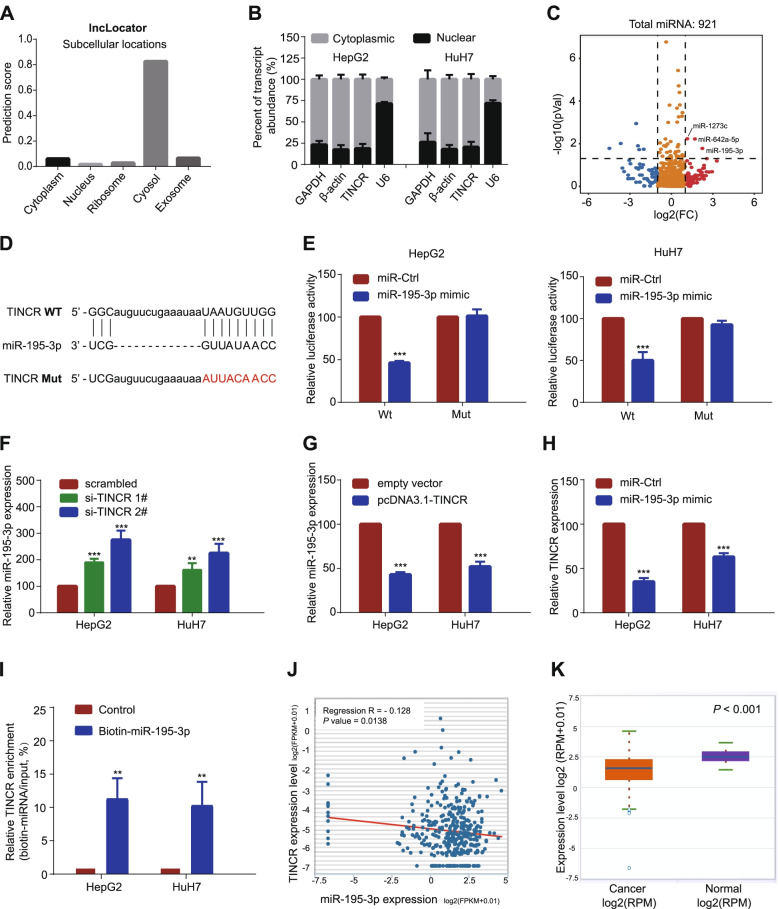
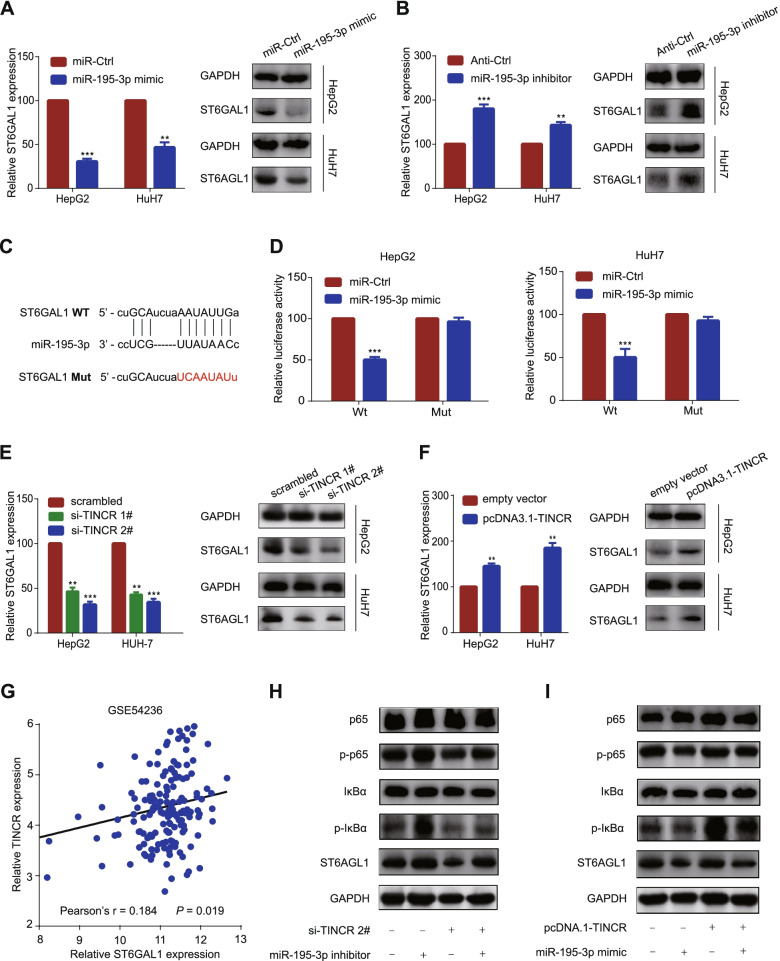
为了揭示TINCR潜在的调控机制,我们首先探索了TINCR在LncLocator中的预测位置。推测TINCR主要位于细胞质中(图4A)。TINCR在细胞核和细胞质中表达的QRT-PCR分析进一步证实了这一结论(图4B)。基于这些结果,我们假设TINCR作为一个ceRNA发挥作用。为了找到结合的miRNA,我们对经TINCR敲除后的HepG2的miRNA进行测序,发现miR-195-3p是显著增加的miRNA之一,其fold change值最大(图4C)。接下来,双荧光素酶报告基因检测显示,过表达miR-195-3p降低了野生型TINCR基因片段的荧光素酶活性,而不是突变型TINCR载体(图4D-E)。我们通过qRT-PCR进一步验证了TINCR和miR-195-3p在HCC细胞中的表达值相反。结果显示,miR-195-3p在TINCR抑制后上调,在TINCR过表达后下调(图4F-G)。相比之下,过表达miR-195-3p时,TINCR下调(图4H)。RNA拉下实验显示,与对照组相比,生物素标记的miR195-3p转染的HCC细胞中,TINCR的表达占总输入量的比例显著升高(图4I)。最后,来自TCGA数据库和Starbase的调查结果表明,miR-195-3p与TINCR呈负相关,并可能作为一种在临床病理特征和生存预测方面与TINCR相反趋势的肿瘤抑制分子(图4J-K)。以上结果提示,TINCR的致癌作用部分是通过miR-195-3p的负调控介导的。
4)TINCR缓解miR-195-3p对ST6GAL1的抑制,增强NF-κ B通路
为了找到miR-195-3p的下游靶蛋白,我们在TargetScan中筛选了累积加权上下文评分小于−0.1的靶基因。在这些预测目标基因,ST6GAL1是可能的候选基因。我们发现ST6GAL1的表达受miR-195-3p变化的影响(图5A-B)。为了验证这种潜在的相互作用,双荧光素酶报告分析显示,过表达miR-195-3p会降低野生型ST6GAL1基因片段的荧光素酶活性,但不会降低突变型ST6GAL1载体(图5C-D)。这些结果表明ST6GAL1是miR-195-3p的靶基因。此外,western blotting结果显示ST6GAL1的表达与TINCR的表达呈正相关(图5E-F),我们进一步用GEO数据集(GSE54236,图5G)验证了这一点。为了寻找潜在的信号通路,基于TCGA数据集进行GSEA分析。结果显示,包括NF-κB通路在内的多个经典通路相关基因组均显著富集了TINCR的高表达。为了验证这一点,进一步的实验结果显示,沉默TINCRs蛋白水平后ST6GAL1降低,IκBα (p-IκBα)和p65 (p-p65)的磷酸化水平降低。抑制miR-195-3p可部分逆转上述作用(图5H)。相比之下,TINCR过表达增加了ST6GAL1蛋白水平以及IκBα (p-IκBα)和p65 (p-p65)的磷酸化水平,而过表达miR-195-3p可部分逆转这一变化(图5I)。基于这些发现,我们提出TINCR通过吸收miR-195-3p上调ST6GAL1,并激活NF-κB通路。
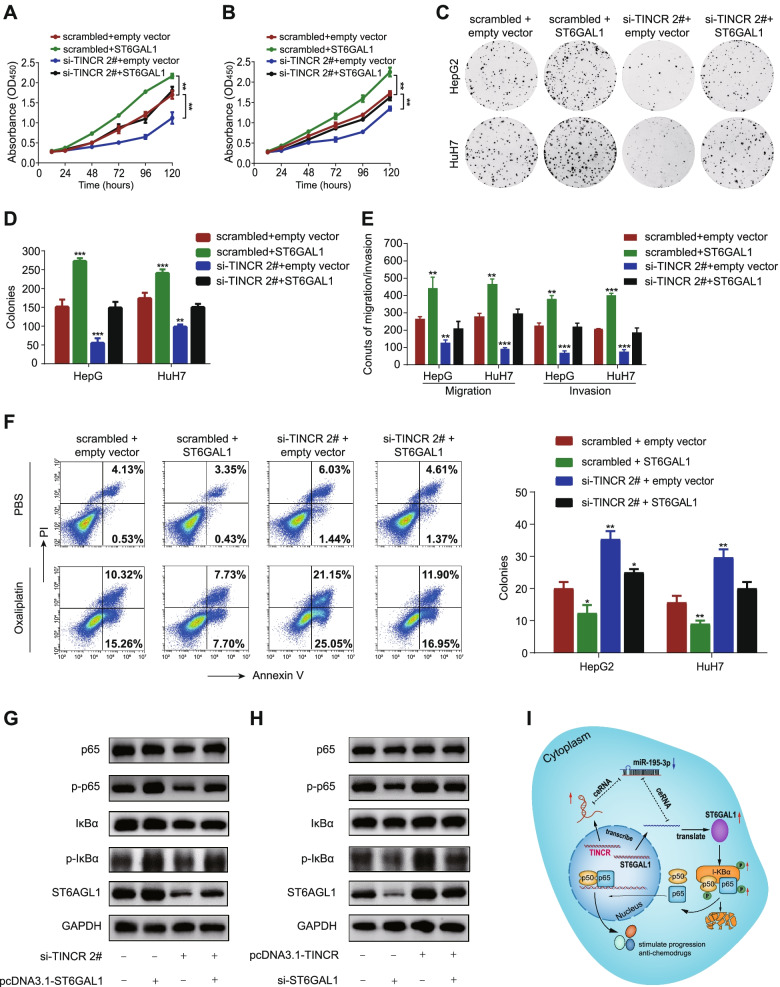
5)ST6GAL1负责TINCR介导的细胞进展和奥沙利铂不敏感
为了证实TINCR介导的ST6GAL1的功能,我们在TINCR敲除的基础上,用ST6GAL1过表达载体或空载体转染HuH7和HepG2细胞。细胞功能检测显示,ST6GAL1表达的恢复在一定程度上挽救了细胞增殖、侵袭和迁移能力的下降(图6A-E),以及奥沙利铂耐药情况(图6F)。此外,ST6GAL1的恢复还部分弥补了IκBα (p- IκBα)和p65 (p-p65)磷酸化减弱的水平,而ST6GAL1过表达则表现出相反的作用(图6G-H)。总的来说,这些发现进一步说明了TINCR通过TINCR/miR-195-3p/ST6GAL1/NF-κB信号通路促进了肝癌细胞进展和对奥沙利铂的耐药(图6I)。
6)在体内,沉默TINCR可损害肝细胞癌的肿瘤发生和对奥沙利铂的耐药性
为了验证TINCR在体内的致瘤功能,将TINCR沉默的裸鼠皮下接种稳定转染的HuH7细胞,建立异种移植小鼠模型。qRT-PCR证实了TINCR基因的下调程度(图7A)。与scramble对照组相比,sh-TINCR组肿瘤大小和重量的生长均受到强烈抑制。sh-TINCR组肿瘤对奥沙利铂治疗的敏感性明显高于ctrl-TINCR组(图7B-D)。同时,ST6GAL1在肿瘤组织中的表达随着TINCR的沉默而降低(图7E-F)。这些数据表明,沉默TINCR可以抑制肝癌细胞增殖和体内奥沙利铂耐药。

结论:本研究确定了TINCR在HCC中是一种致癌lncRNA,并通过TINCR/miR-195-3p/ ST6GAL1调控轴阐明了其在促进肝癌细胞增殖、迁移、侵袭和奥沙利铂耐药中的作用。我们的数据可能有助于更深入地理解与肿瘤进展相关的机制,并有助于开发更有效的肝癌患者化疗的治疗靶点和生物标志物。
参考文献:Mei J, Lin W, Li S, Tang Y, Ye Z, Lu L, Wen Y, Kan A, Zou J, Yu C, Wei W, Guo R. Long noncoding RNA TINCR facilitates hepatocellular carcinoma progression and dampens chemosensitivity to oxaliplatin by regulating the miR-195-3p/ST6GAL1/NF-κB pathway. J Exp Clin Cancer Res. 2022 Jan 3;41(1):5. doi: 10.1186/s13046-021-02197-x. PMID: 34980201; PMCID: PMC8722212.






