来自球状体的外泌体circARM1调控乳腺癌细胞糖酵解
肿瘤干细胞(Cancer stem cells, CSC)是目前临床肿瘤治疗的主要障碍。外泌体是一种包含circRNAs的囊泡,参与细胞与细胞之间的通信。然而,乳腺CSC (BCSC)外泌体的作用仍不清楚,本研究的目的是研究BCSC外泌体中的circRNAs对乳腺癌细胞代谢的重编程。circCARM1在BCSC外泌体中的含量高于亲本乳腺癌细胞中的含量。进一步研究表明,BCSC外泌体circARM1通过miR-1252-5p/PFKFB2在乳腺癌细胞糖酵解过程中发挥重要作用。综上所述,BCSC外泌体来源的circARM1通过海绵吸附miR-1252-5p调控PFKFB2的表达,在乳腺癌细胞糖酵解过程中发挥重要作用。本文于2022年1月发表于Oncogene(IF=9.867)上。
技术路线

结果
为了研究BCSC对乳腺癌细胞功能的影响,我们采用微球形成法扩增BCSC。MDA-231细胞在低附着板的干细胞培养基中培养(图1a)。使用乳腺球分析干细胞特征,发现干细胞标记物CD44、SOX2、OCT4和ALDH1A1在CSC中在转录和转录后水平上的表达水平较高(图1b、c)。为了探索BCSC外泌体在调节癌症细胞功能中的作用,我们制备并观察了来自乳腺癌细胞球(S-exo)或其亲本细胞(P-exo)的外泌体(图1d)。外泌体标记物进行免疫印迹分析(图1e)。当用S-exo或P-exo处理MDA-231细胞时,S-exo处理的细胞比P-exo处理的细胞显示出更多的生存能力(图1f)。为了探索CSC外泌体在调节肿瘤糖酵解和糖酵解能力中的作用,我们使用S-exo或P-exo处理乳腺癌细胞,S-exo处理的细胞比P-exo处理的细胞表现出更高的细胞外酸化率(ECAR)(图1g, h)。经S-exo处理的MDA-231细胞表现出较低的耗氧率(OCR),表明线粒体呼吸受到抑制,ATP生成显著减少(图1i, j)。此外,S-exo培养的癌细胞有较高的糖酵解酶的表达,包括GLUT1、HK2、丙酮酸激酶同工酶M2 (PKM2)、3-磷酸肌醇依赖激酶1 (PDK1)和LDHA(图1k)。这些数据表明CSC-exo增加了癌细胞的有氧糖酵解。

为了研究来自CSC外泌体的circRNA对乳腺癌细胞表型影响,我们制备了S-exo和P-exo来进行circRNA阵列分析。热图显示上调和下调的circRNA有两倍以上的折叠(图2a)。外泌体中最丰富的circRNA长度为200-800 bp(图2b)。circRNA资源显示,78%的circRNA来自外显子(图2c)。在乳腺癌细胞和MCF10A细胞中检测circCARM1的表达,MDA-231、MDA-468、BT549细胞中circCARM1的表达高于其他细胞株(图2d)。circCARM1水平在CSC外泌体中比在P-exo中显著上调(图2e)。检测乳腺癌组织中circCARM1的表达,结果显示65例乳腺癌组织中circCARM1的表达高于癌旁正常组织。circCARM1在乳腺中的平均表达水平较高(图2f))。FISH检测证实乳腺癌组织中circCARM1表达水平高于癌旁正常组织(图2g)。为了进一步确认乳腺癌组织外泌体中circCARM1的水平,我们将新鲜的乳腺癌组织制备成球状以获得外泌体,并收集外泌体(图2h),如图2i所示。结果显示,乳腺癌球形体的外泌体中circCARM1的含量高于相邻正常组织的外泌体(图2j)。结果表明,circCARM1在组织和细胞S-exo中富集,可能在乳腺癌中作为癌基因发挥作用。
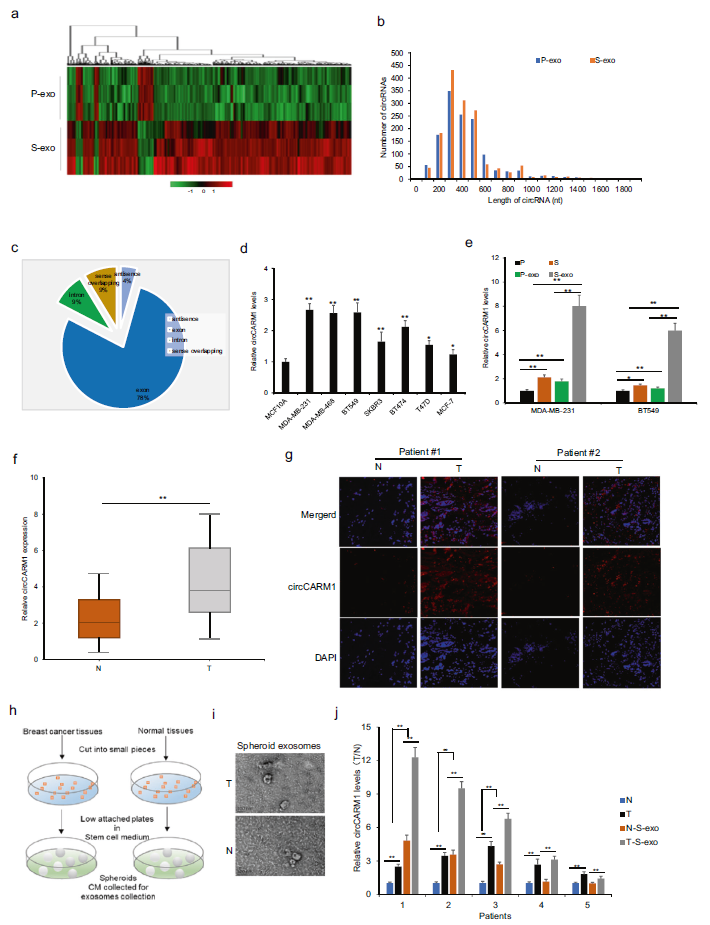
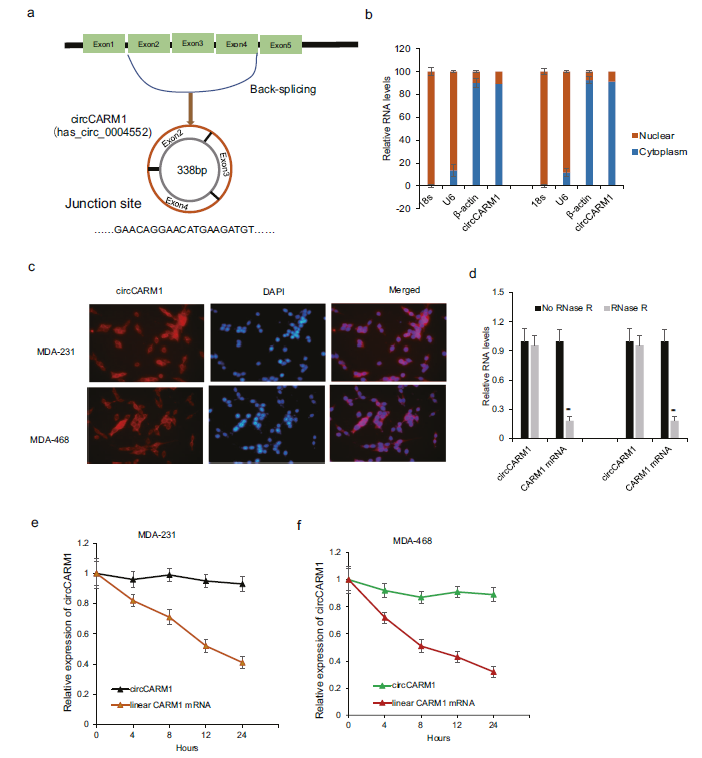
3)circCARM1的环状RNA结构的鉴定及临床特征
CircCARM1 (circ_0004552)源于CARM1基因,该基因位于第3染色体(chr3:157839891-157841780),由基因组长度4257 bp的外显子2、3和4的头尾剪接组成(图3a)。对MDA -231和MDA-468细胞中circCARM1在细胞质或细胞核中的丰度进行qRT-PCR分析,发现circCARM1主要位于细胞质中(图3b)。乳腺癌细胞中circCARM1的FISH分析显示,circCARM1存在于细胞质中(图3c)。为了研究circCARM1是否对RNase R有反应,我们在MDA-231和BT549细胞中对总RNA进行预消化,对RNase R处理后的circCARM1和CARM1 RNA进行qRT-PCR分析,结果表明circCARM1对RNase R有抗性(图3 d)。为了了解circCARM1和CARM1的RNA稳定性,我们用转录抑制剂放线菌素Dat处理细胞,数据显示circCARM1转录物相对于CARM1 mRNA是稳定的(图3e, f)。
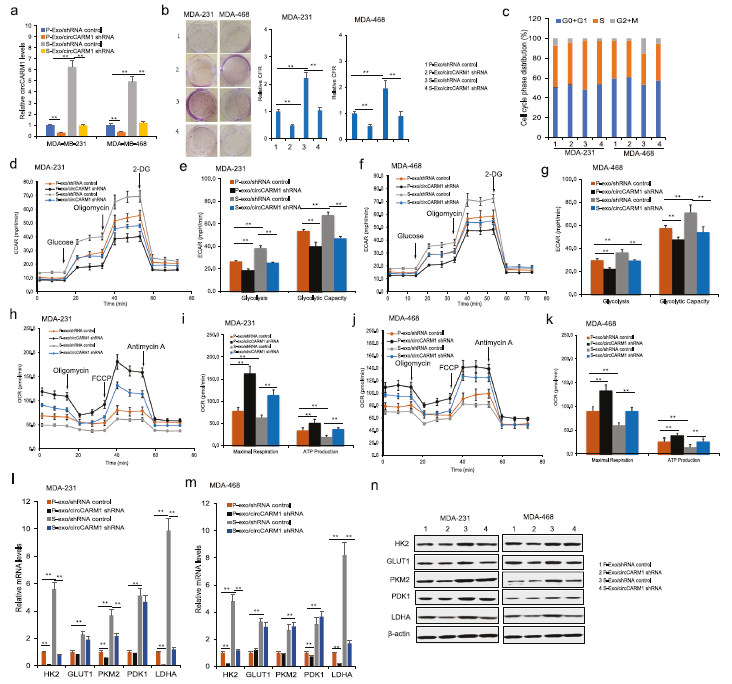
4)来自BCSC外泌体的circCARM1增加了乳腺癌细胞的有氧糖酵解
为了了解来自BCSC外泌体的circCARM1在癌细胞中的作用,circCARM1被慢病毒介导的shRNA敲除(图4a)。在细胞中下调circCARM1后,乳腺癌细胞生存能力受到抑制(图4b)。流式细胞术分析显示,circCARM1下调介导细胞周期相位分布(图4c)。将circCARM1下调的S-exo和P-exo与乳腺癌细胞共培养,评估糖酵解作用。数据表明,通过S-exo处理,ECAR降低(图4d)。在S-exo存在和circCARM1下调的情况下,癌细胞的糖酵解和糖酵解能力被抑制(图4e)。在MDA-468细胞中也有类似的结果(图4f, g)。与P-exo处理的细胞相比,S-exo处理的癌细胞表现出更低的OCR(图4h)、ATP生成和最大呼吸(图4i),然而,抑制外泌体circCARM1则逆转这一结果。在MDA-468细胞中也有类似的结果(图4j, k)。通过实时RT-PCR(图4l, m)和western blotting(图4n),我们还发现糖相关基因在具有circCARM1下调的外泌体的MDA-231和MDA-468细胞中被下调。这些数据表明circCARM1参与了癌细胞糖酵解。
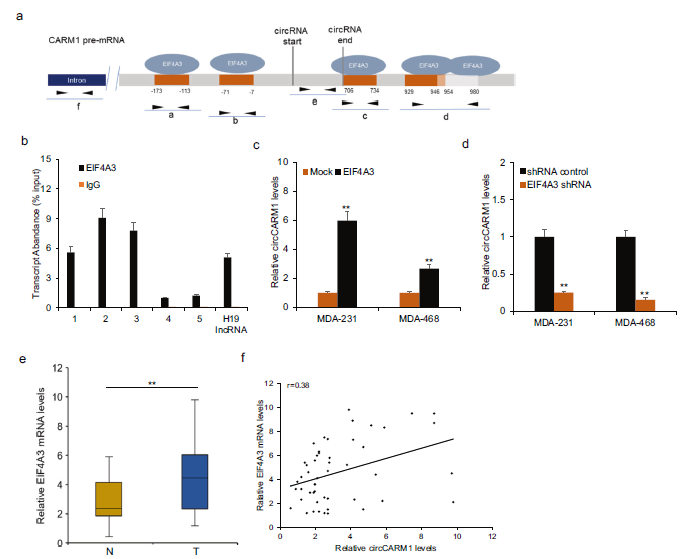
5)EIF4A3调控乳腺癌细胞中circCARM1的表达
为了探究circCARM1的生物发生,circRNA相互作用(https://circinteractome.nia.nih.gov/index.html)显示,在circCARM1 pre-mRNA的上游和下游,EIF4A3有5个结合位点(图5a)。采用RIP验证EIF4A3能通过抗EIF4A3抗体通过这些假定的结合位点与CARM1 pre-mRNA结合(图5b)。此外,qRT-PCR检测显示,过表达EIF4A3促进了circCARM1的表达,而下调EIF4A3则抑制了乳腺癌细胞中circCARM1的表达(图5c, d)。western blot分析显示,在乳腺癌细胞中,敲除circCARM1可以抑制糖酵解相关蛋白的表达,而这种影响可以通过共转染EIF4A3表达载体来逆转(图5e)。临床上,EIF4A3与乳腺癌组织中circCARM1的表达呈正相关(图5f)。这些数据支持了EIF4A3促进circCARM1的生物发生。
6)乳腺癌细胞中circCARM1与miR-1252-5p结合
CircInteractome (CircInteractome .nia.nih.gov)预测了circCARM1和miRNA的相互作用,其中一个潜在的miRNA为miR-1252-5p,并显示了结合位点(图6a)。为了研究潜在的靶miRNA,我们设计了一个生物素化的circCARM1探针,该探针被证实可以拉下癌细胞中的miRNA, miR-1252-5p在乳腺癌细胞中被circCARM1探针大量拉下(图6 b, c)。通过生物素化的miR-1252-5p探针,证实circARM1在MDA-231和MDA-468细胞中被miR-1252-5p拉下(图6d)。通过荧光素酶报告基因检测,miR-12525p过表达显著降低了转染含有完整circCARM1序列的载体的细胞的荧光素酶活性(图6e)。FISH研究显示,circCARM1和miR-1252-5p共定位于乳腺癌细胞的细胞质中(图6f)。乳腺癌组织中miR-1252-5p显著下调(图6g)。Pearson相关分析显示,在乳腺癌组织中miR-1252-5p与circCARM1的表达呈负相关(图6h)。

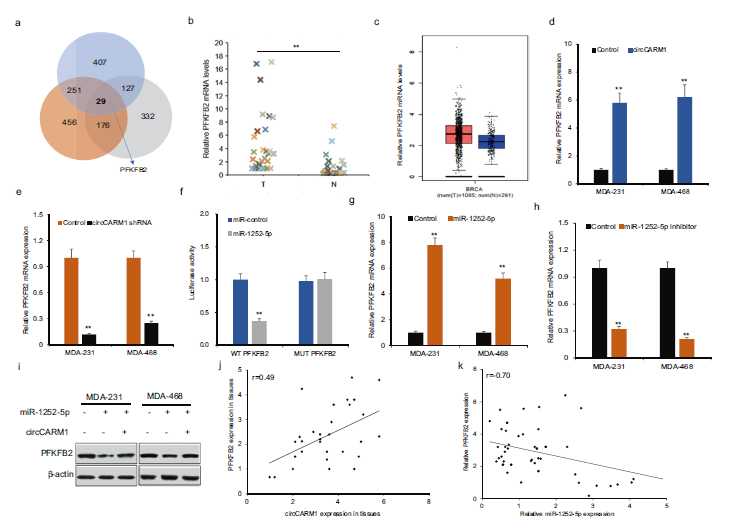
7)circCARM1通过miR-1252-5p调控PFKFB2在乳腺癌细胞中的表达
我们使用目标预测引擎(包括targescan、miRanda和miRWalk)识别候选目标(图7a)。其中,我们选择了10个在乳腺癌中表现出显著表达失调的基因进行进一步研究。实时荧光定量PCR证实PFKFB2在乳腺癌组织中较正常癌旁组织表达上调(图7b)。数据与TCGA数据一致(图7c)。通过异位表达circCARM1可以增加PFKFB2的表达(图7d),通过抑制circCARM1的表达可以降低PFKFB2的表达(图7e)。为了证实miR-1252-5p调控PFKFB2,我们构建了一个基于荧光素酶的报告基因质粒。用miR-1252-5p模拟物和报告质粒共转染细胞可显著降低PFKFB2的荧光素酶活性(图7f)。在miRNA-1252-5p过表达的乳腺癌细胞株中,PFKFB2显著降低(图7g)。PFKFB2通过过表达circCARM1恢复(图7h)。相反,过表达miR-1252-5p后PFKFB2表达下调,circCARM1可部分恢复下调(图7i)。Pearson相关分析显示circCARM1和PFKFB2在乳腺癌标本中的表达呈正相关(图7j)。乳腺癌标本中miR-1252-5p和PFKFB2的表达呈负相关(图7k)。这些结果表明PFKFB2是miR-1252-5p的靶基因,在乳腺癌细胞中受到circCARM1的调控。
8)PFKFB2部分挽救了外泌体circCARM1对癌细胞糖酵解的影响
为了解circCARM1在PFKFB2调控的乳腺癌细胞糖酵解中的作用,乳腺癌细胞外泌体中下调circCARM1或过表达PFKFB2。干扰circCARM1后,细胞生存能力被抑制,PFKFB2可以挽救这种进展 (图8a,b)。细胞集落形成也用于验证结果(图8 c, d)。circCARM1的下调降低ECAR,PFKFB2可以挽救MDA-468和MDA-231细胞ECAR的下降(图8e-h)。经S-exo处理的癌细胞显示出较低的OCR,PFKFB2可以挽救经S-exo/CARM1处理的细胞中OCR的上调(图8i, j)。与对照组相比,缺氧条件下circCARM1过表达导致基底OCR明显降低,最大OCR显著降低。相反,在缺氧条件下,circCARM1的下调导致了基底和最高水平的OCR升高。在另一个细胞株BT549中,结果是一致的(图8k, l)。通过western blotting检测,circCARM1和PFKFB2过表达后,GLUT1、HK2、PKM2等糖酵解标志物增强(图8m)。因此,我们认为来自乳腺癌细胞外泌体的circCARM1增强了PFKFB2调控的细胞糖酵解作用。

9)circCARM1在乳腺癌体内的生物学意义
为了进一步证实来自CSC外泌体的circCARM1在体内促进乳腺癌的作用,我们建立了Balb/c裸鼠乳腺癌原位模型。使用MDA-231细胞与来自circCARM1下调的亲本细胞的CSC外泌体建立模型(图9a)。生长曲线如图9b所示。实时成像显示,circCARM1 shRNA组的平均肿瘤大小远小于sh-NC组(图9c)。S-exo/circCARM1 shRNA组肿瘤的重量比sh-NC组轻(图9d)。我们对小鼠血清中的circCARM1水平进行了评估,发现在S-exo处理的小鼠中circCARM1升高,而在circCARM1下调的小鼠中circCARM1降低(图9e)。将切除的肿瘤进行石蜡包埋切片,检测Ki67、PFKFB2。S-exo/ circCARM1 shRNA小鼠的Ki67、CD44、HK2、PFKFB2和LDHA水平低于对照组(图9f)。结果还显示,在S-exo/circCARM1 shRNA处理的小鼠组织中,PFKFB2的表达被抑制,LDHA和HK2也被下调(图9g)。结果表明circCARM1在促进乳腺癌生长中发挥了重要作用。

结论:该研究表明,乳腺癌细胞或新鲜组织的球状体中的外泌体中circCARM1上调。circCARM1可以作为miR-1252-5p的海绵,在乳腺癌细胞中调节PFKFB2的表达,参与乳腺癌糖酵解。
参考文献:Liu Y, Ma L, Hua F, Min Z, Zhan Y, Zhang W, Yao J. Exosomal circCARM1 from spheroids reprograms cell metabolism by regulating PFKFB2 in breast cancer. Oncogene. 2022 Jan 13. doi: 10.1038/s41388-021-02061-4. Epub ahead of print. PMID: 35027669.






