ENSA拷贝数扩增通过调控胆固醇生物合成促进三阴性乳腺癌的进展
三阴性乳腺癌(TNBC)约占所有乳腺癌病例的10-20%。其特点是雌激素受体(ER)和孕激素受体(PR)表达阴性,HER2无过表达(也可定义为ERBB2无扩增)。与其他形式的乳腺癌相比,TNBC具有更强的侵袭性临床特征,包括起病年龄更小、肿瘤体积更大、肿瘤分级更高、转移潜力更显著。TNBC患者远端复发和5年内死亡的风险增加。作为癌症的一个标志,拷贝数变化(CNAs)在癌症中无处不在。本研究中,作者探索TNBC中新的受CNAs影响的基因。本文于2022年1月发表于《Natural communication》,IF=12。121。
本文技术路线:

本文主要结果:
1、整合DNA拷贝数和转录组分析显示TNBC中1q21。3区域的ENSA扩增
为了确定TNBC中CNAs驱动的基因表达异常,首先根据TNBC队列的CNA数据和RNA-seq数据筛查CNA影响的癌基因。共发现41个基因,其中,ENSA和GOLPH3L是TNBC中最常见的扩增基因(18.5%的患者扩增,57.6%的患者拷贝数增加),位于1q21.3区域(Figure 1a)。在TCGA数据库中,约11%的乳腺癌患者中也发现1q21.3片段扩增(Figure 1b),并且无病生存期和疾病特异性生存期更差(Figure 1c)。作者进一步研究了TCGA队列中不同亚型乳腺癌1q21.3改变的差异。发现TNBC(27.7%)及其亚型(32。6%)扩增较高(Figure 1d)。为了在感兴趣的1q21.3位点中识别潜在的肿瘤促进基因,作者在the Kaplan-Meier plotter数据库中发现ENSA的表达升高,ENSA的高表达与TNBC患者的无复发生存率低有关(Fig 1e,f)。此外,ENSA在肿瘤组织中的表达高于正常组织,在TNBC中随着基因扩增而增加(Fig 1g,h)。这些结果表明,ENSA在1q21.3区域扩增,在TNBC中具有临床预后价值。

Fig1 ENSA在1.21.3区域扩增,呈高表达,预示TNBC生存率较低
2、ENSA促进TNBC细胞的生长
为了确定ENSA在TNBC中的作用,作者用shRNA敲除了ENSA的表达,并在ENSA表达相对较高的两种TNBC细胞系BT549和MDA-MB-231中恢复了ENSA最常见的转录本的表达(Fig 2a)。结果发现,ENSA下调对TNBC细胞生长和集落形成有明显的抑制作用(Fig 2b, c)。此外,过表达ENSA在TNBC细胞中减弱了ENSA沉默对细胞生长和菌落形成的抑制作用(Fig 2d,e)。ENSA下调也明显引起TNBC细胞的凋亡,但对细胞周期进程几乎没有影响(Fig 2f)。这些结果表明ENSA在促进TNBC细胞生长方面具有重要作用。
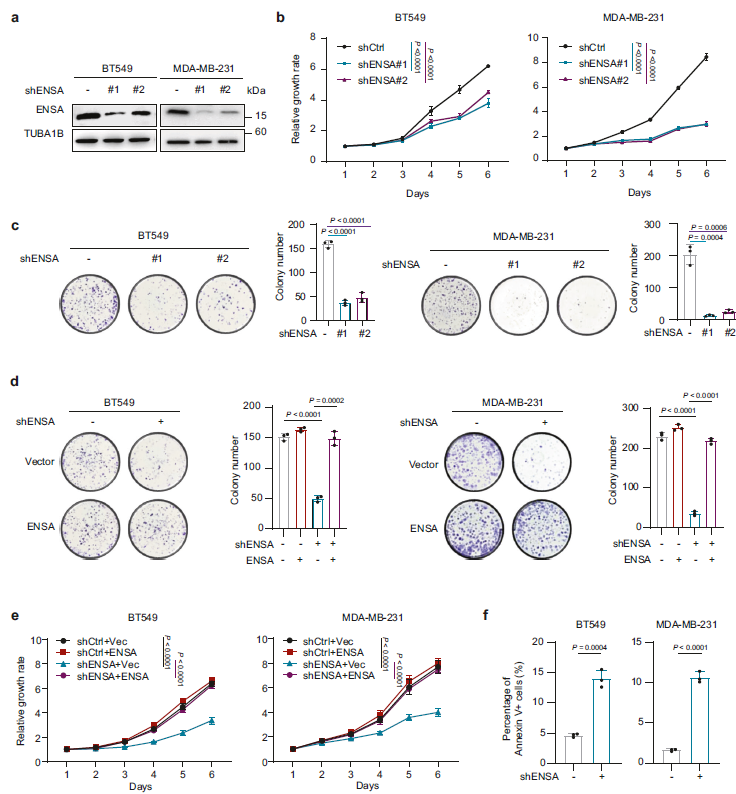
Fig2 ENSA是TNBC细胞生长的主要驱动力
3、ENSA在TNBC中胆固醇的生物合成中起关键作用
为了探讨ENSA的分子机制,作者对ENSA敲除细胞和对照细胞进行了RNA测序分析。基因集富集分析(GSEA)显示,在ENSA沉默的细胞中,胆固醇通路是最富集的下调通路(Fig 3a,b)。此外,GSEA显示ENSA沉默的细胞凋亡通路上调,与ENSA缺失诱导的促凋亡表型一致(Fig 3c)。作者利用基因组变异分析进一步探讨了ENSA表达TNBC队列中胆固醇生物合成通路活性之间的相关性。作者发现ENSA mRNA表达与TNBC中胆固醇生物合成程序之间存在显著的正相关(Fig 3d)。在表达ENSA shRNA的TNBC细胞中检测mRNA和蛋白水平,进一步验证了胆固醇生物合成酶SREBP2(一种优先激活胆固醇生物合成基因的关键转录因子)表达的降低(Fig 3e,f)。重要的是,SREBP2的完整形式和切割形式的蛋白水平都降低了,这与ENSA沉默后SREBP2 mRNA水平的降低是一致的(Fig 3f)。为了确定胆固醇生物合成途径的主要产物是否发生了变化,作者采用液相色谱-质谱联用技术检测胆固醇及其中间代谢物的含量。与胆固醇生物合成相关基因mRNA和蛋白表达下调相一致,ENSA沉默后,TNBC细胞中总胆固醇浓度降低(Fig 3g,h)。此外,ENSA敲除后,TNBC细胞中游离胆固醇含量显著降低(Fig 3i)。接下来,作者研究了ENSA敲除诱导的表型是否与胆固醇消耗有关。发现ENSA敲除的TNBC细胞中,添加胆固醇可部分抑制ENSA缺失细胞的生长,增加细胞凋亡(Fig 3j)。总之,这些发现支持ENSA可能通过调节细胞胆固醇生物合成促进TNBC细胞生长的观点。
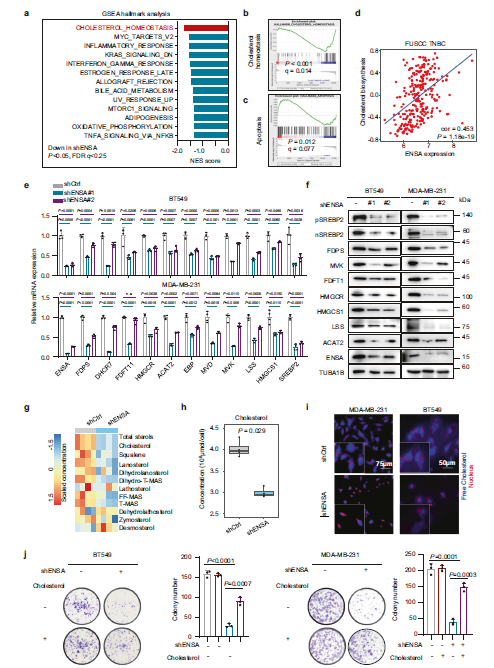
Fig 3 ENSA在TNBC中胆固醇的生物合成中起关键作用
4、激活的STAT3参与ENSA诱导的肿瘤生长
为了阐明ENSA消耗诱导TNBC细胞表型的分子机制,作者对RNA-seq数据进行转录因子(TF)分析并假设STAT3是调控下游的关键转录因子(Fig 4A)。在TNBC细胞中,p-STAT3 (Tyr705),而不是p-STAT3(Ser727)或总STAT3,在ENSA敲除后显著降低(Fig 4b)。ENSA过表达恢复了p-STAT3 (Tyr705)的表达(Fig 4c)。接下来,作者通过在ENSA沉默的TNBC细胞中过表达STAT3,证实了STAT3参与ENSA敲除诱导的生长抑制(Fig 4b)。ENSA过表达恢复p-STAT3 (Tyr705)水平(Fig 4c)。接下来,作者通过在ENSA沉默的TNBC细胞中过表达STAT3来诱导STAT3的组成性激活/磷酸化,证实了STAT3参与ENSA敲除诱导的生长抑制。作者的结果表明,过表达STAT3可以部分减弱ENSA缺失引起的TNBC细胞生长抑制(Fig 4d,e)。在小鼠乳腺脂肪垫异种移植瘤中,ENSA敲除可显著降低MDAMB- 231细胞的肿瘤生长,ENSA过表达可完全挽救MDAMB- 231细胞的肿瘤生长,而STAT3过表达可挽救MDAMB- 231细胞的肿瘤生长(Fig 4f,g)。在免疫组织中,ENSA沉默后,染色p-STAT3 (Tyr705)显著降低。然而,在ENSA敲除的TNBC肿瘤中,ENSA或STAT3过表达均增加p-STAT3 (Tyr705)染色(Fig 4h)。根据体外ENSA缺失诱导的促凋亡表型,在各组异种移植体中cleaved caspase 3的IHC染色表现出相应的变化(Fig 4h)。综上所述,这些数据表明ENSA-STAT3信号在促进三阴性肿瘤生长中发挥了关键作用。
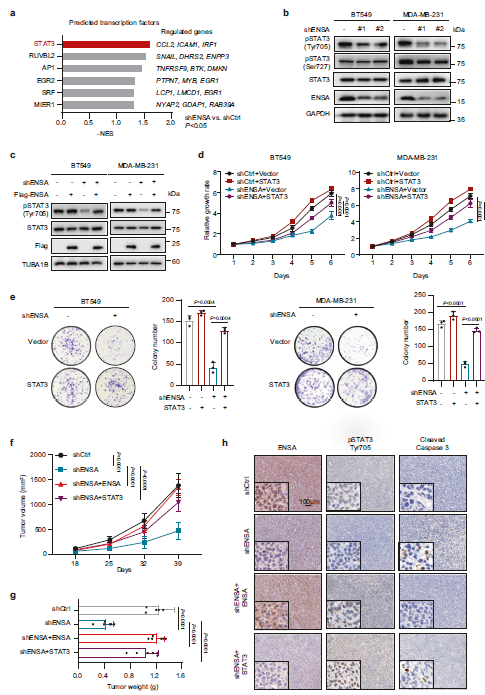
Fig 4 ENSA通过激活STAT3促进肿瘤生长
5、ENSA激活STAT3来调节胆固醇的生物合成
接下来,探讨激活STAT3是否参与了ENSA诱导的胆固醇生物合成途径的改变。JASPAR数据库的预测显示,STAT3可能与SREBP2的启动子结合(Fig 5a)。在 Chip实验中,作者证实STAT3在SREBP2的启动子区域存在一个结合位点(Fig 5b)。此外,在TNBC细胞中沉默STAT3可以抑制SREBP2 mRNA和蛋白的表达(Fig 5c)。这些结果表明,在TNBC细胞中,STAT3可以与SREBP2的启动子结合,并在转录水平上改变SREBP2的表达(Fig 5b)。此外,在TNBC细胞中沉默STAT3可以抑制SREBP2 mRNA和蛋白的表达(Fig 5c)。这些结果表明,STAT3可以与SREBP2的启动子结合,并在转录水平上改变SREBP2的表达。作者接下来验证了启动子的活性,基于荧光素酶报告基因检测,发现SREBP2被ENSA耗尽所抑制,随着STAT3过表达被拯救(Fig 5d)。当ENSA敲低时,SREBP2和参与胆固醇生物合成的酶的表达水平持续下降,但这种效应被STAT3过表达逆转(Fig 5e)。此外,ENSA耗尽后细胞游离胆固醇水平降低,STAT3过表达也可使其恢复(Fig 5f )。
作者下一步探究ENSA敲除对p-STAT3的抑制作用是否依赖于蛋白磷酸酶2A (PP2A),PP2A是一种已知的蛋白磷酸酶,其功能被ENSA直接作用所抑制。作者在MDAMB-231细胞中利用PP2A的靶向siPPP2CA亚基催化PP2A沉默,促进p-STAT3 (Tyr705)表达增加(Fig 5g)。然而,p-STAT3 (Ser727)不受PP2A沉默的影响。此外,ENSA缺失对p-STAT3 (Tyr705)和SREBP2表达的抑制作用被TNBC细胞中PP2A的进一步下调所削弱(Fig。 5h)。这些提示ENSA可能以PP2A依赖的方式促进STAT3磷酸化调控TNBC细胞胆固醇合成。
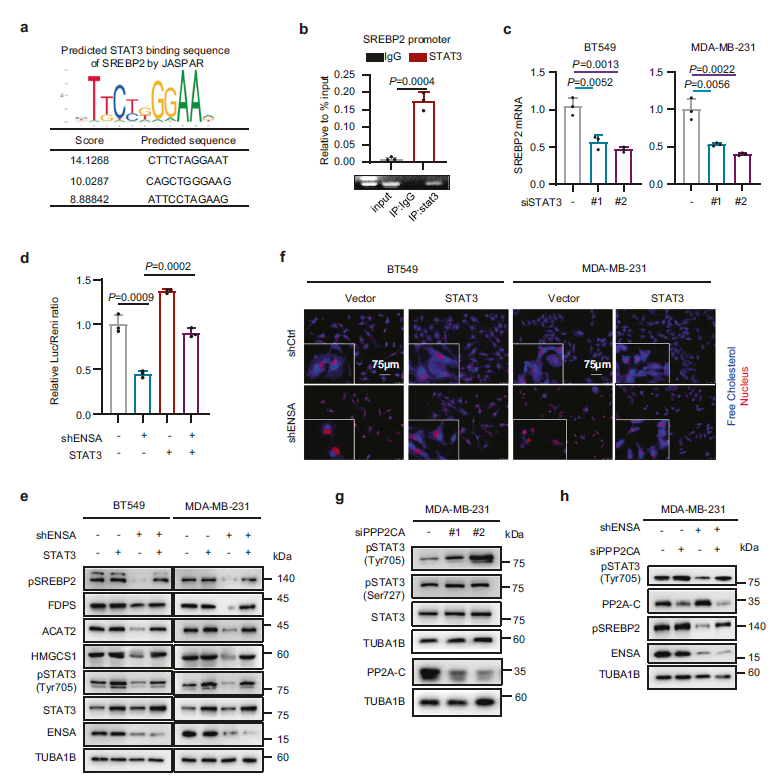
Fig5 ENSA激活STAT3以pp2a依赖的方式促进SREBP2的转录
6、ENSA决定对STAT3抑制剂的治疗敏感性
由于ENSA调节STAT3的活性,作者试图评估ENSA是否可以作为TNBC细胞中STAT3抑制剂敏感性的治疗标志物。作者使用STAT3作为STAT3激活的小分子抑制剂。与ENSA敲除组相比,ENSA水平较高的对照组对抑制剂更敏感,且在抑制剂处理后,增长显著下降(Fig 6a,b)。在3例ENSA表达水平不同的TNBC患者的类器官中,作者也发现类器官对抑制剂的敏感性随着ENSA表达水平的增加而增加(Fig 6c-e)。此外,在异种移植模型中,当ENSA耗尽时,发现TNBC细胞对抑制剂的敏感性显著降低(Fig 6f,g)。为了进一步探讨TNBC患者对药物的反应,作者构建了7个患者来源的小异种移植(mini-PDX)模型,并测量了归一化的抑制剂对治疗的反应(Fig 6h)。结果发现,ENSA高表达的肿瘤的敏感性高于ENSA相对低表达的肿瘤(Fig 6i,j)。总之,作者的TNBC细胞系、类器官、动物模型和mini-PDX模型的结果都表明,ENSA表达可以作为STAT3抑制剂有效治疗的生物标志物。
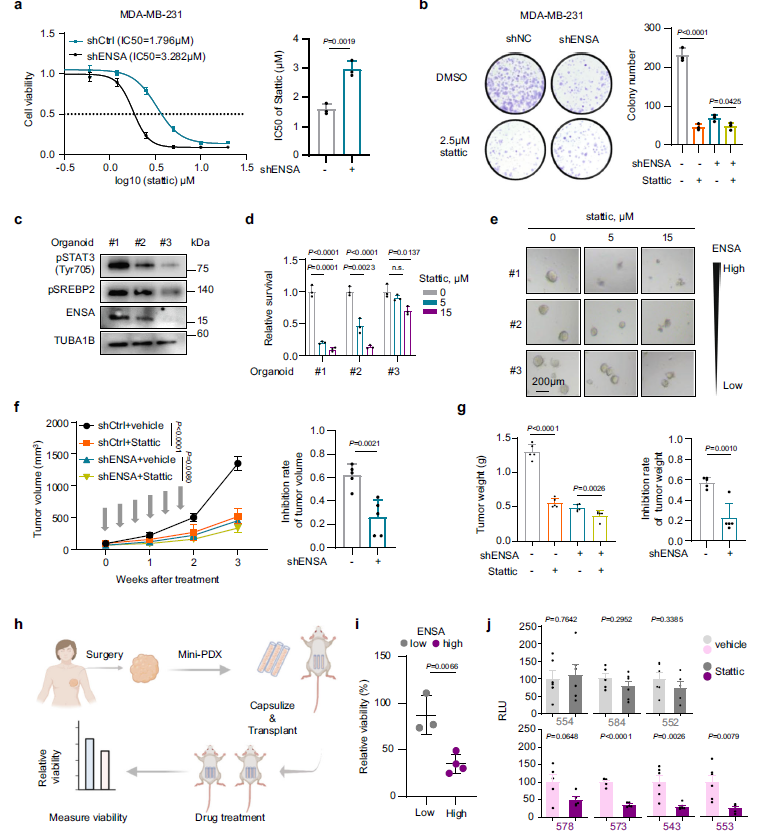
Fig6 ENSA与TNBC中的Stattic抑制剂敏感性有关
7、ENSA、p-STAT3和SREBP2在临床样本和患者预后中的表达相关性
为了探讨作者研究结果的临床相关性,作者首先用免疫组化法检测了8对TNBC原发标本和相邻正常组织中ENSA蛋白的表达水平。结果显示,TNBC标本中ENSA蛋白水平明显高于正常组织(Fig 7a,b)。为了探讨ENSA蛋白表达与患者生存的相关性,作者收集138例TNBC患者的手术标本,通过免疫组化分析检测ENSA蛋白表达水平(Fig 7c)。样本Kaplan-Meier分析显示,ENSA水平高的肿瘤患者的无复发生存期和总生存期往往比ENSA水平低的患者更差(Fig 7d)。作者进一步检测了SREBP2、HMGCR和p-STAT3(Tyr705)的蛋白表达水平。免疫组化结果显示ENSA表达与SREBP2, HMGCR,p-STAT3 (Tyr705)呈正相关(Fig 7f)。总之,这些结果表明ENSA的表达与下游分子的表达呈正相关,在TNBC中是一个不良预后因素。
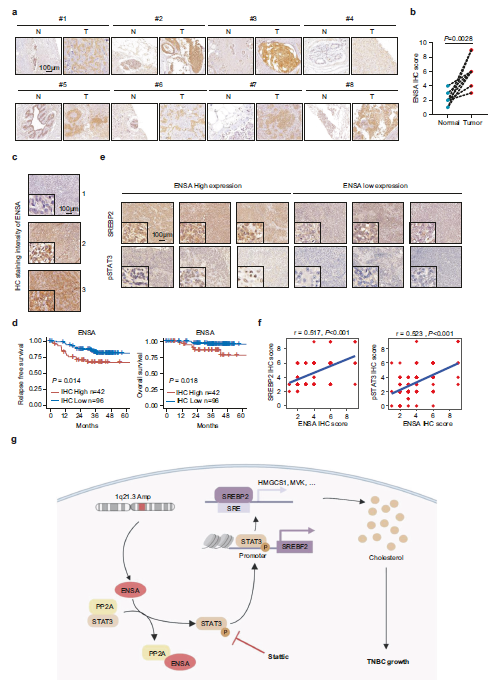
Fig7 ENSA、SREBP2、pSTAT3-Tyr705与临床样本生存率的相关性
本研究表明ENSA,是一个通过促进TNBC中胆固醇生物合成来触发肿瘤生长的基因。ENSA-PP2A-STAT3-SREBP2调控轴表征了其潜在机理。作者认为STAT3抑制剂Stattic可能是治疗ENSA表达的TNBC的重要方法。
参考文献:
Chen, Y.Y., et al., Copy number amplification of ENSA promotes the progression of triple-negative breast cancer via cholesterol biosynthesis. Nat Commun, 2022. 13(1): p. 791.






