昼夜节律基因NFIL3的高表达通过抑制NFKBIA转录而激活NF-κB信号通路,从而促进TNBC的进展
流行病学研究证实,昼夜节律异常与乳腺癌的发生有关。然而,很少有研究探讨节律基因在乳腺癌进展中的病理作用。目前,有研究发现节律基因NFIL3在体外和体内均能促进乳腺癌细胞的增殖和转移,该研究发表在《JOURNAL OF EXPERIMENTAL & CLINICAL CANCER RESEARCH》,IF:11.161。
技术路线:

主要研究结果:
1. NFIL3 mRNA的减少表明,通过筛查乳腺癌节律基因的异常表达,TNBC中NFIL3蛋白升高
作者从基于TCGA数据集和GTEx数据集,搜索GEPIA数据库,研究了32个节律基因在乳腺癌中的异常表达,其中与正常乳腺组织相比,乳腺癌组织中CRY2、NFIL3、PER1、EGR3、NR1D1和TIMELESS 6个节律基因的表达发生了显著变化(图1A)。q-PCR结果验证了这6个节律基因在临床样本的mRNA水平,证实了NFIL3和EGR3在乳腺癌中的异常表达与GEPIA数据库的结果一致(图1B)。EGR3 mRNA在HER2阳性乳腺癌亚型中显著下调,而NFIL3 mRNA在TNBC亚型中特异性低于其他亚型乳腺癌(图1C)。因此,作者选择NFIL3做后续研究。免疫组化评估NFIL3蛋白在TNBC和其他亚型乳腺癌之间的表达,发现NFIL3蛋白在TNBC中的表达明显高于其他亚型乳腺癌(图1D),这与NFIL3在TNBC中的表达模式的mRNA水平相反(图1C)。此外, NFIL3蛋白高表达与TNBC患者预后不良相关(图1E)。
ChIP (图1F)和双荧光素酶报告基因 (图1G)证明NFIL3可以结合NFIL3基因的启动子区域并抑制其转录。这表明NFIL3是NFIL3基因转录的抑制因子,这可能解释了NFIL3在mRNA和蛋白水平上的相反变化。后续作者发现随着外源性NFIL3蛋白的增加,NFIL3的pre-mRNA显著下调(图1I)。这些结果表明,NFIL3是NFIL3转录的一个转录抑制因子,并且NFIL3 mRNA的下降表明癌症中NFIL3蛋白水平的升高。
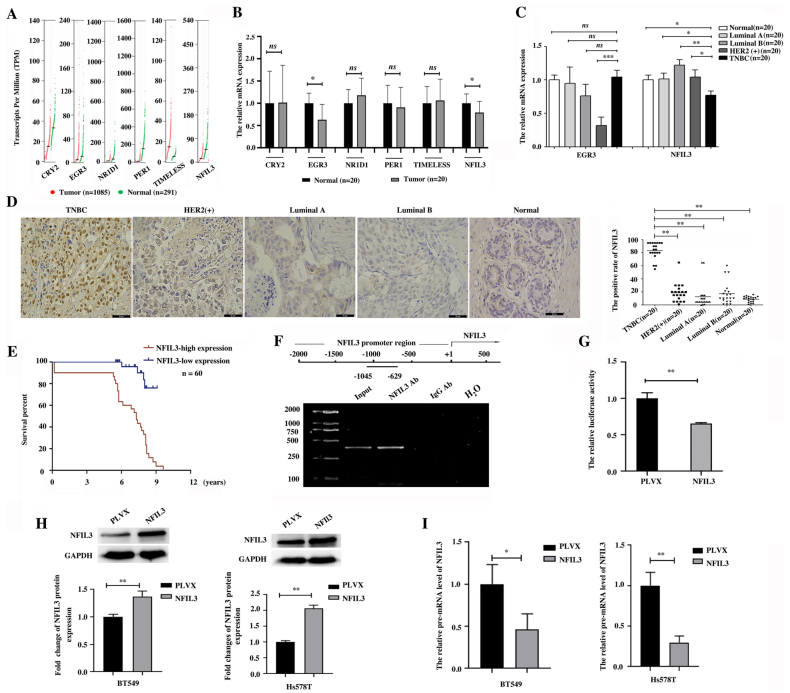
图1 NFIL3 mRNA下降提示TNBC中NFIL3蛋白升高
2. NFIL3蛋白促进TNBC细胞的增殖和转移
为了检测NFIL3蛋白在TNBC进展中的潜在作用,分别通过功能获得和功能缺失实验研究了NFIL3蛋白对两种TNBC细胞株BT549和Hs578T增殖和转移的影响:增加NFIL3蛋白促进Hs578T细胞增殖(图2A-B),而内源性NFIL3基因的下调抑制了Hs578T细胞的增殖(图2C, D);上调NFIL3蛋白可促进Hs578T细胞的生长(图2E),而下调NFIL3蛋白可抑制Hs578T细胞的生长(图2F);过度NFIL3蛋白质促进Hs578T细胞迁移和入侵(图2),而减少NFIL3蛋白抑制细胞迁移和入侵 (图2 j-l);上调NFIL3蛋白可促进Hs578T细胞的肺转移(图2M),而下调NFIL3蛋白可抑制Hs578T细胞的肺转移(图2N)。这些表明NFIL3蛋白可促进TNBC细胞在体外和体内的进展。
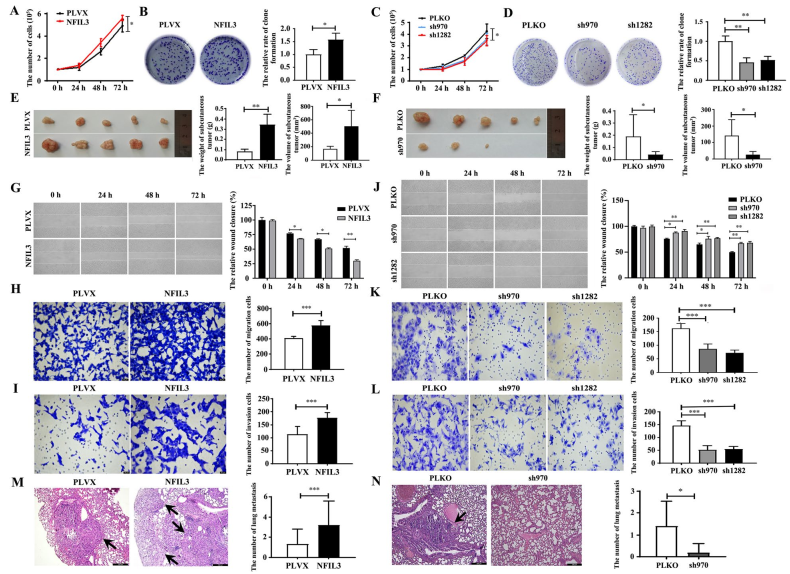
图2 NFIL3促进TNBC细胞在体外和体内的增殖和转移
3. NFIL3调节乳腺癌中的肿瘤相关炎症
作者使用mRNA阵列检测了NFIL3敲除后的整体基因表达变化。功能富集分析表明,下调和上调的基因在炎症中均显著富集(图3A, B)。NFIL3敲除影响的主要炎症通路:先天免疫信号通路和适应性免疫信号通路显著丰富(图3C)。基于TCGA数据集,分析NFIL3 mRNA水平与乳腺癌组织中22个炎性细胞浸润的相关性(图3D-E):NFIL3 mRNA水平与I型巨噬细胞(M1)、CD4+记忆T细胞、CD8+ T细胞、树突状细胞(DCs)、滤泡T辅助细胞、M0细胞和中性粒细胞的浸润水平呈正相关(图3D),而与Treg细胞、II型巨噬细胞(M2)、单核细胞、静息肥大细胞、naïve CD4+ T细胞、γδ T细胞和嗜酸性粒细胞水平呈负相关(图3E)。此外,在60个TNBC组织中检测了NFIL3蛋白水平与浸润M1、M2、CD8+T细胞数量的相关性,证实NFIL3蛋白水平与浸润M2细胞呈正相关,与浸润M1细胞、CD8+T细胞呈负相关(图3F-G)。这些结果表明,NFIL3在乳腺癌中调节肿瘤相关的炎症。

图3 NFIL3调节乳腺癌中的癌相关炎症
4. NFIL3通过抑制TNBC细胞中NFKBIA的表达增强NF κB信号通路的活性
NF-κB信号通路是一个与癌症进展相关的炎症通路,在NFIL3调控的十大炎症信号通路中富集(图3C)。免疫荧光实验中,TNF-α刺激后,NF-κB迅速从细胞质转位至细胞核,NFIL3蛋白的过表达显著增强NF-κB在不同时间点入核的转位,而NFIL3蛋白的减少阻断了NF-κB的核转位(图4A)。随后,双荧光素酶报告基因实验证实,过表达NFIL3蛋白显著增强NF-κB活性,而敲低NFIL3蛋白显著抑制NF-κB活性(图4B)。这些结果表明,NFIL3能有效促进TNBC细胞NF-κB的活化。
考虑到NFIL3是一个转录抑制因子,NF-κB激活的典型抑制因子NFKBIA在NFIL3敲除细胞中显著上调,将NFKBIA作为NFIL3的直接靶点进行进一步研究。采用ChIP试验和双荧光素酶报告基因试验证明,在Hs578T细胞中,NFIL3结合NFKBIA基因(图4C)并抑制其转录(图4D)。NFKBIA在NFIL3过表达细胞中下降,但在NFIL3敲除细胞中,在Hs578T细胞(图4E-F)。此外,免疫组化检测乳腺癌组织中NFIL3和NFKBIA的蛋白水平,发现乳腺癌组织中NFIL3蛋白水平与NFKBIA蛋白水平呈负相关(图4G)。TCGA数据集中NFIL3和NFKBIA的相关性,发现NFIL3 mRNA与NFKBIA mRNA在乳腺癌(图4H)中均呈正相关。这些结果表明NFKBIA是NFIL3蛋白的直接靶点,在TNBC细胞中被NFIL3转录抑制。
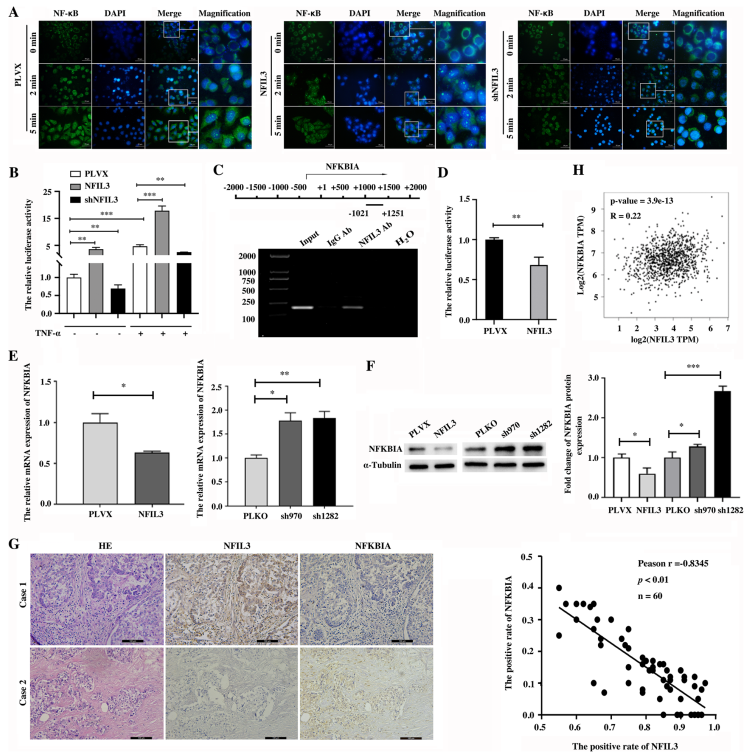
图4 NFIL3增强NF-κB信号通路活性,抑制TNBC细胞中NFKBIA的转录
5. NFKBIA抑制NF-κB信号通路的活性,抑制TNBC细胞在体内外的增殖和转移
NF-κB基因的下调增强了NF-κB从细胞质进入细胞核的易位,而NFKBIA的过表达阻断了Hs578T细胞中NF-κB的核易位(图5A)。NF-κB活性显著增强,而NF-κB过表达显著抑制NF-κB活性(图5B)。此外,基于TCGA数据集,分析NFKBIA mRNA水平与乳腺癌组织中22个炎症细胞浸润的相关性(图5C, D),发现NFKBIA mRNA水平与M1、CD4+ T细胞、CD8+ T细胞和naïve B细胞的浸润水平呈正相关(图5C),而根据TCGA数据集,与乳腺癌组织中M2细胞、静息肥大细胞和嗜酸性粒细胞浸润水平呈负相关(图5D)。通过免疫组化检测,乳腺癌组织中NFKBIA蛋白水平与M1、M2和CD8+ T细胞浸润量的相关性也得到了证实(图5E, F)。这些结果表明,NFKBIA是NF-κB信号通路的抑制因子,与NFIL3不同,它调控TNBC中肿瘤相关的炎症反应。
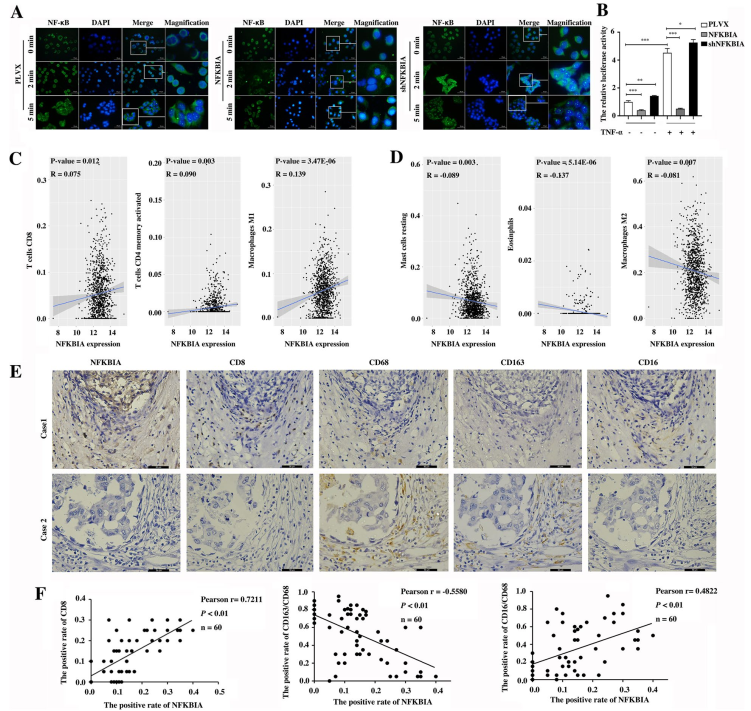
图5 NFKBIA抑制NF-κB信号通路的活性,并与乳腺癌免疫细胞的浸润相关
接下来,通过细胞计数和克隆形成实验,发现过表达NFKBIA抑制了细胞增殖,而下调NFKBIA则促进了Hs578T细胞(图6A-D)。NFKBIA的过表达抑制了皮下Hs578T肿瘤的生长(图6E),而NFKBIA的下调促进了裸鼠皮下Hs578T肿瘤的生长(图6F)。此外,过表达NFKBIA不仅在体外抑制Hs578T细胞(图6G-I)的迁移和侵袭,而且在小鼠尾静脉注射模型中降低Hs578T细胞的肺转移(图6J)。下调NFKBIA基因可促进Hs578T细胞(图6K-M)在体外的迁移和侵袭,并增强Hs578T细胞在体内的转移(图6N)。这些结果表明,NFKBIA与致癌的NFIL3不同,是一种抑制乳腺癌细胞进展的肿瘤抑制因子。

图6 NFKBIA抑制TNBC细胞的增殖和转移
6. NFIL3通过抑制NFKBIA促进NF κB的激活和乳腺癌的进展
为了进一步评价NFKBIA在介导NFIL3对NF-κB激活和TNBC进展的影响中的关键作用,在Hs578T(图7A)细胞中过表达NFKBIA和NFIL3,并检测了NFKBIA和NFIL3过表达对NF-κB活性和乳腺癌细胞株的增殖、迁移和侵袭的影响。在过表达NFIL3的乳腺癌细胞中拯救NFKBIA的表达,可以阻断Hs578T细胞中NFIL3过表达引发的NF-κB从细胞质到细胞核的快速易位(图7B)。双荧光素酶报告实验证实,挽救NFKBIA的表达抑制了NFIL3对NF-κB活性的促进作用(图7C)。NFKBIA的表达部分逆转了NFIL3对Hs578T细胞(图7D)的增殖促进作用,以及对Hs578T细胞(图7E, F)的迁移和侵袭促进作用。这些表明NFIL3通过抑制NFKBIA进而增强NF-κB信号通路的活性,从而促进TNBC的进展。

图7 NFIL3通过抑制NFKBIA,激活NF-κB炎症通路,促进TNBC细胞的增殖、迁移和侵袭
7. 针对NF-κB活性的抗炎策略阻断了NFIL3蛋白在TNBC中的致癌作用
双荧光素酶报告实验检测到,阿司匹林和Bay11-7082不仅显著阻断了NFIL3蛋白介导的NF-κB信号通路的激活(图7G),而且显著抑制了NFIL3对Hs578T细胞增殖、迁移和侵袭的促进作用(图7H-J)。此外,阿司匹林显著抑制了NFIL3对裸鼠Hs578T细胞生长(图7K)和转移(图7L)的促进作用。综上所述,针对NF-κB活性的方法可阻断了NFIL3蛋白在TNBC中的致癌作用。
主要结论:
与正常乳腺组织及其他亚型乳腺癌相比,NFIL3蛋白在TNBC中均升高,并通过抑制NFKBIA的表达,激活NF-κB信号通路,促进TNBC细胞的进展。针对NF-κB活性的抗炎策略阻断了NFIL3在TNBC中的致癌作用。本研究可能为TNBC的防治提供新的靶点。






