LHFPL3-AS2通过与SFPQ相互作用调控TXNIP表达,抑制非小细胞肺癌的转移
肺癌是世界上最常见的癌症,也是癌症死亡的主要原因。除了编码基因外,lncRNA在非小细胞肺癌(NSCLC)中的作用尚不清楚。在这里,我们通过Affymetrix基因芯片人类转录组阵列2.0在37对肿瘤NSCLC组织和邻近非肿瘤组织样本中探索了lncRNA的表达谱。我们发现LHFPL3-AS2是一种新型的lncRNA,在NSCLC组织中明显减少。LHFPL3-AS2在另外93对NSCLC样本中进一步验证。低水平的LHFPL3-AS2表达与NSCLC患者较差的总生存期、TNM分期和转移密切相关。LHFPL3-AS2表达的增强抑制了非小细胞肺癌的体内外侵袭转移。此外,LHFPL3-AS2的下调降低了其与SFPQ的特异性相互作用,使SFPQ更多地结合到TXNIP的启动子上,引起TXNIP的转录抑制,从而最终促进NSCLC细胞的迁移和侵袭。此外,LHFPL3- AS2在缺氧条件下受到EGR1的调控。本文于2022年1月发表于Cancer Letters(IF=8.679)上。
技术路线

结果
1)LHFPL3-AS2作为非小细胞肺癌候选抑癌基因的鉴定
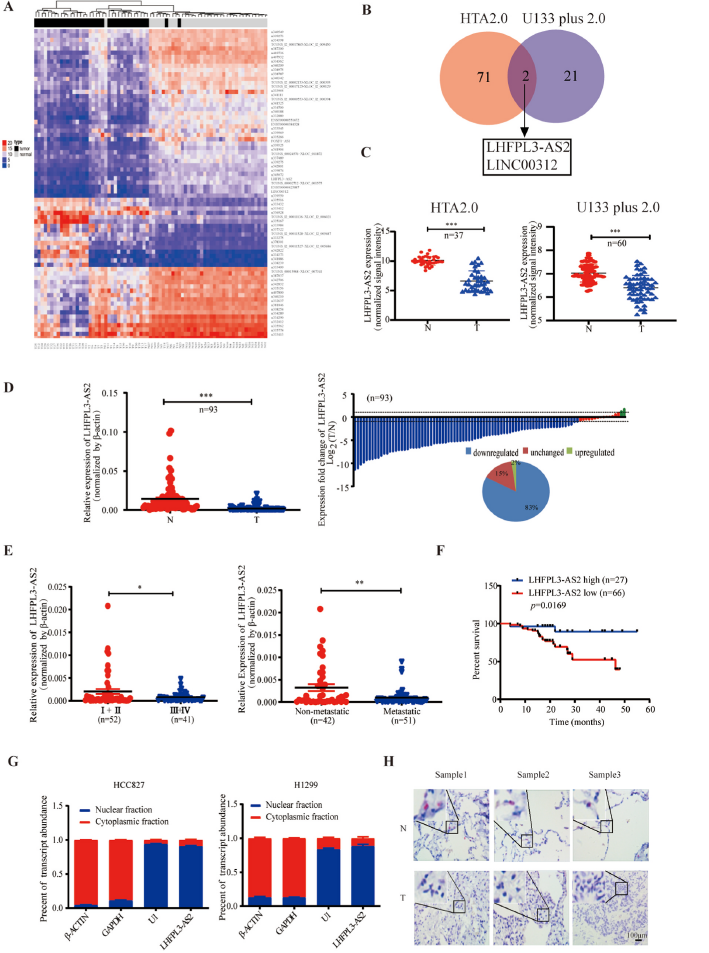
为了研究lncRNA在NSCLC中的潜在作用,我们使用Affymetrix人类转录组阵列2.0 (HTA 2.0)从37对肿瘤NSCLC组织(T)和相应的相邻非肿瘤组织(N)样本中生成了lncRNA谱图。共鉴定出1230个异常的lncRNA,其中fold change≥8或≤-8的lncRNA有73个,被认为是需要进一步分析的NSCLC相关的关键lncRNA(图1A)。为了确定NSCLC中普遍失调的lncRNA,我们采用GSE19804数据分析进行进一步筛选。在GSE19804数据中,我们比较了60对肿瘤NSCLC组织和邻近非肿瘤组织中差异表达的lncRNAs,发现了23个异常表达的lncRNAs。在这些lncRNAs中,有2个在HTA2.0和U133 Plus 2.0 Array分析中始终处于失调状态,其中LHFPL3-AS2在NSCLC中被鉴定为一种新的lncRNA(图1B),同时也被显著下调(图1C)。我们在另外93对非小细胞肺癌样本中证实了LHFPL3-AS2的下调。与相应的非肿瘤组织相比,LHFPL3-AS2在肿瘤组织中显著降低,而在83%的NSCLC组织中观察到LHFPL3-AS2表达下调(图1D)。为了进一步探讨LHFPL3-AS2在非小细胞肺癌中的临床病理和预后意义,我们研究了LHFPL3-AS2与TNM分期、淋巴结或远端转移的相关性。结果显示LHFPL3-AS2表达下调与转移和III/ IV期显著相关(图1E)。此外,LHFPL3-AS2表达水平降低与NSCLC患者的总生存期较差相关(图1F)。亚细胞定位分析显示LHFPL3-AS2主要位于NSCLC细胞的细胞核中(图1G)。RNAscope分析还显示LHFPL3-AS2在细胞核中表达较多,且在肿瘤NSCLC组织中的表达低于相应的相邻非肿瘤组织(图1H)。综上所述,LHFPL3-AS2在肿瘤组织中低水平表达,可能作为非小细胞肺癌的候选肿瘤抑制因子。
2)LHFPL3-AS2在体外和体内抑制NSCLC细胞的迁移和侵袭
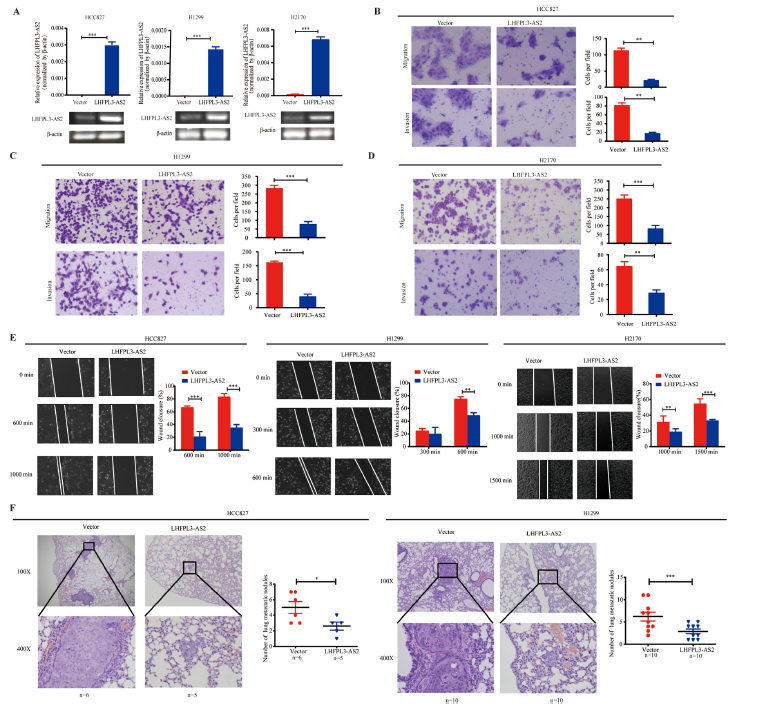
为了阐明LHFPL3-AS2在NSCLC细胞生物学过程中的作用,我们构建了含有LHFPL3-AS2的慢病毒载体,并将其导入HCC827、H1299和H2170细胞中,以建立稳定的LHFPL3-AS2过表达(图2A)。Transwell检测显示LHFPL3-AS2过表达显著抑制NSCLC细胞的迁移和侵袭能力(图2B-D)。伤口愈合检测显示,与载体对照相比,过表达LHFPL3-AS2显著降低了NSCLC细胞的运动能力(图2E)。为了研究LHFPL3-AS2在体内对NSCLC细胞转移的影响,我们将过表达LHFPL3-AS2的HCC827和H1299细胞经尾静脉注射到裸鼠体内。H&E染色分析显示,与载体组相比,LHFPL3-AS2显著降低了肺转移结节数量(图2F)。这些结果表明LHFPL3-AS2在体内外均能抑制NSCLC细胞的迁移和侵袭。
3)LHFPL3-AS2在NSCLC细胞中特异性与SFPQ相互作用
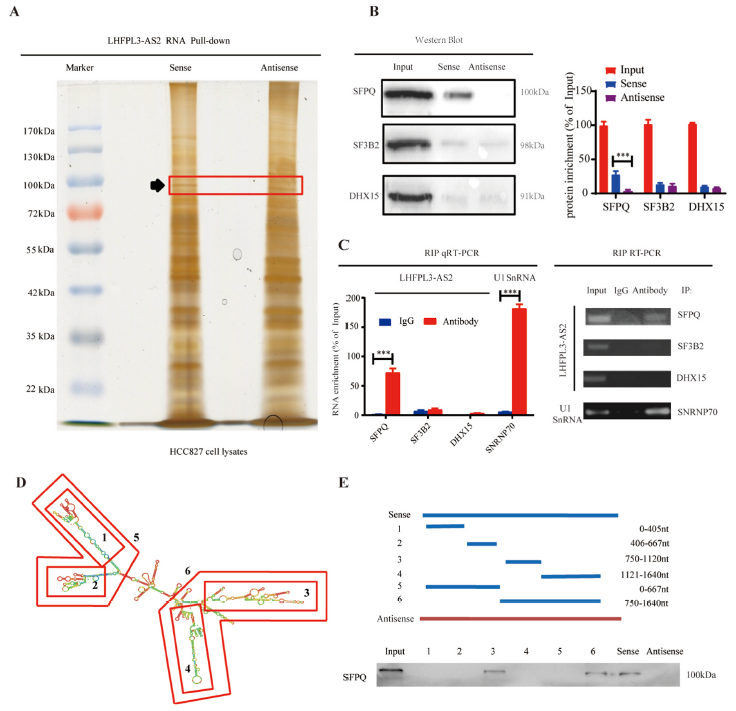
lncRNA通过与不同类型的分子(包括DNA、RNA和蛋白质)相互作用发挥重要作用。结合LHFPL3-AS2主要位于细胞核的证据,我们推测LHFPL3-AS2可能通过与蛋白质相互作用发挥关键作用。我们采用RNA下拉试验来鉴定LHFPL3- AS2相互作用体。LHFPL3-AS2在100 kDa附近富集了一条明显的条带,随后通过质谱分析(图3A)。通过下拉试验获得LHFPL3-AS2的8个潜在的相互作用蛋白。在LHFPL3-AS2样品中SFPQ特异性下降,其次为SF3B2和DHX15。我们通过Western blot分析进一步检查了它们的相互作用,仅SFPQ沉淀(图3B),这也被RIP检测证实(图3C)。我们研究了LHFPL3-AS2的哪一个片段是特异性结合SFPQ所必需的。用RNAfold软件预测LHFPL3-AS2的二级结构,然后将其截断成6个片段,分别进行RNA拉下(图3D)。缺失映射分析发现LHFPL3-AS2的750-1120 nt区域是其与SFPQ相互作用所必需的(图3E),这表明LHFPL3-AS2与SFPQ特异性相互作用。
4)TXNIP作为LHFPL3-AS2调控的下游靶点的鉴定
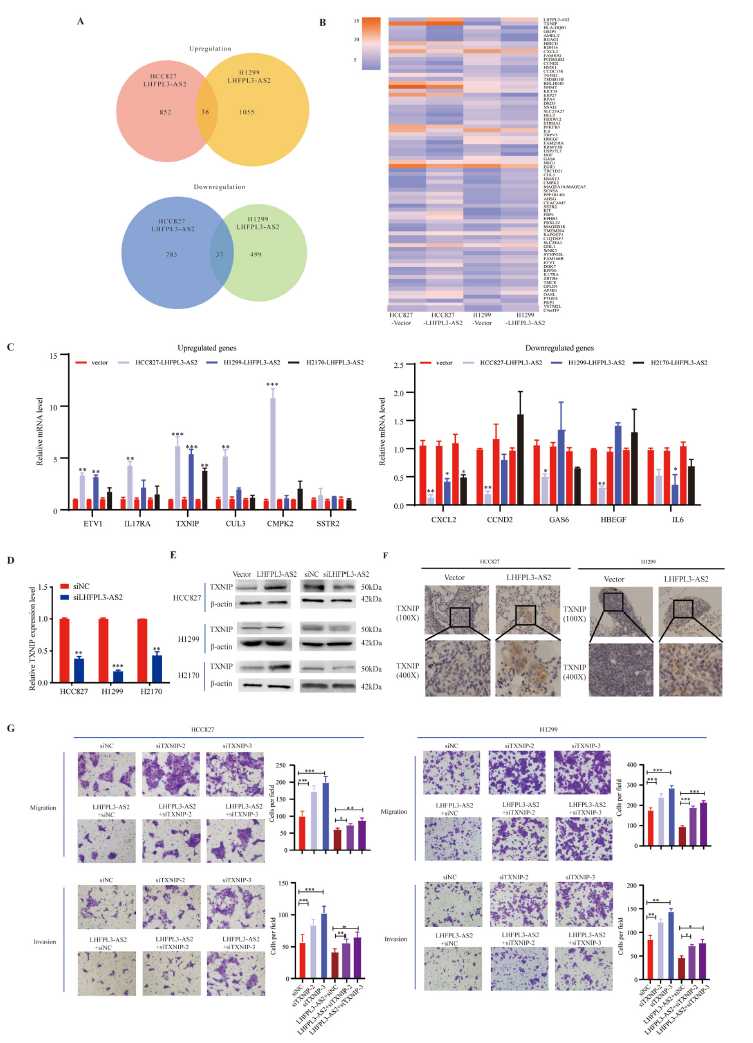
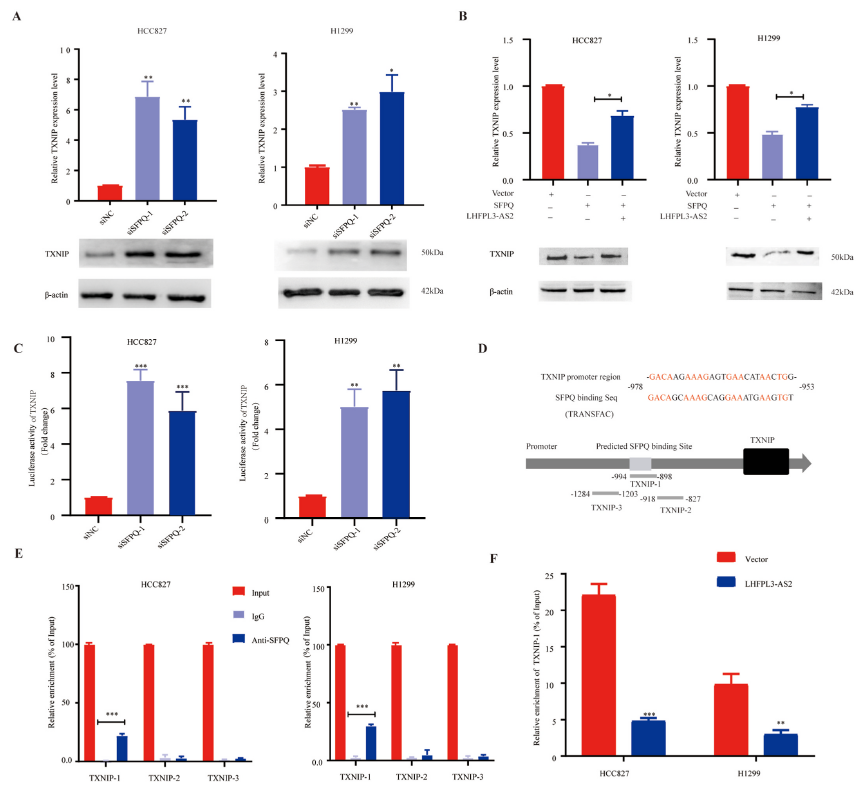
为了了解LHFPL3-AS2参与NSCLC转移的分子机制,我们使用了Agilent SurePrint G3人类基因表达V2阵列来评估LHFPL3-AS2过表达的NSCLC细胞的转录谱。LHFPL3-AS2的上调分别改变了HCC827和H1299细胞中1708和1627个基因的表达,其中73个基因在两种细胞中共失调,包括36个上调基因和37个下调基因(图4A)。然后我们集中研究了73个共失调基因(图4B)。在这些基因中,11个表达差异最大的基因与肿瘤生长和转移 (ETV1、TXNIP、CLU3、CMPK2、SSTR2、CCND2、GAS6和HEBEGF),以及细胞因子和细胞因子受体(IL17RA、CXCL2和IL6) 相关。我们进一步通过qRT-PCR证实了这些被选择的基因在LHFPL3-AS2过表达的HCC827、H1299和H2170细胞中的mRNA水平(图4C)。TXNIP在三种LHFPL3-AS2过表达的NSCLC细胞系中均显著上调。敲低LHFPL3-AS2显著降低了TXNIP的mRNA水平(图4D)。通过Western blot分析验证LHFPL3-AS2对TXNIP蛋白水平的影响,与其对TXNIP mRNA的影响一致(图4E)。此外,通过分析TXNIP在裸鼠肺样品中的表达,IHC数据显示LHFPL3-AS2增强了TXNIP的表达(图4F)。沉默TXNIP显著促进迁移和侵袭,而促进作用随着LHFPL3-AS2表达的增加而减弱(图4G)。
5)LHFPL3-AS2通过消除SFPQ介导的转录抑制促进TXNIP的表达
SFPQ是一种多功能核蛋白,参与RNA加工、RNA剪接和转录调控。为了研究LHFPL3-AS2如何调控TXNIP的表达,我们在转染SFPQ siRNA后检测了TXNIP在NSCLC细胞中的表达。我们观察到SFPQ的沉默导致TXNIP表达的增加(图5A)。此外,SFPQ过表达显著抑制TXNIP的表达,但这种效应可以通过提高LHFPL3-AS2的表达来逆转(图5B)。这说明LHFPL3-AS2可以通过SFPQ调控TXNIP的表达。SFPQ的主要生物学作用之一是转录抑制,因此我们进行了TXNIP启动子荧光素酶报告研究以进一步分析。SFPQ的下调刺激了NSCLC细胞中TXNIP启动子的荧光素酶活性(图5C),表明SFPQ抑制了TXNIP启动子的转录。通过TRANSFAC软件预测SFPQ结合基序。生物信息学分析表明,SFPQ可能结合TXNIP启动子−978~-953 nt区域。因此,我们围绕该区域设计了3对引物,用于后续的ChIP检测(图5D)。ChIP实验验证了SFPQ与TXNIP启动子−994~-898 nt区域直接结合,如图5E所示。此外,我们发现当NSCLC细胞转染LHFPL3-AS2时,在SFPQ结合区TXNIP的富集程度较低(图5F)。这些观察结果表明,SFPQ与TXNIP启动子结合抑制TXNIP的转录。因此,LHFPL3-AS2可以特异性地与SFPQ相互作用,导致SFPQ介导的TXNIP的转录抑制降低。
6)LHFPL3-AS2受EGR1调控
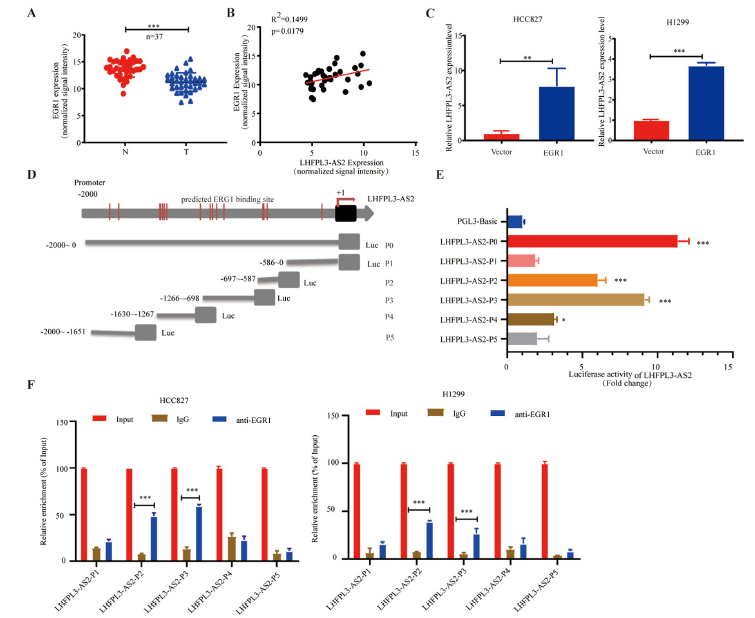
为了探索NSCLC中LHFPL3-AS2表达的影响机制,我们首先利用MethPrimer Prediction和Mexpress Prediction分析了LHFPL3-AS2启动子区域的DNA甲基化状态。我们在LHFPL3-AS2启动子上没有发现CpG岛,这表明DNA甲基化可能与NSCLC中LHFPL3-AS2的下调无关。我们推测可能与转录因子有关。利用在线转录因子预测软件JASPAR对LHFPL3-AS2启动子区域的2000个碱基对进行分析。在这里,我们发现了16个潜在的EGR1结合位点。与相邻的非肿瘤组织相比,非小细胞肺癌组织中EGR1的表达也下调(图6A),这与LHFPL3-AS2的表达呈正相关(图6B)。因此,我们评估了EGR1是否可以调控LHFPL3-AS2的表达。结果显示,EGR1表达的增强促进了LHFPL3-AS2的上调(图6C)。根据JASPAR预测的EGR1结合位点,我们将LHFPL3-AS2启动子片段构建到荧光素酶报告基因中(图6D)。在P2(−697~-587 nt)和P3(−1266~-698 nt)的LHFPL3-AS2启动子区域检测到强荧光素酶活性信号(图6E)。根据JASPAR的预测,LHFPL3-AS2-P2区域包含3个推测的EGR1结合位点,而LHFPL3-AS2-P3区域包含5个推测的EGR1结合位点。随后的ChIP分析证实了这两个片段中EGR1的直接相互作用(图6F)。以往的研究表明,EGR1受缺氧调节。因此,我们检测了缺氧处理后不同时间点EGR1 mRNA水平。结果显示,1% O2处理NSCLC细胞24小时后,EGR1表达迅速下降。然后我们检测缺氧条件下LHFPL3-AS2的表达,其表达与EGR1相似。HCC827细胞缺氧48 h、H1299细胞缺氧72 h后LHFPL3-AS2也显著降低,说明LHFPL3-AS2在缺氧条件下可能受到EGR1的调节。
结论:我们的研究结果为我们对NSCLC转移的理解提供了新的见解,LHFPL3-AS2是NSCLC的潜在靶点。
参考文献:Cheng Z, Lu C, Wang H, Wang N, Cui S, Yu C, Wang C, Zuo Q, Wang S, Lv Y, Yao M, Jiang L, Qin W. Long noncoding RNA LHFPL3-AS2 suppresses metastasis of non-small cell lung cancer by interacting with SFPQ to regulate TXNIP expression. Cancer Lett. 2022 Jan 29;531:1-13. doi: 10.1016/j.canlet.2022.01.031.






