心律失常性心肌病的潜在新疗法:crenolanib药物抑制PDGFRA
FLNC截断突变(FLNCtv)是遗传性扩张型心肌病(DCM)的常见病因,是发展成心律失常性心肌病的高危因素。本研究结果表明,PDGFRA信号通路与DCM发病机制有关,抑制该通路可能是flnc相关心肌病的一种治疗策略本研究于2022年2月发表在《Science Advances》IF:14.136杂志上。
技术路线:

主要研究结果:
1、使用患者特异性多能干细胞来源的心肌细胞(iPSC-CMs)构建FLNC-相关DCM模型
作者从FLNCG1891Vfs61X和FLNCCE2189X的DCM患者身上分离出iPSC细胞,然后诱导成iPSC-CMs,并探究其电生理学属性,结果显示与健康对照组相比,FLNCtv患者的iPSC-CMs均表现出较弱的收缩性和较慢的放松性(Fig. 1 A and B)。两种患者特异性iPSC-CMs也表现为自发性心律失常(Fig. 1 C)。与对照组iPSC-CMs相比,心律失常表型也表现为心率的较大变异(Fig. 1 D)。为了进一步验证心律失常的表型,检测了健康和iPSC-CMs患者的动作电位(AP)形态。与收缩数据一致,40%的FLNCG1891Vfs61X和36%的FLNCCE2189X 的iPSC-CMs与对照iPSC-CMs相比出现异常AP形态(Fig. 1 E and F)。总之,这些数据表明,FLNC患者iPSC-CMs概述了体外与FLNC相关的DCM相关的心律失常表型。
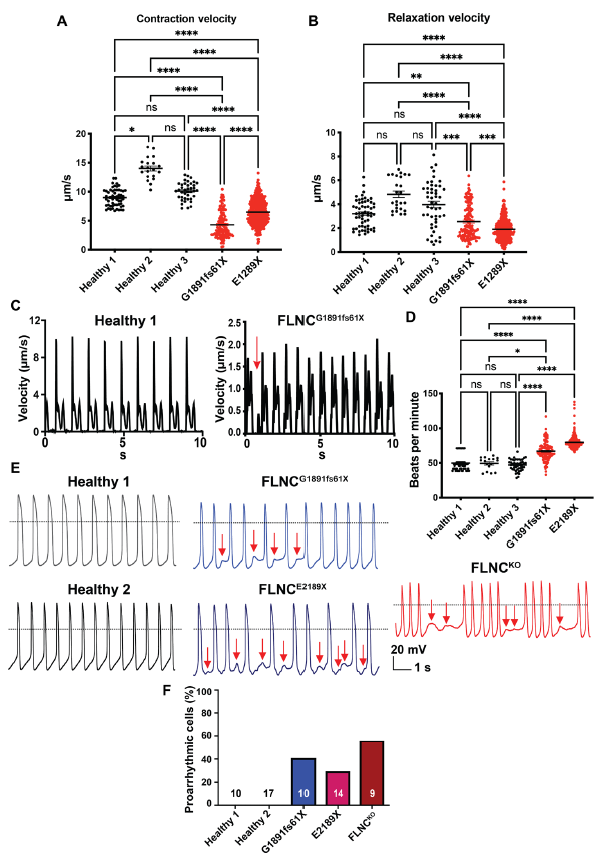
图1 FLNCG1891Vfs61X and FLNCE2189X iPSC-CMs 表现出收缩性受损和心律失常
2、FLNCG1891Vfs61X和FLNCCE2189X都是缺失突变体其导致FLNC相关心肌病的单倍机能不全
接下来检测了患者特异性iPSC-CMs中FLNC的表达水平,通过免疫印迹和qPCR检测发现,与对照组iPSC-CMs相比,FLNCG1891Vfs61X和FLNCCE2189X突变体表达FLNC蛋白和mRNA水平均显著降低(Fig. 2 A to C)。尽管FLNC表达水平降低,但通过免疫荧光染色和共定位分析,能够在两个FLNC突变的iPSC-CM细胞系中检测到FLNC及其与α- actitin在Z-discz盘的共定位(Fig. 2D)。
为了探究FLNCG1891Vfs61X和FLNCCE2189X是否是功能丢失的突变体,为FLNC缺失的iPSC系和等基因对照系细胞生成了差异表达基因(DEG)谱,并与iPSC- CMs患者的DEG谱进行了比较。结果显示成功构建了FLNC纯合子(FLNCKO−/−)和杂合子(FLNCKO+/−)敲除的iPSC-CMs(Fig. 2 E to H)。FLNCKO−/−和FLNCKO+/−iPSC-CMs中FLNC的表达在mRNA和蛋白水平上均以等位基因依赖的方式显著降低。RNA测序生物信息学分析显示,FLNC截断突变中的DEGs与FLNC KO iPSC-CMs中的DEGs呈正相关,支持功能缺失是FLNC突变引起表型表现的主要机制(Fig. 2I)。此外,携带FLNC突变的iPSC-CMs显著降低了ID蛋白水平;FLNC KO iPSC-CMs也有相同的发现(Fig. 2J)。最后,FLNCKO−/−细胞表现出与患者iPSC-CMs相似的心律失常表型(Fig. 1 E and F)。总之,这些结果说明FLNCG1891Vfs61X和FLNCCE2189X都是缺失突变体其导致FLNC相关心肌病的单倍机能不全。
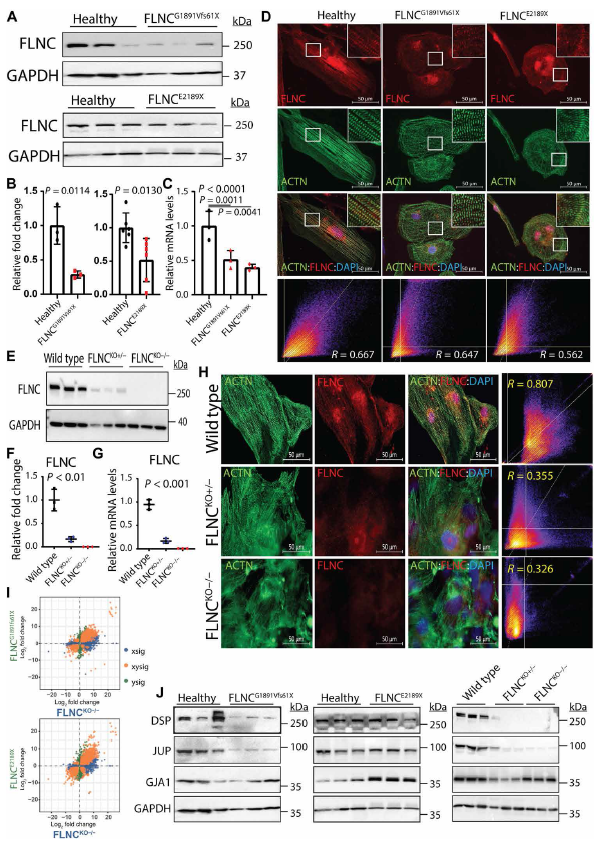
图2 FLNCG1891Vfs61X and FLNCE2189X的功能缺失突变导致FLNC相关心肌病的单倍机能不全
3、FLNC缺失导致β-Catenin核定位和β-Catenin信号通路的激活
为了发现FLNC的分子伴侣,进行了共免疫沉淀和蛋白质组学分析,通过蛋白质组学分析确定了β-Catenin,经免疫印迹证实(Fig. 3A)。在FLNCKO−/− iPSC-CMs的裂解液中没有检测到β-Catenin,而且在FLNC突变的iPSC-CMs的裂解液中β-Catenin的水平也减少了(Fig. 3A)。此外,在FLNC -突变体和FLNCKO−/− iPSC-CMs的细胞核中检测到大量的β-Catenin,而对照iPSC-CMs中β-Catenin主要在细胞质中检测到(Fig. 3B-C)。此外,FLNC -突变体和FLNCKO−/− iPSC-CMs的RNA-seq数据表达谱显示β-Catenin信号通路激活(Fig. 3D)。总之,数据表明β-Catenin可能是一种新的FLNC结合伙伴和FLNC的下游效应物,并且iPSC-CMs中FLNC的缺失导致β-Catenin从胞浆迁移到细胞核,导致β-Catenin信号的激活。
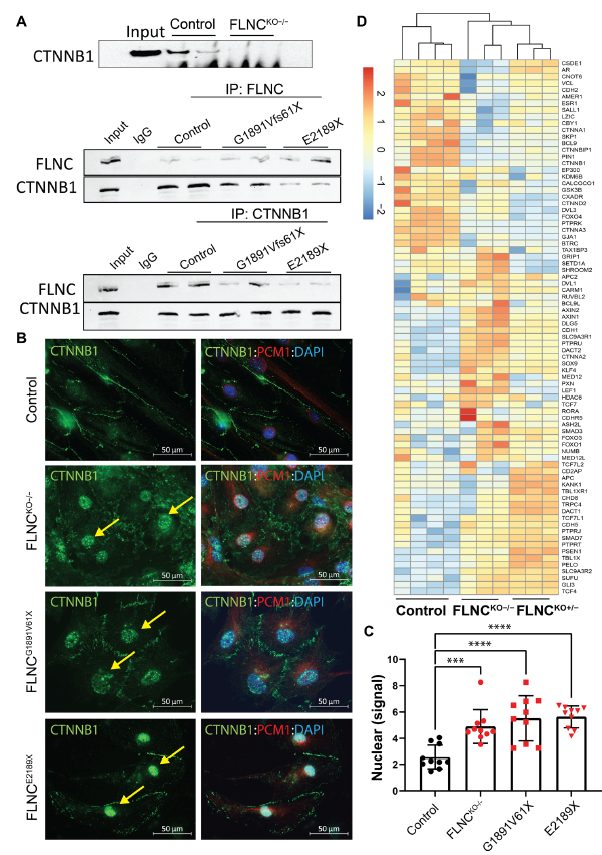
图3 β-Catenin与FLNC和FLNC激活的β-Catenin信号通路的缺失有关
4、PDGFRA在FLNC相关心肌病中上调并且是β-Catenin的下游调控因子
为鉴定更多的下游靶点用于药物开发,作者比较了FLNCKO−/−和FLNCKO+/−的iPSC-CMs的转录组以鉴定潜在靶基因。如图Fig. 4A所示,FLNCKO−/−和FLNCKO+/−的iPSC-CMs的转录组有接近相似的上调和下调DEGs。对两者间共有的上调和下调DEGs进行KEGG分析,发现它们主要参与调控cell-cell adhesion, intercellular communication,ion transport等通路(Fig. 4B to D)。此外,这些上调的DEGs主要富集至PDGF分子水平的结合活性(Fig. 4E)。数据显示,与等基因对照的iPSC-CMs相比,FLNC KO系中PDGFRA的表达水平显著提高了4倍(Fig. 4F)。由于数据表明,FLNCG1681Vfs61X和FLNCE2189X突变导致单倍功能不全,作者假设携带这些突变的iPSC-CMs患者的PDGFRA水平也可能升高。如Fig. 4G to H所示,与对照组相比,两种患者来源的iPSC-CMs中PDGFRA均上调。总之,这些发现提示PDGFRA信号通路的激活与FLNC相关心肌病的发病机制有关。

图4细胞粘附途径的失调导致PDGFRA在FLNC相关心肌病发病机制中的激活
β-Catenin被认为可以上调PDGFRA在其他组织和/或疾病中的表达。由于观察到β-Catenin在FLNC缺失的iPSC-CMs中有显著的核定位,于是研究了β-Catenin是PDGFRA上游转录激活因子的假设。因此,使用β-Catenin抑制剂(JW67和JW74)在不同浓度下抑制β-Catenin,并观察到PDGFRA转录水平的剂量依赖性抑制(Fig. 5A)。此外,ChIP下拉实验表明,已知的转录因子和β-Catenin结合伙伴SOX2与PDGFRA启动子区结合(Fig. 5B)。总之,数据表明β-Catenin是PDGFRA的转录激活因子,并且β-Catenin的核定位导致PDGFRA在FLNC缺失的iPSC-CMs中持续上调。

研究显示PDGFRA通过激活MAPK/ERK信号通路,破坏细胞膜上connexin43(缝隙连接蛋白-1 (GJA1))的信号。作者发现,与对照iPSC-CMs相比,FLNC突变体和KO iPSC-CMs的ERK激活并且GJA1离开细胞膜(Fig. 6A)。为了测试FLNC单倍不足的iPSC-CMs中PDGFRA的激活是GJA1定位错误的原因,使用FDA批准的药物crenolanib对PDGFRA进行药物抑制,以确定对GJA1膜定位的影响。免疫荧光研究表明,crenolanib抑制PDGFRA可以挽救GJA1在膜上的定位(Fig. 6A)。
转录组分析显示,与FLNCG1891Vfs61X和KO iPSC-CMs相比,FLNCE2189X突变体iPSC-CMs对crenolanib的反应最大,拯救的DEGs数量最多(Fig. 6B)。GSEA揭示了细胞粘附途径(hsa04510)的部分正常化,支持了cell-cell adhesion位点的结构稳定促进了GJA1粘附在细胞膜上的假设(Fig. 6C)。然而,通过免疫印迹检测,发现crenolanib处理后GJA1的表达水平没有改变,这表明PDGFRA抑制并不影响GJA1的表达水平,而是影响GJA1的转运(Fig. 6D)。最后,也是最重要的一点是,crenolanib处理也显著改善了来自FLNC患者的iPSC-CMs的收缩性,并减少了心律失常,但对健康对照组而言并非如此(Fig. 6E-F)。综上,说明FLNC缺失导致细胞-细胞黏附系统失调,抑制PDGFR信号通路改善FLNC突变体iPSC-CMs的收缩性.

图6 FLNC缺失导致细胞-细胞黏附系统失调,抑制PDGFR信号通路改善FLNC突变体iPSC-CMs的收缩性
通过免疫荧光检测到,与对照组iPSC-CMs相比,FLNC突变体iPSC-CMs中β-catenin的核定位增加,但在crenolanib处理后,β-catenin的核定位减少(Fig. 7A)。qPCR证实crenolanib处理对β-catenin核信号转导的抑制作用,β-catenin靶基因TCF4、SOX9、COL1A2、TGF 3的转录水平降低(Fig. 7B)。此外,通过GSEA分析比较crenolanib治疗前后患者源性和KO iPSC-CMs的DEGs谱,进一步证实PDGFRA信号抑制后β-catenin信号通路部分恢复(Fig. 7C-D)。因此,证据表明PDGFRA的激活增强了β-catenin信号,并促进了一个正反馈回路。此外,PDGFR抑制可以部分恢复β-catenin膜定位,减少FLNCtv突变引起的β-catenin的激活。
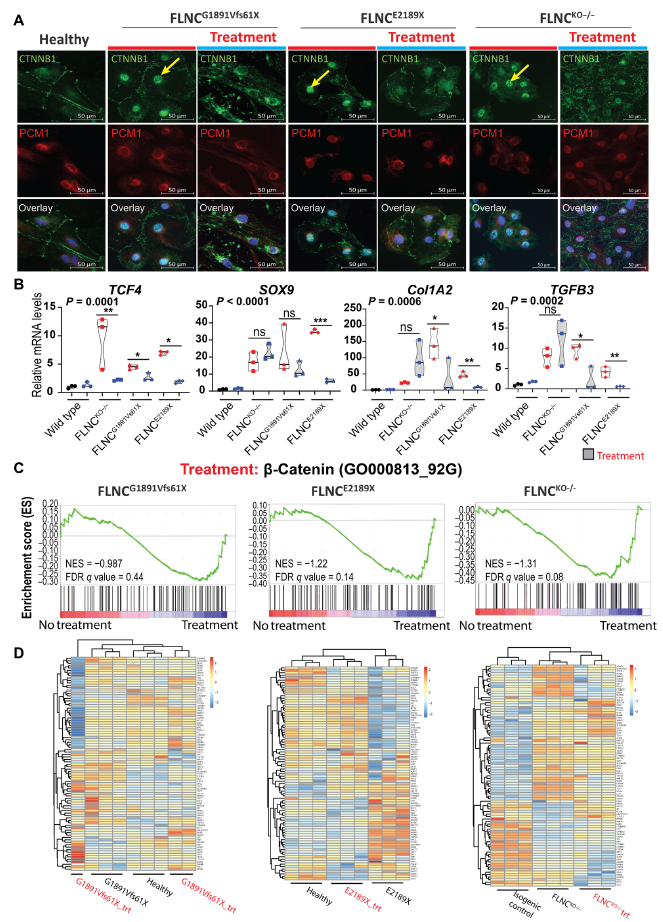
图7 PDGFRA抑制减缓了β-catenin信号通路及其在FLNC突变体iPSC-CMs中的核定位
7、a-DCM中PDGFRA信号的激活
为了证实体外研究的结果,测定了a-DCM患者心脏中PDGFRA的表达水平。在a-DCM患者中(n = 5), 1例患者是FLNCG1891V61X突变的姐妹。另外4例患者诊断为特发性DCM合并室性心律失常。发现a-DCM患者心脏PDGFRA水平升高, PDGFRA下游效应物ERK被激活(Fig. 8A and B)。此外,还确定了β-catenin和GJA1在DCM心脏中的表达水平和定位。虽然β-catenin和GJA1的表达水平结果保持不变,但免疫荧光染色检测到β-catenin和GJA1从细胞膜上分离(Fig. 8C and E)。此外,移植心脏的RNA-seq数据显示,与DCM (n = 15)和未衰竭心脏(n = 12)相比,a-DCM (n = 20)心脏中PDGFRA mRNA的丰度显著更高(Fig. 8F)。RNA-seq数据经qPCR验证,如Fig. 8G所示。此外,各组间PDGFRB mRNA转录水平未发生变化,提示FLNC突变引起a-DCM的致病机制是特异性于PDGFRA亚型的(Fig. 8F)。总之,证实了来自患者特异性和KO iPSC-CM系和人类a-DCM移植心脏的体外发现,强烈表明PDGFRA促进a-DCM的致病信号传导。
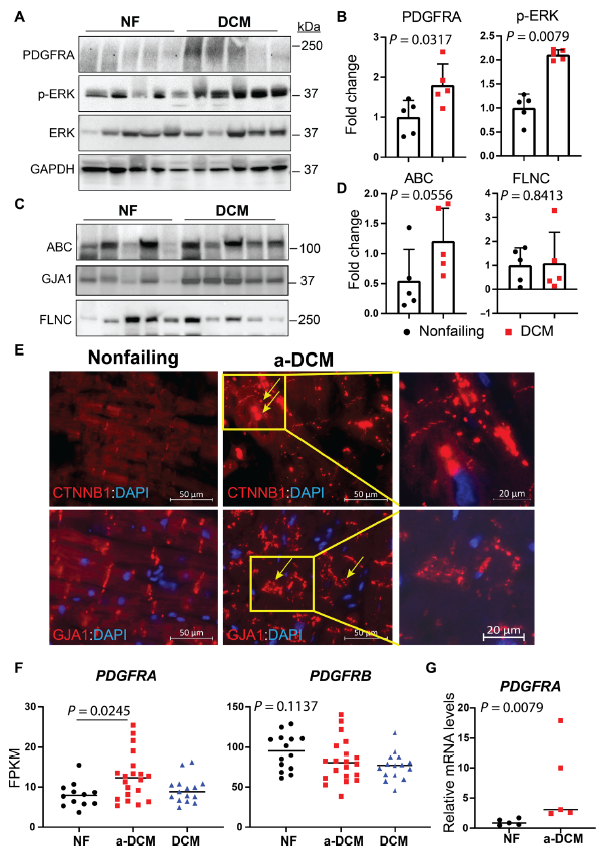
图8 PDGFRA的上调有助于GJA1和β-catenin在心律失常性扩张型心肌病心脏的离域
总之,如图9,本研究发现β-catenin是FLNC的下游靶点,FLNC单倍不足不仅影响cell-cell adhesion、细胞骨架和肌肉组织,还增加β-catenin的核迁移,进而上调PDGFRA的转录。随后PDGFRA信号的激活可能是FLNC突变体iPSC-CMs中观察到的收缩功能障碍和电不稳定的原因。FLNC 单倍不足和随后PDGFRA激活引起的心律不齐的表现型至少部分是由于GJA1位移引起的细胞膜的几种机制导致的,如PDGFRA下游靶点ERK磷酸化,ID中断和异常易位。
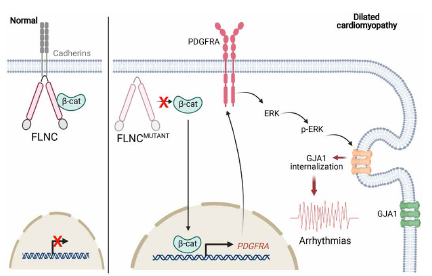
图9 FLNC相关心肌病的疾病模型
参考文献:
Chen Suet Nee., Lam Chi Keung., Wan Ying-Wooi., Gao Shanshan., Malak Olfat A., Zhao Shane Rui., Lombardi Raffaella., Ambardekar Amrut V., Bristow Michael R., Cleveland Joseph., Gigli Marta., Sinagra Gianfranco., Graw Sharon., Taylor Matthew R G., Wu Joseph C., Mestroni Luisa.(2022). Activation of PDGFRA signaling contributes to filamin C-related arrhythmogenic cardiomyopathy. Sci Adv, 8(8), eabk0052. doi:10.1126/sciadv.abk0052






