CircCPM通过激活PRKAA2介导的自噬促进胃癌的化疗耐药性
5-氟尿嘧啶(5-FU)是临床上常用的一种晚期GC的一线化疗药物。然而,其疗效因化疗耐药性而显著减弱。最近,有证据表明,自噬失调可能导致癌症的耐药性,而CircRNA也参与了化疗耐药性。然而,circRNAs是否通过自噬参与5-FU化疗耐药仍不清楚。circCPM在5-FU耐药的GC细胞系和组织中上调。此外,circCPM高表达与生存率低呈正相关。沉默circCPM提高了体外和体内的化疗敏感性。在机制上,它直接与细胞质中的miR-21-3p结合,从而增加PRKAA2的表达,促进自噬和化疗耐药性的激活。我们的结果显示,circCPM通过靶向PRKAA2在调节GC自噬和5-FU耐药性方面起着关键作用,为评价GC的疗效和逆转5-FU耐药提供了新的理论依据。本文于2022年1月发表于“Clinical and Translational Medicine”(IF= 11.492)上。
技术路线
结果
1)5-FU耐药GC中的失调的circRNA
为了研究circRNA和mRNA表达谱,我们在5-FU耐药和敏感的GC细胞和组织中使用circRNA和mRNA微阵列进行联合分析(图1A)。我们在5-FU耐药的GC细胞系和组织中发现了数百个上调或下调的CircRNA和mRNA。我们首先通过Targetscan、miRDB、miWALK和Starbase数据库建立了ceRNA调控网络。考虑到自噬在耐药性中的关键作用,我们通过GO和KEGG的clusterProfiler进一步分析了包括PARK2、PRKAA2和SOGA3在内的自噬途径相关基因。接下来,使用癌症药物敏感性基因组学(GDSC)数据库分析这些自噬途径相关基因与5-FU敏感性之间的关系。根据5-FU药物敏感性的IC50值,我们发现PRKAA2表达上调(图1B)。基因与5-FU药物敏感性之间的皮尔逊相关系数分析表明,高PRKAA2表达与5-FU耐药性呈正相关(图1C)。Kaplan–Meier结果显示,与PRKAA2低表达患者相比,只有PRKAA2高表达患者的生存期更差(图1D)。我们中心的随访数据也有类似的结果(图1E)。qRT PCR分析显示,PRKAA2在5-FU耐药组织中表达上调(图1F)。细胞活力分析还证实,PRKAA2表达降低促进了化疗耐药细胞的化疗敏感性(图1G)。基于初步构建的ceRNA调控网络,我们进行了miRNA第二代测序,以进一步优化ceRNA网络。结合生物信息学预测和测序结果,我们发现了几个与mRNA相关的miRNA,包括hsa-miR-21-3p、hsa-miR-9-5p、hsa-miR-162-5p、hsa-miR-126-5p和hsa-miR-31-5p。然后,我们选择了五个可能调控PRKAA2的候选circRNAs。qRT PCR结果显示,在5-FU耐药组织中,circ0027497表达(在本研究中也称为circCPM)上调(图1H)。随访数据分析显示,只有高表达的circCPM与患者的生存率呈负相关(图1I)。细胞活力分析显示,在5-FU耐药的GC细胞中,circCPM表达降低,IC50降低(图1J)。线性相关模式分析表明PRKAA2表达和circCPM表达之间存在正相关性(图1K)。在ceRNA调控网络中,有一个miR-21-3p连接circCPM和PRKAA2。因此,我们最终选择circCPM-miR-21-3p-PRKAA2轴进行后续研究。

2)circCPM的特征
CircCPM起源于羧肽酶M(CPM)基因的第四、第五和第六外显子。Sanger测序确定了具有预期大小的circCPM的头-尾剪接结构(图2A)。放线菌素D分析显示,circCPM表达不受影响,而线性CPM mRNA表达降低(图2B,C)。与线性CPM mRNA相比,circCPM对RNase R的抗性更强(图2D)。接下来,为了测试circCPM的圆形结构,我们设计了发散引物和收敛引物来扩增circCPM和线性CPM mRNA。从AGS-5FU和HGC-27-5FU中提取的互补DNA(cDNA)和gDNA用作模板(图2E,F)。结果表明,发散引物只能扩增cDNA中的circCPM。qRT PCR结果显示,circCPM主要定位于细胞质内(图2G)。FISH结果显示了类似的结果(图2H)。总的来说,我们的结果表明,circCPM是一种稳定的、来源于CPM的细胞质circRNA,它可能在5-FU抗性中发挥重要作用。

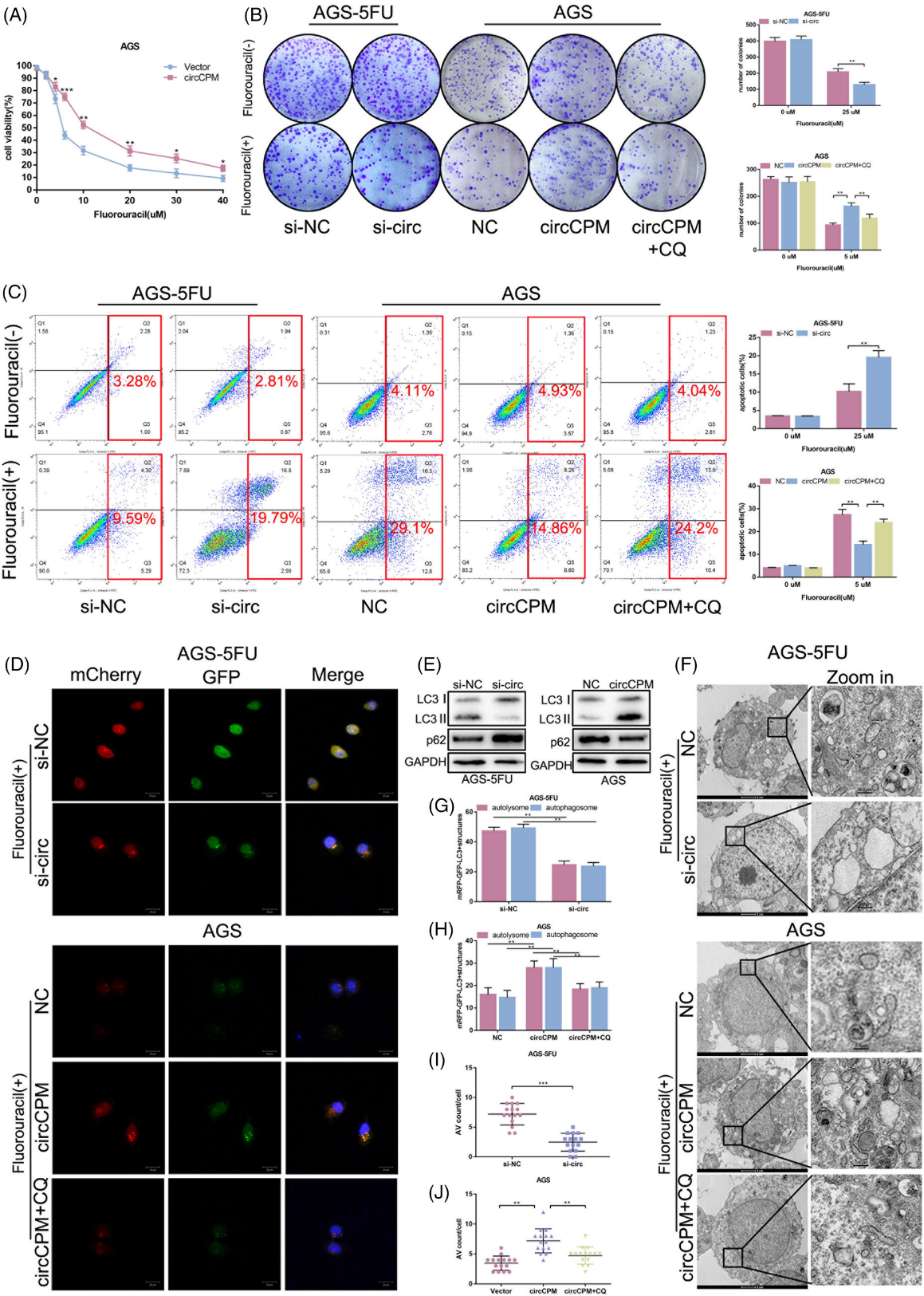
3)CircCPM增强GC 5-FU体外抗药性和自噬作用
为了确定circCPM在GC化疗耐药中的生物学功能,我们分别在5-FU敏感和耐药细胞中构建了circCPM过表达细胞和circCPM敲除细胞。细胞存活率的结果显示,circCPM表达的降低促进了5-FU耐药GC细胞的化疗敏感性,IC50值降低(图1J)。然而,在5-FU敏感GC中过表达circCPM导致了相反的结果(图3A)。此外,还检测了平板集落形成和细胞凋亡。自噬抑制剂氯喹(CQ)也应用于这些功能实验。结果表明,在5-FU耐药细胞中,降低circCPM表达会减少平板菌落数量并增加凋亡比例,而在5-FU敏感细胞中提高circCPM表达会导致相反的结果(图3B、C)。然后,我们进一步探讨了circCPM在自噬中的潜在作用。根据LC3和p62水平测定,circCPM的沉默和过表达分别抑制并促进5-FU耐药和敏感细胞的基本自噬水平(图3E)。此外,在5-FU敏感细胞中过表达circCPM后,LC3点的数量增加,而在5-FU耐药细胞中沉默circCPM后,LC3点的数量减少(图3D、G、H)。TEM结果证实,沉默CIRCPM导致A V计数减少。在5-FU敏感细胞中外源性表达circCPM观察到相反的结果(图3F,I,J)。
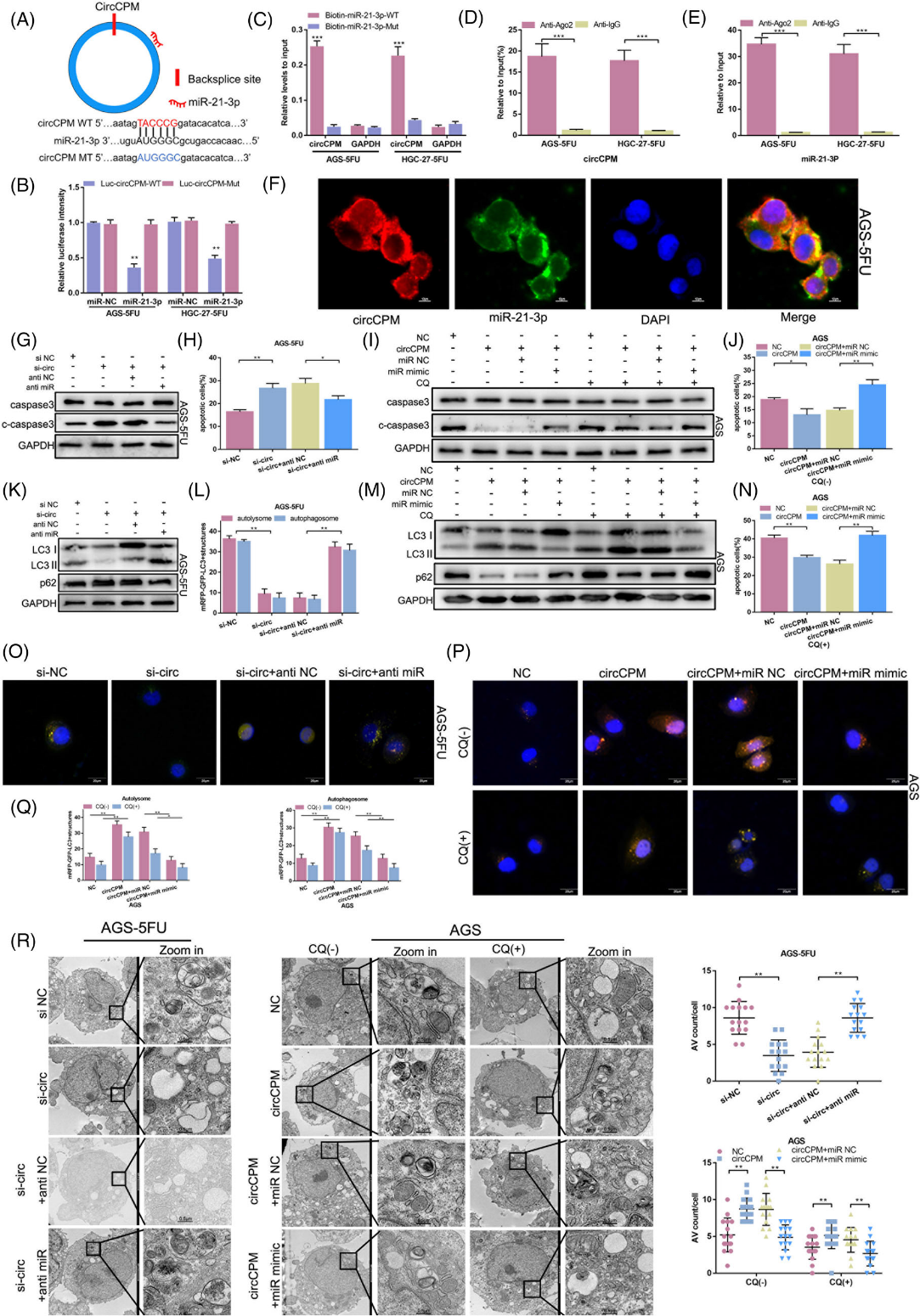
4)CircCPM在GC中起到miR-21-3p海绵的作用
众所周知,CircRNA对miRNA有海绵的作用,circCPM主要富集在细胞质中。因此,我们研究了circCPM与miRNA结合的可能性。通过TargetScan预测CircCPM可能与miR-21-3p结合(图4A)。为了直接确认circCPM与miR-21-3p结合,我们根据预测的结合位点设计了野生型和突变型荧光素酶质粒。荧光素酶报告分析结果显示,在转染Luc-circCPM-WT质粒的293T细胞中,miR-21-3p极大地降低了荧光素酶活性(图4B)。miRNA下拉分析显示,生物素化的miR-21-3p在AGS-5FU和HGC-27-5FU细胞中显著富集circCPM(图4C)。通过形成circRNA- AGO2 -miRNA复合物,circRNA被证明对miRNA具有海绵的作用。RIP实验证实AGO2同时与circCPM和miR-21-3p结合(图4D,E)。随后,FISH分析显示circCPM和miR-21-3p共同定位于细胞质中(图4F)。为了研究circCPM和miR-21-3p在自噬和化疗耐药中的潜在机制,在GC细胞中进行共转染。将circCPM siRNA和miR-21-3p抑制剂转染5-FU耐药细胞。凋亡检测表明,circCPM siRNA显著提高了细胞凋亡率,与miR-21-3p抑制剂共转染后细胞凋亡率降低(图4H)。凋亡相关蛋白caspase3和c-caspase3的表达进一步证实了结果(图4G)。在转染circCPM质粒和miR-21-3p模拟物的5-FU敏感细胞中观察到相反的结果,无论是否经过CQ处理(图4I、J、N)。此外,western blotting结果显示circCPM siRNA明显抑制LC3的表达水平;然而,当与miR21-3p抑制剂共转染时,LC3在5-FU耐药细胞中的低表达水平得以挽救。另一个自噬标记物p62显示出相反的结果(图4K)。在用miR-21-3p模拟物和circCPM过表达载体转染的5-FU敏感细胞中观察到相反的效果,无论是否经过CQ处理(图4M)。此外,我们发现共转染miR21-3p抑制剂逆转了沉默circCPM降低自噬水平的效果(图4L,O),而miR-21-3p模拟物和circCPM过表达载体的联合转染部分恢复了在5-FU敏感细胞中过表达circCPM的效果,无论是否进行CQ处理(图4P、Q)。TEM分析结果相似(图4R)。总之,上述结果表明,circCPM通过miR-213p调节GC自噬和化疗耐药性。
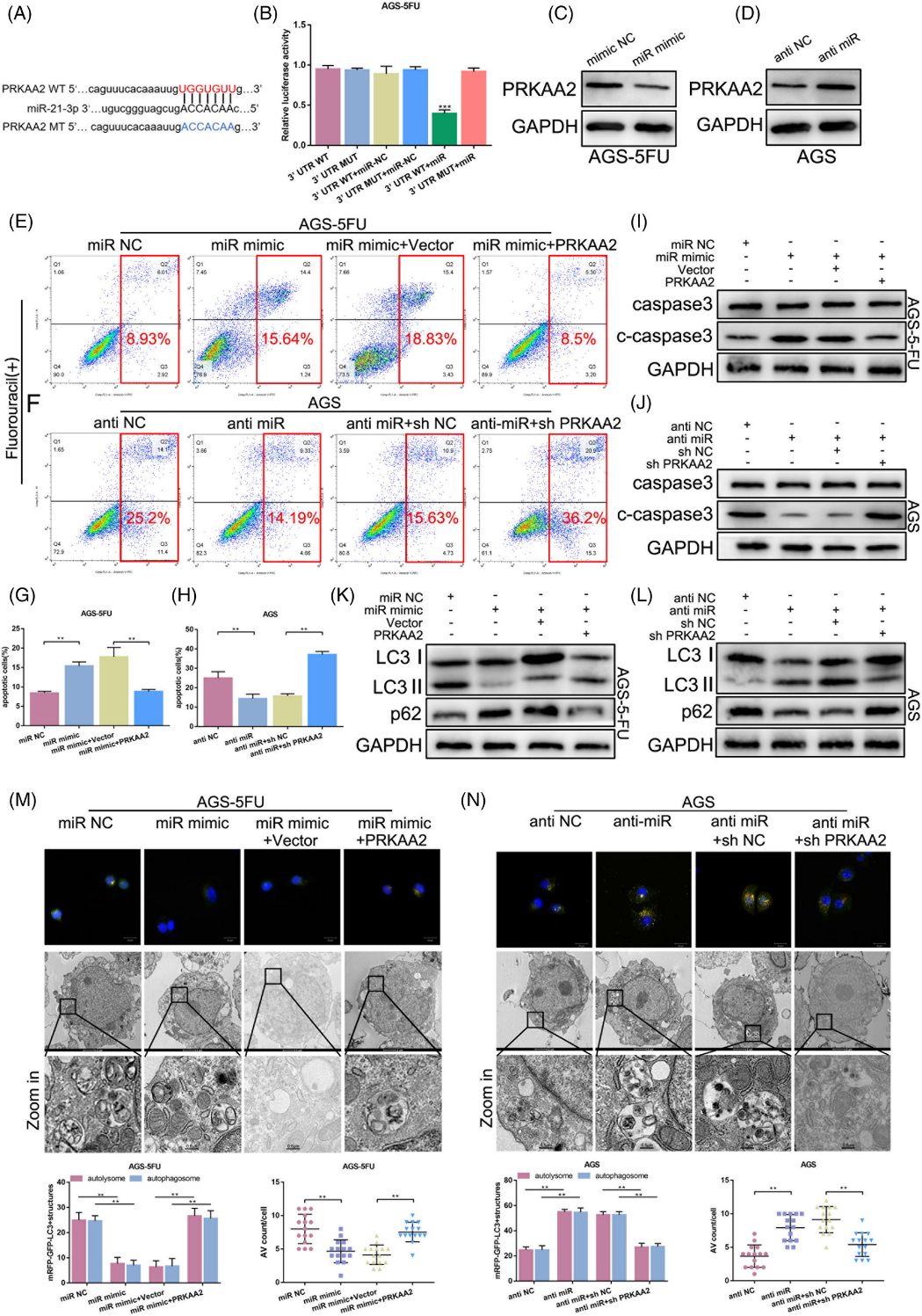
5)MiR-21-3p通过靶向PRKAA2调节自噬和化疗耐药性
据报道,PRKAA2参与调节自噬,是耐药性的重要原因。因此,我们假设PRKAA2可能参与5-FU耐药性的形成。miR-21-3p的PRKKA2的潜在结合位点为5′UGGUGUU3’(图5A)。接下来,我们进行了荧光素酶报告分析。与PRKAA2 3′UTR mut相比,将PRKAA2 3′UTR wt与miR-21-3p表达质粒共转染可降低荧光素酶活性,这表明miR-21-3p与PRKAA2直接结合(图5B)。Western blotting进一步证实PRKAA2表达受miR-21-3p转录后调控(图5C,D)。随后,FACS和western blotting分析显示,miR-21-3p模拟物诱导5-FU耐药细胞凋亡。然而,PRKAA2过表达载体和miR21-3p模拟物的共转染消除了这些效应(图5E、G、I)。在5-FU敏感细胞中观察到相反的结果(图5F、H、J)。自噬水平通过miR-21-3p的过表达而降低,而通过PRKAA2在化疗耐药细胞中的过表达而得以挽救(图5K、M)。在化学敏感细胞中观察到相反的结果(图5L,N)。总之,miR-21-3p通过靶向PRKAA2调节GC自噬和化疗耐药性。
6)CircRNA通过PRKAA2介导的自噬调节GC的耐药性
我们进一步探讨了circCPM和PRKAA2之间的关系。首先,FACS和Western Blot显示,过表达PRKAA2可以减弱circCPM siRNA诱导的凋亡细胞增加(图6A、C、D)。类似地,自噬关键蛋白的表达、共焦免疫荧光和TEM分析均表明,在沉默circCPM的基础上通过增强PRKAA2表达恢复自噬(图6G、I、L、N)。通过共转染circCPM质粒和sh-PRKAA2,在5-FU敏感细胞中进行了类似的实验。结果表明,sh-PRKAA2可以挽救circCPM过表达引起的凋亡水平下降和自噬增加(图6B、D-F、H、J、K、M、N)。总之,circCPM通过PRKAA2介导的自噬调节GC的化疗耐药性。
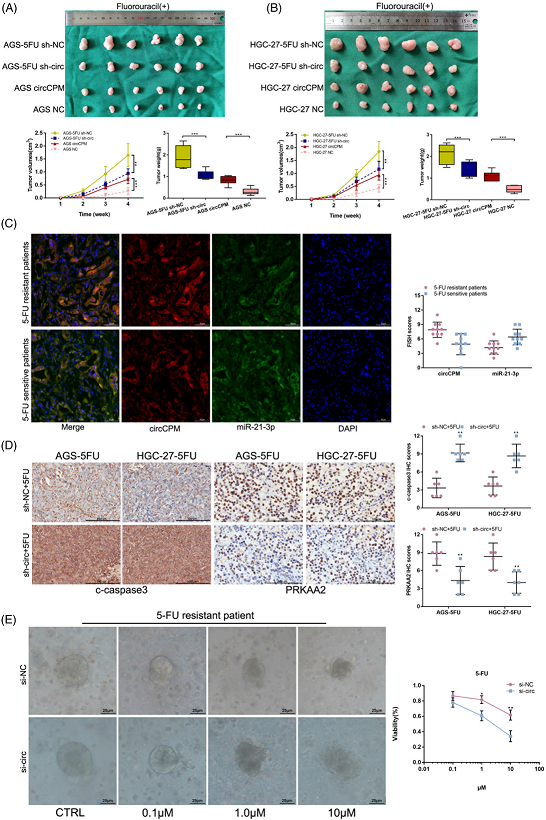
7)CircCPM增强体内5-FU耐药性
为了进一步评估circCPM的临床价值,将沉默或过表达circCPM的细胞与化疗药物一起皮下注射到BALB/c裸鼠体内,并使其增殖4周。分别对肿瘤进行称重和测量。结果表明,在5-FU耐药细胞中沉默circCPM可显著降低异种移植瘤的重量和体积,并增强5-FU治疗GC的效果,而过表达circCPM则显示相反的结果(图7A,B)。FISH显示circCPM和miR-21-3p共定位于5-FU耐药或5-FU敏感GC患者的组织中。FISH分析显示,抗5-FU的GC组织中circCPM的表达更高(图7C)。与对照组相比,IHC观察到转染sh-circCPM联合5-FU化疗的肿瘤中c-caspase3蛋白水平升高,而PRKAA2显示出相反的结果(图7D)。我们还建立了一个类器官模型来观察5-FU的化疗敏感性。细胞活力分析表明,转染circCPM siRNA的类器官具有较低的细胞活性。形态学上,有反应的类器官变暗并分解(图7E)。总的来说,circCPM在体内促进了GC 5-FU的耐药性。
结论:CircularCPM通过激活PRKAA2介导的自噬促进胃癌化疗耐药。circCPM可能是5-FU耐药的生物标志物,也是克服GC耐药的靶点。
参考文献:Fang L, Lv J, Xuan Z, Li B, Li Z, He Z, Li F, Xu J, Wang S, Xia Y, Jiang T, Zhang L, Wang L, Zhang D, Xu H, Yang L, Xu Z, Wang W. Circular CPM promotes chemoresistance of gastric cancer via activating PRKAA2-mediated autophagy. Clin Transl Med. 2022 Jan;12(1):e708. doi: 10.1002/ctm2.708.






