新思路:Pink1支持神经元局部线粒体自噬
PTEN诱导的激酶1 (PINK1)是一种短命蛋白,是Parkin易位和线粒体自噬去除受损的线粒体所必须的。由于PINK1的半衰期较短,限制了其进入神经突的能力,因此要使这一线粒体自噬途径在远离体细胞的地方活跃起来,就需要进行局部翻译。Pink1转录本和神经元线粒体相关并转运的。与转运相一致,线粒体外膜结合蛋白突触小泡磷酸酶2(SYNJ2)和其结合蛋白(SYNJ2BP)都是将Pink1 mRNA连接到线粒体所必须的通过SYNJ2的RNA结合域。这种对PINK1局部翻译的神经元特异性适应为远端线粒体提供了持续的PINK1供应,以激活线粒体自噬。本研究于2022年2月发表在《Neuron》IF:17.173期刊上。
技术路线:

主要实验结果:
为了确定PINK1在哺乳动物神经元中的半衰期,我们检测了iPSC来源的神经元中内源性PINK1的稳定性和清除性(Figures 1A and 1B)。在CCCP介导的线粒体去极化后PINK1水平升高,这种作用被蛋白合成抑制剂CHX阻止。在CCCP洗脱后,PINK1水平在30min内降至基线水平,表明PINK1持续切割导致极化线粒体中PINK1蛋白水平保持在较低丰度。在健康的线粒体中,这种快速降解会抑制突触和轴突中PINK1的运输。然而,PINK1 mRNA局部转运可以支持局部线粒体自噬。于是作者探究在CHX存在的情况下YFP-Parkin线粒体转运是否发生。AA处理将Parkin线粒体共定位提高了10-29%(Figures 1C and 1D)。在AA前4小时,将CHX应用于轴突室,消除了80%的这种增加(Figures 1D)。因此,轴突局部转运会导致Parkin依赖的线粒体自噬。
Pink1转录本的相对丰度和一个已知的体细胞限制表达的RNA,γ-actin,被测定并校正到线粒体rRNA的数量。虽然γ-actin很少,但在轴突部分容易检测到Pink1 mRNA(Figures 1E)。随后作者检测了体内是否有Pink1表达,结果显示外源性Pink1 mRNA已被运输到视神经,而对照组的GFP转录本几乎没有出现在轴突(Figures 1F)。
之后,作者利用光转换蛋白Kaede探究了PINK1在轴突中的翻译情况(PINK1-NKaede),Kaede 使用通用的 mito 靶向域(mito-Kaede)靶向线粒体作为对照。曝光后 45 分钟,来自 PINK1-N-Kaede 融合蛋白的绿色 Kaede 信号出现在轴突线粒体中,相比之下,mito-Kaede 的信号仅进一步下降(Figures 1G and 1H)。这表明远端轴突的PINK1蛋白可能由局部翻译转运提供。
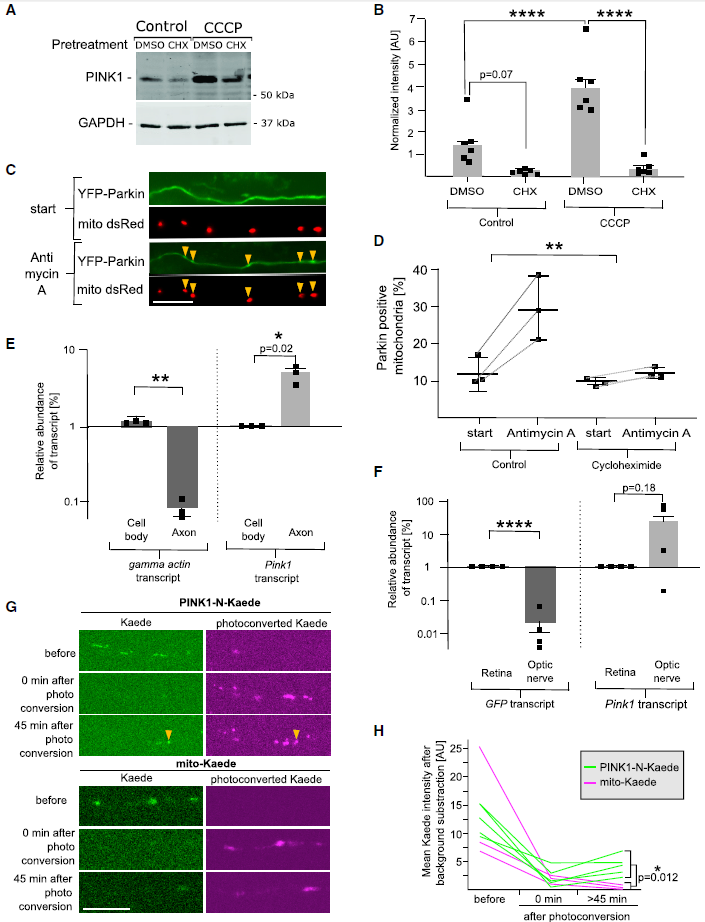
图1轴突中的PINK1活动需要局部翻译
原位杂交的结果显示内源性Pink1 mRNA出现在轴突和树突的斑块中,与线粒体蛋白ATP5a共定位(Figure 2A)。STED成像显示Pink1 mRNA信号分解成多个小点状点在每个线粒体上,相反,β-actin mRNA几乎不与线粒体重叠(Figure 2B)。
对于神经元中Pink1 mRNA的实时成像,使用MS2/PP7-splitVenus方法(Figure 2C),将12个PP7和MS2串联茎环添加到一个大鼠Pink1结构体中,该结构体包含该基因的3’和5’UTR。为了防止PINK1的过表达活性,这会限制线粒体运动,作者引入了kinase死亡突变(K219M)。这种带有茎环标记的Pink1 mRNA在体细胞和树突中很容易被检测到。轴突中检测到的Pink1是有限的,虽然在近端轴突观察到很多小的Pink1 mRNA点,并且它们主要和线粒体共定位(Figure 2D)。通过这两种方法,当用Mander相关系数量化时,共定位是显著的。为了排除轴突线粒体的相对频率会随机产生相同的重叠,将直线图像的线粒体通道翻转,原始图像的共定位程度明显高于翻转对照图像(Figures 2E–2G)。观察到体细胞和树突的共定位重叠明显高于相应的翻转图像(Figures 2E–2G)。此外,β-actin mRNA与线粒体共定位点也能观察到,但不存在于体细胞只存在于树突,并且无论是在树突还是体细胞,Pink1 mRNA点和线粒体共定位明显更高(Figures 2E–2G)。总之,这些结果说明神经元中Pink1 mRNA定位于线粒体。
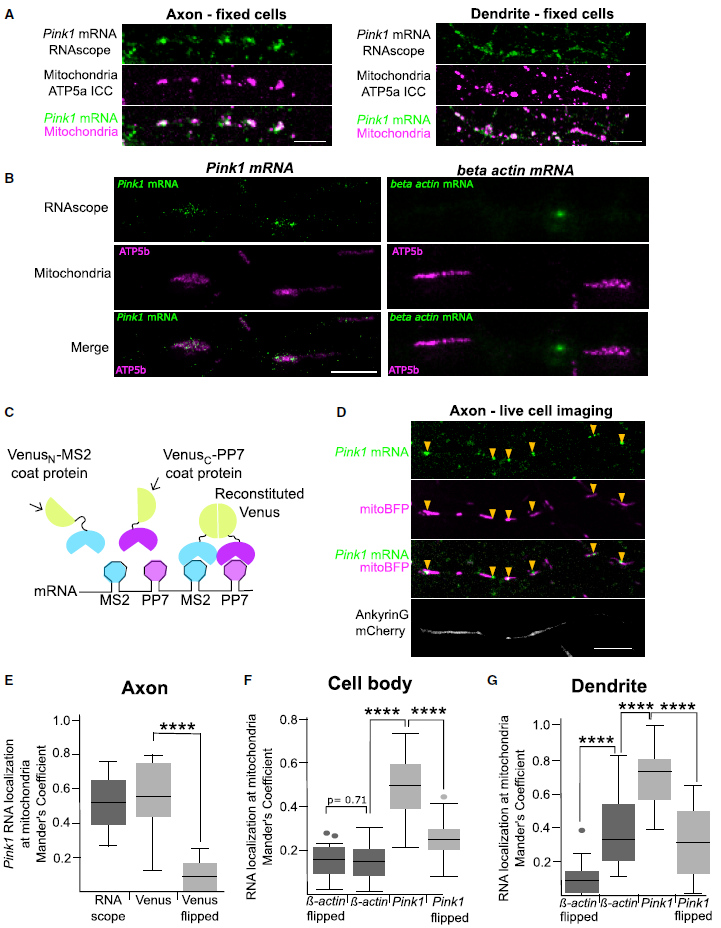
图2神经元中Pink1 mRNA定位于线粒体
3、Pink1 mRNA与线粒体共转运
由于轴突中Pink1颗粒的实时成像受到限制,作者主要分析了树突中mRNA的转运(Figure 3A)。大多数Pink1 mRNA颗粒及其相关的线粒体是静止不动的,正如树突中固定线粒体的优势所预期的那样(红色箭头,Figure 3A)。然而,在运动线粒体上也存在Pink1 mRNA颗粒(黄色箭头,Figure 3A),它们的运动反映了细胞器的运动,这可以从它们重叠的纹波图痕迹中看出(Figure 3A)。总的来说,在观察的整个过程中,树突和轴突中的mRNA和线粒体都保持在一起,89%的Pink1 mRNA与线粒体同步移动,在无法检测到相应线粒体痕迹的情况下,mRNA颗粒是静止的或只移动了很短的距离(Figures 3B-3C)。文献报道具有催化活性的PINK1过表达抑制线粒体运动,因此,比较了野生型(WT)和失活的PINK1 K219M mRNA的线粒体运动性。和预期一样,当Pink1蛋白WT形式表达时,Pink1 mRNA颗粒的运动时间比Pink1 K219M的表达少60%(Figure 3D)。
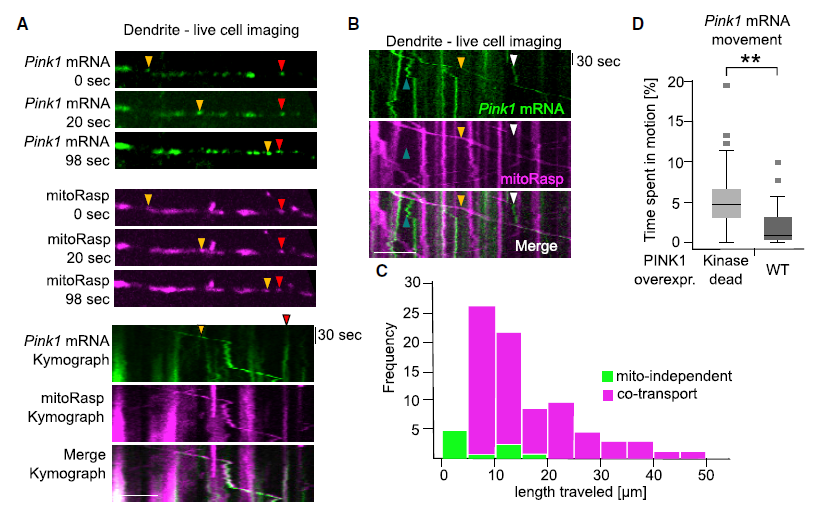
图3 Pink1 mRNA与线粒体共转运
4、Pink1 mRNA与线粒体的关联需要Pink1线粒体靶向序列的翻译
为了确定Pink1 mRNA与线粒体结合的机制,表达了与BFP编码序列融合的mRNA的截短序列(Figure 4)。BFP序列单独与线粒体没有关联。使用MS2/PP7- splitVenus系统来探究Pink1转录本的某个部分是否可以将线粒体关联传递到嵌合结构上(Figure 4A)。尽管许多RBP结合在UTR内,但Pink1 UTR都不足以诱导BFP转录本的线粒体定位,而且Pink1 C端部分和3’UTR的结合也不充分(Figure 4A)。然而,将PINK1的N端部分(ORF的1 675)和5’UTR包含在一起,就足以将mRNA定位于体、轴突和树突中的线粒体(Pink1 5’UTR+N-BFP; Figures 4A, 4B)。Pink1 5’UTR+N-BFP编码的225个氨基酸包括其起始密码子和线粒体靶向序列(MTS),提示线粒体定位可能需要翻译。事实上,在翻译抑制剂嘌呤霉素的存在下,全长Pink1的表达改变了Pink1 mRNA的分布。孵育1 h后,全长Pink1 mRNA从线粒体转移到胞质中(Figures 4C)。类似地,缺乏起始密码子的结构不能定位于线粒体(Figures 4A, 4D)。PINK1的MTS是否足以将其mRNA定位到线粒体呢?作者表达了Pink1与BFP融合的5’UTR和MTS (Pink1 5’UTR+MTS-BFP),虽然BFP融合蛋白定位于线粒体,但嵌合的Pink1/BFP转录本仍然是胞质的(Figures 4E)。这些结果说明Pink1 mRNA与线粒体的关联需要Pink1线粒体靶向序列的翻译。于是这促使作者进一步探究RBPs在Pink1 mRNA定位中的作用。
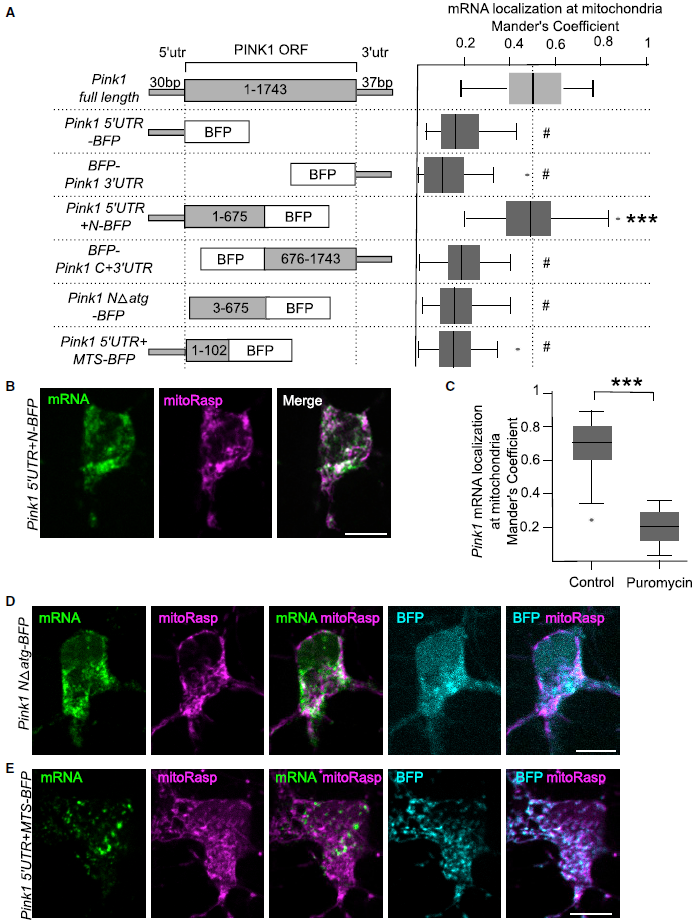
图4 PINK1线粒体靶向序列的翻译是必要的,但不足以使PINK1 mRNA与线粒体关联
5、SYNJ2BP敲低将Pink1 mRNA重新分配到RNA颗粒,抑制局部线粒体自噬
最近的研究已经将SYNJ2BP与内质网和线粒体RNA的定位连接到外线粒体膜。当SYNJ2BP在神经元中被敲低时,发现神经元体中Pink1 mRNA与线粒体的关联减少,树突中Pink1 mRNA与线粒体的关联减少(Figures 5A and 5B)。抗shRNA SYNJ2BP的表达挽救了这些影响(Figures 5B)。Pink1 mRNA在体中形成较大的聚集物,与RFP-DDX6共定位,RFP-DDX6是加工体的标记(Figures 5C)。与对Pink1 mRNA的影响相反,SYNJ2BP敲低后,β-actin mRNA和RFP-DDX6的共定位没有改变。这表明SYNJ2BP缺失对Pink1 mRNA的定位具有选择性影响。
图1提到Pink1 mRNA与线粒体关联和共转运需要SYNJ2BP,这预示着,敲低SYNJ2BP可以阻止Pink1 /Parkin通路的轴突线粒体自噬的局部激活。与Pink1 mRNA转运的需要相一致,SYNJ2BP基因的敲除降低了AA诱导的轴突远端线粒体自噬的发生率(Figures 5D)。为了测量PINK/Parkin通路的功能,对磷酸化泛素(PINK1的直接下游产物)进行染色。在AA处理后,神经突线粒体磷泛素的增加被SYNJ2BP敲除所废止。
总之,以上表明SYNJ2BP敲低将Pink1 mRNA重新分配到RNA颗粒,抑制局部线粒体自噬。
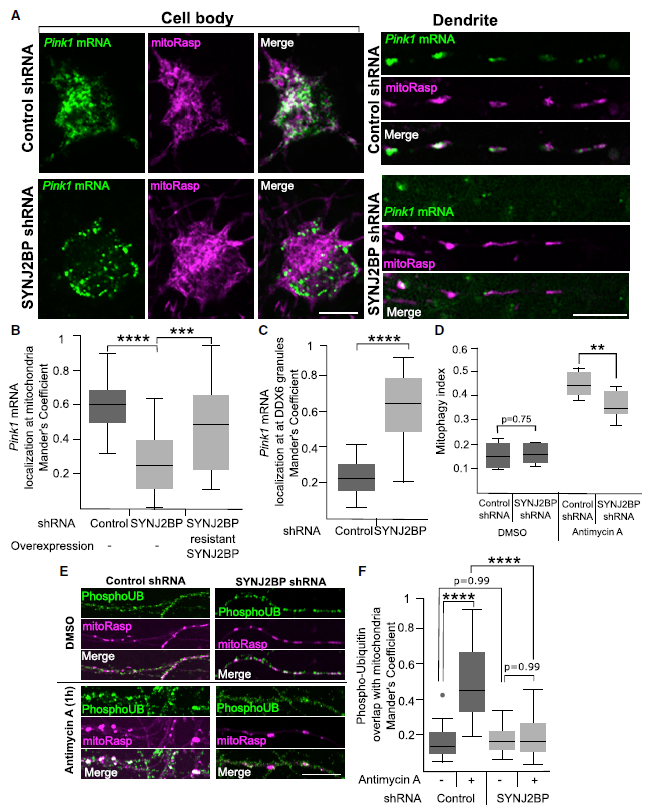
图5 SYNJ2BP敲低使Pink1 mRNA重新分布到RNA颗粒中,并抑制局部线粒体自噬
6、Pink1 mRNA对线粒体的定位是神经元特异性的,依赖于SYNJ2a
在包括COS-7、HeLa细胞和小鼠胚胎成纤维细胞在内的非神经元细胞中,Pink1 mRNA不在线粒体上(Figures 6A)。因此,该转录本的线粒体关联可能是神经元特异性的。在这些细胞类型中缺乏线粒体定位,这让人不禁要问,缺失的神经元成分需要什么带来Pink1 mRNA在非神经元细胞中传递到线粒体。由于SYNJ2BP普遍表达,作者首先探究了其相互作用分子SYNJ2a或ER蛋白核糖体结合蛋白1 (RRBP1,在神经元中富集)。结果发现Synj2a转录本在海马培养中比成纤维细胞高5倍(Figures 6B)。而成纤维细胞中Rrbp1的转录水平高出7倍(Figures 6C)。类似地,SYNJ2蛋白在神经元中比成纤维细胞中更丰富,而RRBP1则相反(Figures 6D)。
在COS-7细胞中过表达SYNJ2a和SYNJ2BP使Pink1 mRNA重新定位于线粒体(Figures 6E-6F)。相反,过表达SYNJ2BP的相关蛋白SYNJ1并没有改变Pink1胞质定位。SYNJ2a过表达对Pink1 mRNA的影响是选择性的,β-actin mRNA始终留在细胞质中(Figures 6E-6F)。此外,SYNJ2BP和SYNJ2a的过表达也导致线粒体聚类(Figures 6E)。因此,SYNJ2作为Pink1 mRNA的线粒体锚点,与Pink1初生链的协同翻译靶标一致。
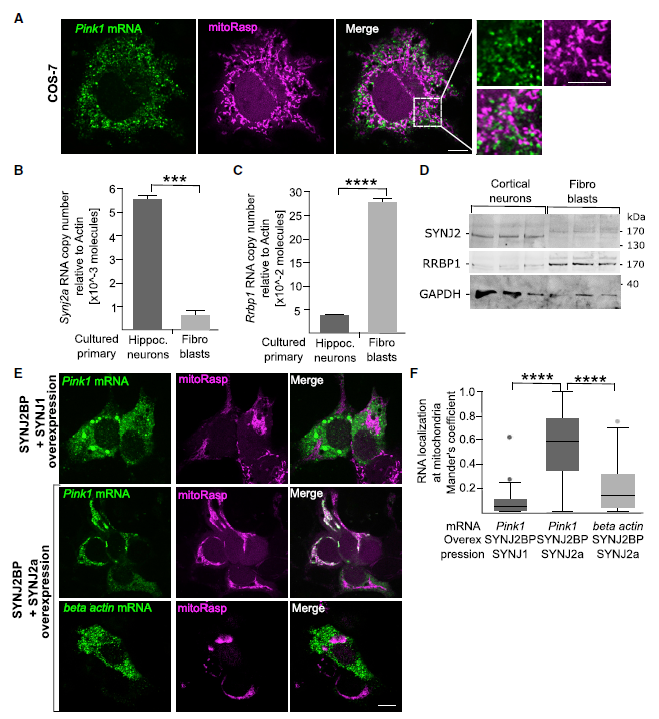
图6 Pink1 mRNA对线粒体的定位是神经元特异性的,依赖于SYNJ2a
7、RNA结合SYNJ2是Pink1 mRNA定位至线粒体所必须的
接下来进一步研究SYNJ2作为Pink1 mRNA的线粒体锚点的具体效应及其必须性。在HEK细胞中表达了SYNJ2的myc-tagged RRM结构域,并使用254 nm紫外交联和免疫沉淀CLIP技术。这说明RRM结构域可以与RNA交联,VQL残基向丙氨酸的突变破坏这种结合能力,阻止了交联物种的出现(Figure 7A)。为了确定SYNJ2a的RNA结合特性是否足以将Pink1 mRNA靶向到线粒体,作者创建了WT和VQL/AAA版本的人工锚点,其SYNJ2a通过跨膜结构域靶向到线粒体表面,即使不存在SYNJ2BP。结果显示,在神经元中过表达过表达SYNJ2mito足以克服SYNJB2P敲除和选择性重定位Pink1 mRNA到线粒体(Figure 7B-7C)。而SYNJ2mito VQL/AAA表达后,Pink1 mRNA则保持在胞质(Figure 7B-7C)。因此,SYNJ2的RNA结合能力可以介导Pink1 mRNA在线粒体中的定位。
之后,作者对SYNJ2mito WT或VQL/AAA突变体的HEK细胞进行转录组测序,筛选关键的基因(Figure 7D)。该分析产生了800多个优先绑定到SYNJ2mito WT(包括Pink1)的转录本。作者对检测到的和已报道的转录本进行重叠,但两种数据间重叠性很小(Figure 7E)。这支持了SYNJ2a在独立于SYNJ2BP介导的RNA结合而介导线粒体转录本亚组转运中的独特作用。
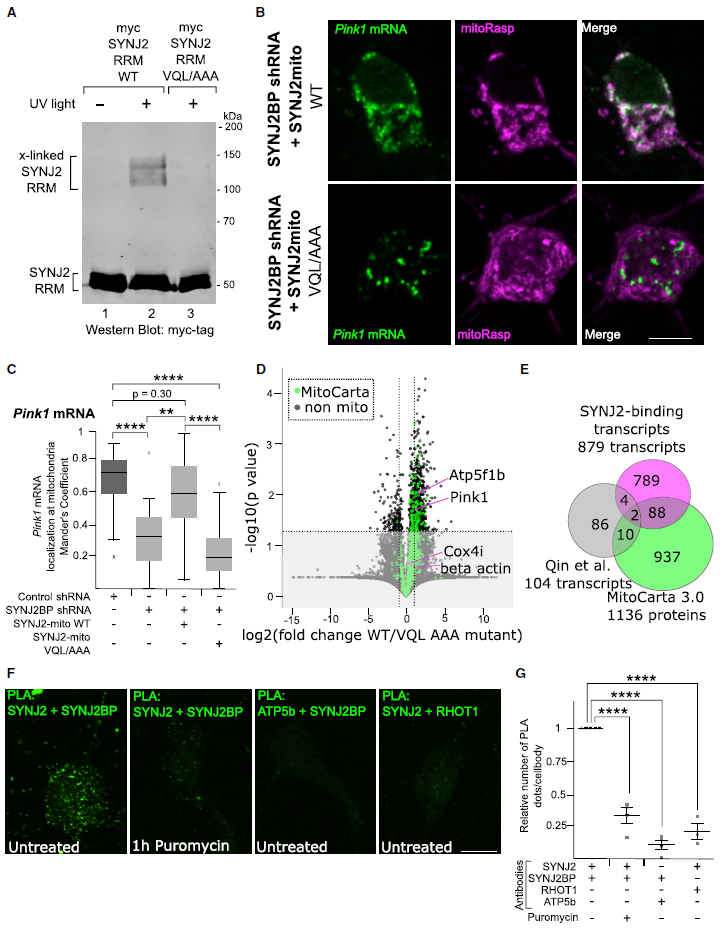
图7 SYNJ2a的结合对于Pink1 mRNA定位到线粒体是必要的
参考文献:
Harbauer Angelika B., Hees J Tabitha., Wanderoy Simone., Segura Inmaculada., Gibbs Whitney., Cheng Yiming., Ordonez Martha., Cai Zerong., Cartoni Romain., Ashrafi Ghazaleh., Wang Chen., Perocchi Fabiana., He Zhigang., Schwarz Thomas L.(2022). Neuronal mitochondria transport Pink1 mRNA via synaptojanin 2 to support local mitophagy. Neuron, undefined(undefined), undefined. doi:10.1016/j.neuron.2022.01.035






