去甲基酶ALKBH5通过PKMYT1 m6A修饰抑制胃癌侵袭
胃癌(GC)是严重危害人类健康的恶性肿瘤之一。GC转移是癌症治疗失败的主要原因之一,但m6A与GC转移之间的相关性报道较少。在GC样本中检测到ALKBH5表达降低,并且与临床肿瘤远端转移和淋巴结转移相关。ALKBH5干扰促进了GC细胞的转移,这种作用与ALKBH5的去甲基化酶活性密切相关。PKMYT1作为ALKBH5的下游靶点,促进了GC的侵袭和迁移。由ALKBH5敲除或其去甲基化酶活性突变引起的PKMYT1表达上调表明,ALKBH5以m6A依赖的方式调节PKMYT1的表达。IGF2BP3通过其m6A修饰位点帮助稳定PKMYT1的mRNA稳定性。本研究建立了ALKBH5-PKMYT1-IGF2BP3在转移中的调节系统,代表了GC转移的新治疗靶点。本文于2022年2月发表于Molecular Cancer(IF=27.401)上。
技术路线

结果
1)MeRIP‑seq揭示了m6A修饰基因与GC细胞粘附之间的强相关性,脱甲基酶ALKBH5的下调与GC预后相关
为了评估GC中m6A修饰的总体水平,随机选择5对临床肿瘤组织和相邻的正常样本。使用EpiQuik m6A RNA甲基化定量试剂盒,我们观察到GC组织中m6A的水平显著高于相邻正常组织(图1A),表明m6A可能参与GC的发生或进展。选择三对组织进行进一步甲基化RNA免疫沉淀测序(MeRIPseq)。在三对组织的MeRIP-seq分析中,m6A信号主要发生在mRNA转录本的终止密码子和3'UTR附近(图1B)。m6A修饰集中在GGACU基序上(图1C)。大多数基因在肿瘤组织中表现出较高水平的m6A修饰和mRNA表达(图1D)。GO分析表明,这些基因主要富集于细胞间粘附和上皮细胞迁移(图1E)。通过数据分析确定,大多数在肿瘤组织中表现出高m6A水平的基因也表现出显著高于相邻正常组织的mRNA水平(图1F)。
M6A水平主要由甲基转移酶和去甲基酶平衡,而甲基转移酶METTL3和METTL14被报道调节GC进展。然而,GC中去甲基化的机制报道较少。为了探索参与细胞迁移的关键去甲基化酶,利用TCGA数据库探索了m6A相关酶和迁移相关基因之间的相关性。数据显示ALKBH5与这些基因呈显著负相关,而FTO主要与它们呈正相关(图1G)。检测49例患者的GC组织和正常组织中的mRNA水平表明,ALKBH5在GC组织中的低水平表达显著,而GC和正常组织之间的FTO表达没有ALKBH5显著(图1H)。因此,我们重点研究了ALKBH5的表达及其在胃癌转移中的可能机制。TCGA和GEO数据库均显示GC中ALKBH5表达降低(图1I-J)。组织微阵列的统计分析还显示,相邻正常组织中ALKBH5的蛋白质水平显著升高(图1K-L)。ROC曲线表明,ALKBH5对GC的临床诊断具有高度敏感性和特异性(图1M)。生存分析还表明,ALKBH5高表达的患者预后改善(图1N)。临床统计显示,有远处转移的患者ALKBH5的表达低于无远处转移的患者(图1O)。在淋巴结转移组中也观察到类似的结果(图1P)。综上所述,ALKBH5的低表达可能是胃癌转移的根源。
2)ALKBH5在体外抑制GC的侵袭和迁移
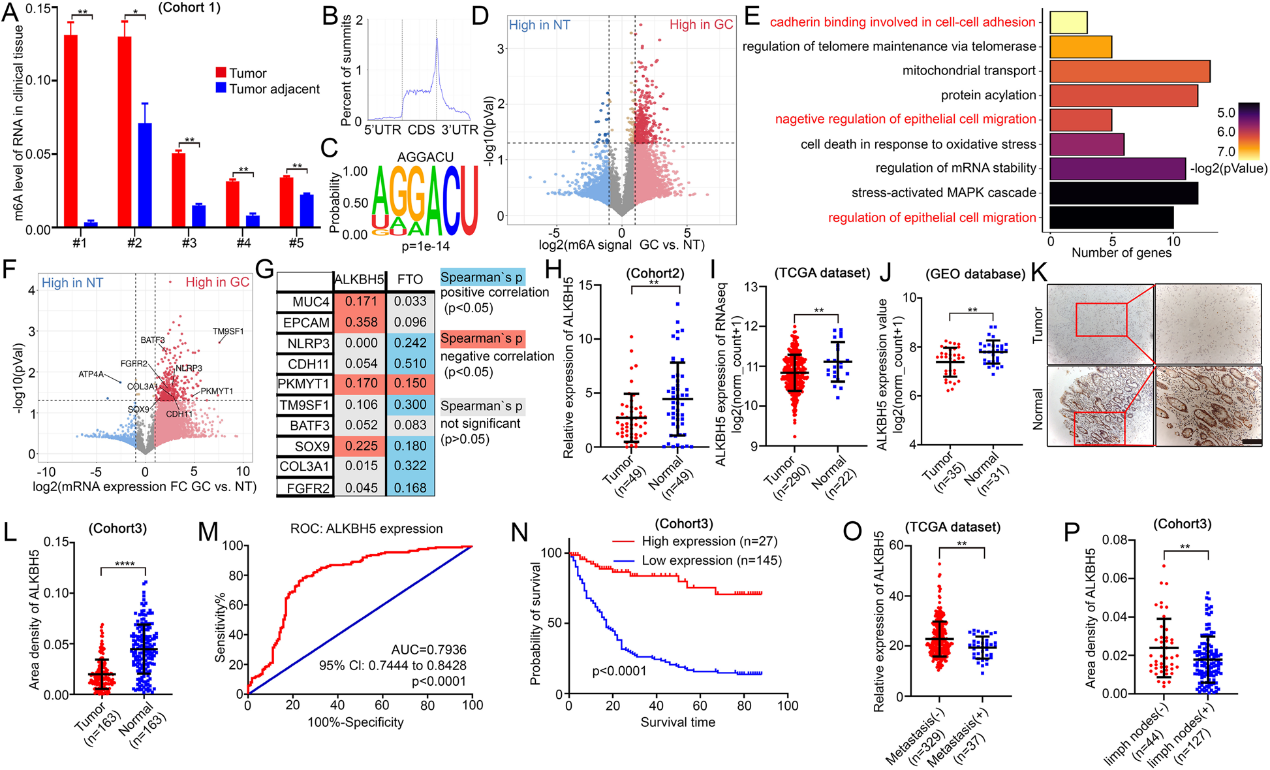
为了挖掘ALKBH5在GC进展中的潜在特征,我们进行了细胞实验。在HGC-27和BGC-823细胞中建立了ALKBH5的稳定过表达(图2A-B)。我们还沉默了SGC-7901细胞中的ALKBH5(图2C-D)。经transwell分析验证,ALKBH5过表达后,GC细胞的转移能力明显受到抑制(图2E、G),而在SGC-7901细胞中,ALKBH5敲除显著增强了GC细胞的转移能力(图2F、H)。伤口愈合试验发现,ALKBH5的上调显著抑制GC细胞的迁移能力(图2I)。ALKBH5表达的减弱加速了GC细胞的迁移(图2J)。为了阐明m6A在迁移中的作用,我们在HGC-27细胞中使用了ALKBH5 H204A突变体(图2K)。结果表明,ALKBH5突变对其mRNA或蛋白质水平的影响较小(图2M-N),但ALKBH5 H204A细胞中的m6A水平明显高于LV-ALKBH5 GC细胞(图2L)。与ALKBH5过表达相比,突变组的迁移和侵袭能力也增强(图2O-P)。这些数据表明,ALKBH5过表达对细胞侵袭的抑制主要取决于其去甲基酶活性。
3)PKMYT1被确定为ALKBH5的下游靶点
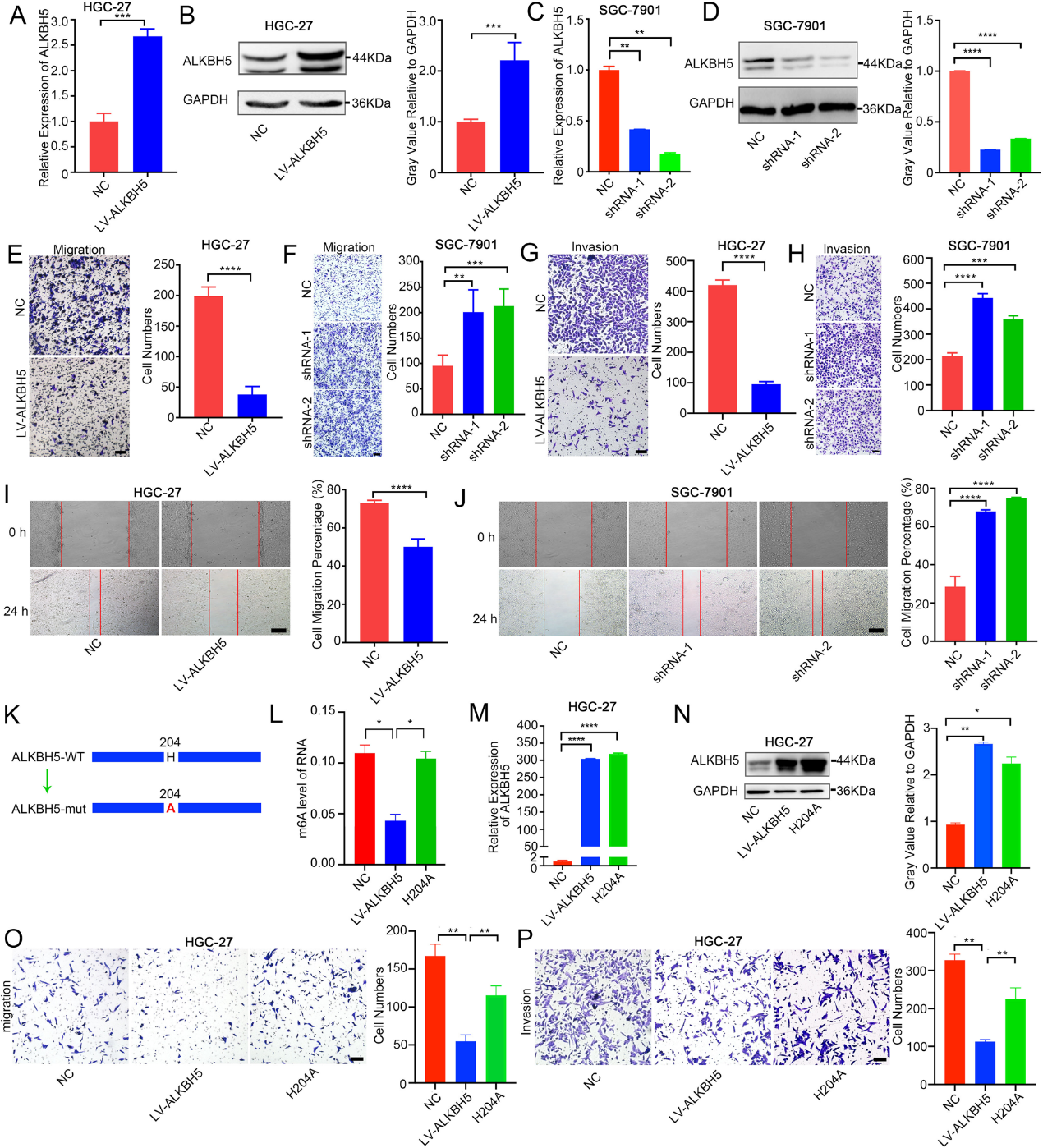
为了确定在ALKBH5下游起关键作用的主要靶基因,我们进行了MeRIP-seq和RNA-seq。为了进一步鉴定GC中必需的下游靶基因,我们进行GEPIA数据库分析和参考相关文献,确定四个候选基因(PKMYT1、NT5E、PXDN和MYH9)(图3A)。使用MeRIP-qRT-PCR和mRNA水平验证,我们发现当ALKBH5过表达或破坏时,只有PKMYT1表现出稳定的改变(图3B-F)。ALKBH5干扰SGC-7901细胞后,PKMYT1的m6A水平稳定增加(图3B)。PKMYT1的表达在过表达ALKBH5后显著降低(图3C-D),在干扰ALKBH5后显著增加(图3E-F)。RIP和RNA下拉试验均证明了ALKBH5和PKMYT1转录本之间的结合(图3G-H)。因此,我们初步怀疑PKMYT1可能是ALKBH5的下游效应器。
组织微阵列和TCGA数据库结果均显示PKMYT1在GC中高表达,其表达与不良预后密切相关(图3I-M)。ROC分析表明,PKMYT1在临床GC诊断中具有显著的差异性(图3N)。组织微阵列表达统计显示,ALKBH5和PKMYT1表达之间存在显著的负相关(图3O)。为了验证PKMYT1在GC转移中的独特作用,我们首先在GC细胞系中进行PKMYT1破坏和过表达。transwell分析表明,PKMYT1过表达后,GC细胞的转移能力明显增强(图S3H-J)。为了观察ALKBH5/PKMYT1对胃癌转移的影响,进行了一项挽救实验。结果显示,PKMYT1的过表达显著恢复了由ALKBH5过表达引起的转移能力(图3P-R),这些结果表明PKMYT1是ALKBH5的下游。

4)PKMYT1以m6A依赖的方式促进GC的侵袭和迁移
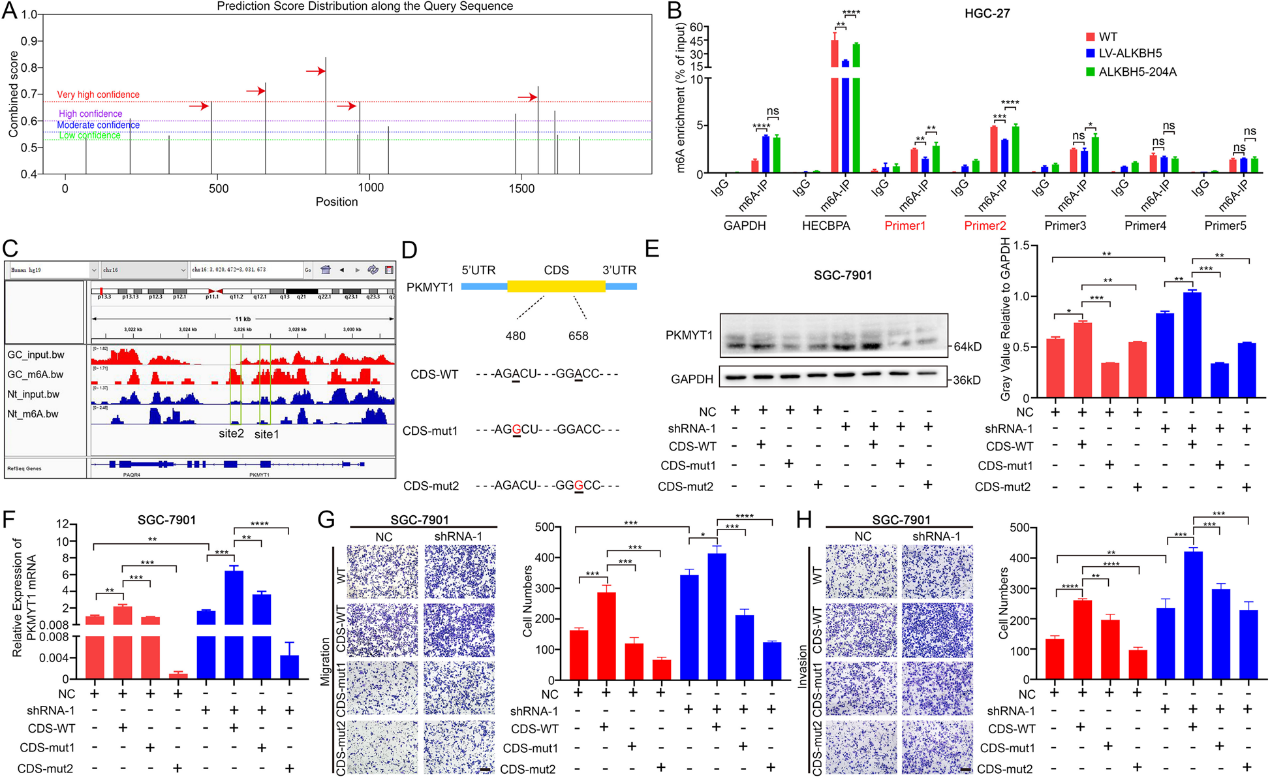
为了确定受ALKBH5影响的特定m6A位点,使用SRAMP网站预测PKMYT1的mRNA序列。预测结果显示,在PKMYT1的mRNA序列中,有五个潜在的m6A修饰位点具有非常高的可信度(图4A)。然后,设计了这五个位点的特异性引物。MeRIP-qRT-PCR显示,在ALKBH5过表达后,前两个位点对应的片段m6A水平显著降低(图4B)。当涉及ALKBH5去甲基化酶活性的残基发生突变时,它们的m6A水平得到恢复(图4B)。我们的数据表明PKMYT1 mRNA上的两个位点可能是ALKBH5调节的特定位置。在MeRIP-seq中也检查了GC组织中这两个位点的m6A水平。来自IGV基因组浏览器的结果表明,与正常组织相比,GC中两个位点的m6A修饰水平明显更高(图4C)。这两个位点的突变旨在观察m6A修饰对PKMYT1的影响(图4D)。结果显示,突变组PKMYT1的整体水平降低(图4E-F)。这两个位点的突变导致GC转移能力显著降低。这种现象在ALKBH5敲除后更为明显(图4G-H)。因此,PKMYT1以依赖于m6A的方式促进GC的侵袭和迁移。
5)PKMYT1 mRNA的M6A修饰通过IGF2BP3维持其稳定性
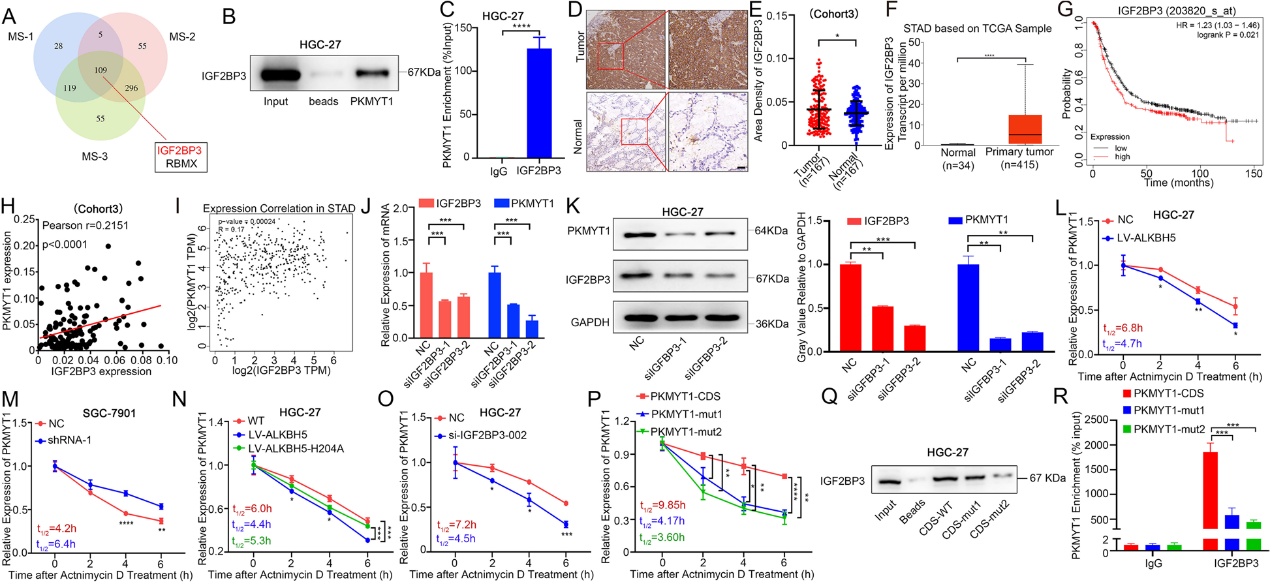
众所周知,m6A修饰主要依赖于“读取器”蛋白发挥额外功能。为了进一步研究PKMYT1的m6A修饰中潜在的“读取器”蛋白,进行了RNA下拉实验和质谱分析。质谱分析结果表明,IGF2BP3和RBMX在m6A修饰PKMYT1后可能发挥作用,而IGF2BP3的得分远高于RBMX(图5A)。我们选择IGF2BP3进行验证。RNA下拉和RIP分析均表明IGF2BP3可与PKMYT1 mRNA结合(图5B-C)。组织微阵列和TCGA数据库均显示IGF2BP3在GC中高表达,其高表达对GC患者预后不良(图5D-G)。组织微阵列和TCGA数据库结果均显示IGF2BP3和PKMYT1在GC中的表达呈显著正相关(图5H-I)。细胞系验证实验证实,干扰IGF2BP3后,PKMYT1的表达显著降低(图5J-K)。
据报道,m6A读取器蛋白IGF2BP3主要通过增强mRNA稳定性发挥作用。因此,我们评估了干扰和过表达ALKBH5后PKMYT1 mRNA的稳定性。研究发现,在放线菌素D处理下过表达ALKBH5后,PKMYT1的mRNA稳定性显著降低,但在干扰ALKBH5后,PKMYT1的mRNA稳定性显著增加(图5L-M)。在ALKBH5 H204A组中,PKMYT1 mRNA的稳定性得到恢复(图5N)。在干扰IGF2BP3后,观察到PKMYT1的mRNA稳定性显著降低(图5O)。为了研究m6A位点修饰对PKMYT1 mRNA稳定性的影响,在放线菌素D的作用下,用PKMYT1-CDS、mut1和mut2质粒转染GC细胞。观察到,这两个位点突变后,PKMYT1 mRNA的稳定性也降低了(图5P)。为了进一步探讨IGF2BP3和PKMYT1的m6A修饰位点之间的关系,我们采用体外转录分析和生物素标记的方法,分别合成了包含PKMYT1中单个m6A修饰位点突变的全长mRNA序列。在RNA下拉试验中,使用链霉亲和素结合免疫磁珠验证IGF2BP3和PKMYT1 mRNA之间的直接相互作用。发现在这两个位点突变后,IGF2BP3与PKMYT1 mRNA的结合能力显著下降(图5Q)。RIP分析也证实了类似的结果(图5R)。
6)ALKBH5、PKMYT1和IGF2BP3在体内的相关性
我们分别使用组织微阵列和TCGA数据库对肿瘤远处转移组和淋巴结转移组中PKMYT1和IGF2BP3的表达进行分析(图6A-D)。转移组PKMYT1的表达明显高于非转移组(图6A,C)。IGF2BP3和PKMYT1表现出相同的现象(图6B,D)。生存分析显示,高ALKBH5和低PKMYT1表达的患者预后最佳(图6 E)。值得注意的是,PKMYT1和IGF2BP3低表达的患者预后也最好(图6F)。接着,我们采用尾静脉注射法建立裸鼠肿瘤肺转移模型。通过分子成像软件观察肺转移的形成。ALKBH5的过表达降低了这些细胞形成肺转移的能力(图6G-H),而ALKBH5的突变(H204A)挽救了这种能力(图6G-H)。相反,ALKBH5的敲除显著加快了小鼠转移的形成(图6I-J)。肺组织切片的HE染色也显示,GC细胞中ALKBH5过表达后,转移性结节的数量显著减少(图6K-L)。通过IHC评估肺组织切片转移结节中ALKBH5和PKMYT1表达的相关性(图6M-N)。PKMYT1的表达在ALKBH5过表达后明显受到抑制,但在ALKBH5突变后得到恢复(图6M-N)。ALKBH5敲除后观察到相反的结果(图6O-R)。
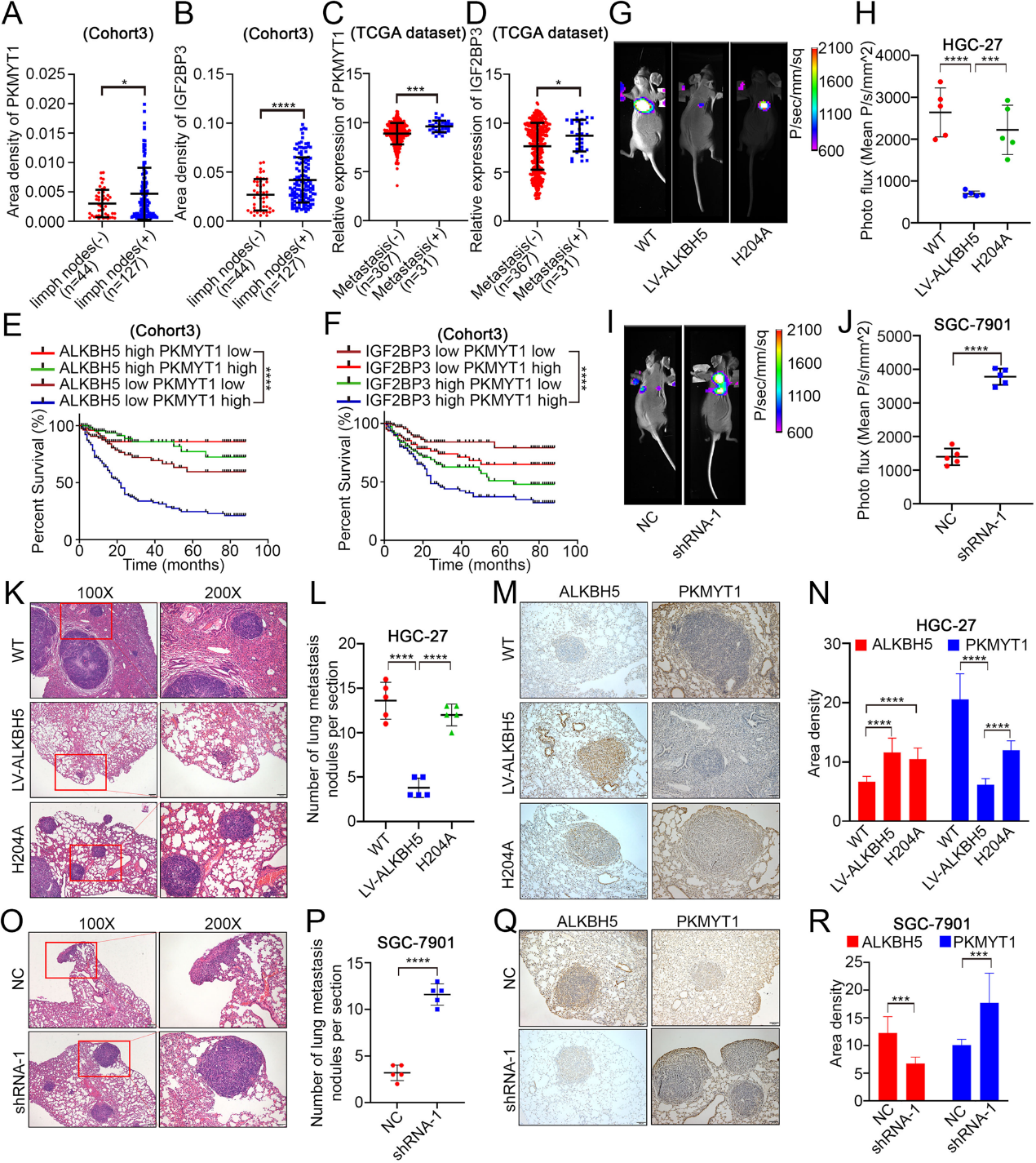
结论:我们确定ALKBH5是GC转移中的一种肿瘤抑制因子,这种作用依赖于ALKBH5的去甲基化酶活性。PKMYT1是ALKBH5的下游靶基因,经m6A修饰后可被IGF2BP3识别和结合。PKMYT1的mRNA稳定性增强,导致更高的表达水平,最终显著促进GC转移。
参考文献:
Hu Y, Gong C, Li Z, Liu J, Chen Y, Huang Y, Luo Q, Wang S, Hou Y, Yang S, Xiao Y. Demethylase ALKBH5 suppresses invasion of gastric cancer via PKMYT1 m6A modification. Mol Cancer. 2022 Feb 3;21(1):34. doi: 10.1186/s12943-022-01522-y.






