单细胞测序分析挖掘心球衍生细胞的起源和特性
从人类心脏活组织中产生的心球衍生细胞(CDCs)在临床试验中已被证明具有疾病修饰的生物活性。矛盾的是,CDCs在心脏的细胞起源仍然难以捉摸。本研究使用单细胞RNA测序(sc-RNAseq)研究了CDCs与心脏非肌细胞和非造血细胞(心脏成纤维细胞/CFs、平滑肌细胞/SMCs和内皮细胞/ECs)的分子特性。总之,CDCs是一种富含线粒体的细胞,具有独特的特性,但也与右心房CFs相似。CDCs表现出高度增殖、分泌和免疫调节的特性,这些特性也可在活化或炎症细胞类型中发现。通过特殊的培养条件,CDCs获得一些生物活性,包括血管生成潜力,这可以改变某些疾病的异常。 本研究于2022年3月发表在《Basic Research in Cardiology》IF:17.165杂志上。
技术路线如下:

主要实验结果如下:
CDCs分离自接受心脏手术的成人右心耳组织,并通过包括生长因子刺激在内的“3D心球”建立的(Fig. 1A)。为了评估CDCs不同的分子谱,将其与心脏成纤维细胞(CFs)、平滑肌细胞(SMCs)、内皮细胞(ECs)和脂肪组织来源成纤维细胞(AFs)等非心脏细胞类型进行比较。分别从心脏脂肪组织和皮下脂肪组织中分离出CFs和AFs(Fig. 1A)。冠状动脉搭桥术(CABG)患者的胸廓血管生成ECs和SMCs(Fig. 1A)。
首先qRT-PCR检测了这些细胞类型的表面标志物以验证是否分离正确(Fig. 1B–F)。随后免疫细胞化学染色或流式细胞术进一步评价选定标志物的蛋白水平(Fig. 1G–L)。总之,这些结果表明CDCs表现出与非肌细胞类型相似的分子特征。然而,CDCs明显不同于真正的心脏祖细胞(DIFF D6)和未成熟的心肌细胞(DIFF D8)。描述良好的CDCs标记物,如CD105,在AFs、CF、SMCs和ECs中均有表达。
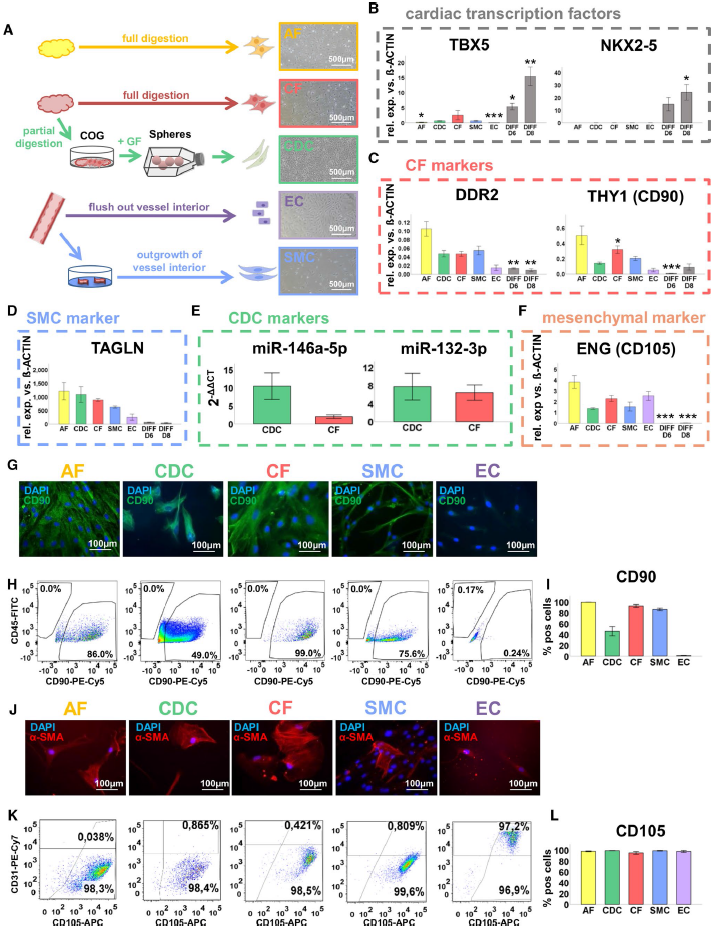
图1与其他原发性非肌细胞类型相比,成人CDC的特征
2、CDCs的单细胞RNA测序与主要的心脏非肌细胞类型进行比较
对CDCs细胞,和3中主要的心脏非肌细胞CF、SMCs和ECs进行单细胞测序。图2A根据细胞标识描述了细胞类型。对于CDCs,CF、SMCs和ECs,鉴定了上调的前10个基因(Fig. 2B)。CFs、SMCs、ECs和CDCs的无监督全局聚类根据其特定的基因表达将其细分为11个不同的聚类,从视觉上看,所有细胞类型都分裂成两个主要的簇,有时还会有进一步的亚簇,特别是对于CDCs来说,分为了5个亚簇(Fig. 2C)。为了更好地了解CDCs,研究了五个CDsC亚簇集群的GSEA。所有的细胞群都表现出主要的免疫调节特性,如“对细胞因子的反应” (Fig. 2D)。主要集群Cl4/7/3和Cl5/8两者之间的主要区别CDCs的Cl5/8似乎参与更有活力过程(线粒体,细胞呼吸,Fig. 2D)。为了更好地了解CDCs与CFs、ECs或SMCs之间是否存在显著的相似性,计算细胞相似性。在CDCs的样本中出现了三个峰,其中,峰值明显,第二峰值与CFs和SMCs相似度得分大致相同,最小峰值与SMC曲线的小峰平行(Fig. 2E)。到目前为止,sc-RNAseq结果显示CDCs表现出最多的线粒体基因,并以分泌和免疫调节特征区别于CFs、SMCs和ECs。然而,CDCs也显示出与非肌细胞类型的某些相似之处。
3、CDCs的单细胞RNA测序与分化的hESCs进行比较
为了更详细地比较CDCs与真正的心脏祖细胞(CPCs)和早期心肌细胞(CMs),纳入了分化的人ESCs (hESCs)的单细胞转录组数据,以在hESC分化过程中绘制谱系决定的轨迹图。hESC DIFF D6/D7/D8/D9/D15进行整合并生成UMAP图(Fig. 2F, G)。无监督聚类产生了8个聚类(Fig. 2G)。CDCs与CPCs或TBX5、GATA4和NKX2-5明显标记的早期CMs无重叠(Fig. 2F-H)。此外,CDCs与上皮细胞(群集5)或血管生成祖细胞(群集7)没有重叠(Fig. 2F, G)。然而,CDCs在簇中与分化的hESCs重叠,显示CF- (cluster 2)或增殖细胞(cluster 0,6)的特征(Fig. 2F, G)。有趣的是,早期定义的CDCs标志物如CXCL1、CXCL6和IL1B(图2B)在这种情况下对CDCs具有高度特异性(Fig. 2I)。综上所述,通过比较CDCs和分化的hESCs的sc-RNAseq数据,发现其与心脏祖细胞或早期心肌细胞没有重叠。
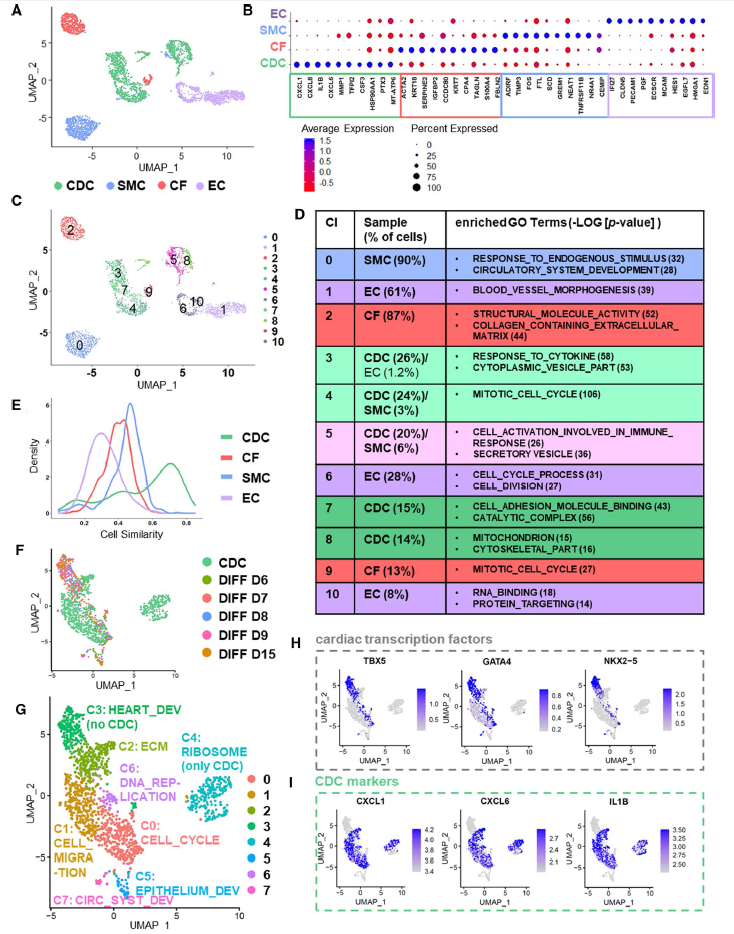
图2CDCs的单细胞RNA测序与主要的心脏非肌细胞类型(CFs、SMCs、ECs)和分化的hESCs进行比较。
接下来,试图阐明CDCs在成人心脏中的起源细胞群。因此,使用来自四个不同个体的右心房人活组织切片,并进行了单核(RA-1, RA-2)或单细胞(RA-3,单核(sn) RNAseq数据。心肌细胞(CMs) 单核(sn) RNAseq数据用的是前人的研究。将Sn-和sc-RNAseq活检数据与成人CDC sc-RNAseq数据进行整合,生成UMAP图。首先,单细胞和单细胞核很好地聚集在一起,因此能够在四个活检样本中识别所有主要的心脏细胞类型:CMs、CFs、ECs、SMCs/周细胞(PCs)、单核细胞/巨噬细胞(MPs)和B-/ t细胞(Fig. 3A–C)。新的CDCs标志物CXCL1/6/8和IL1B(图2B)也在巨噬细胞、树突状细胞和肥大细胞中表达(CXCL6除外)( Fig. 3C)。有趣的是,CDCs位于CFs附近(Fig. 3A、B)。77%的CDCs甚至共享CF-1集群。23%的CDCs建立了自己的集群(Cl7: CDC-2)。与CF相比,CMs离CDCs较远,EC和周细胞/SMCs离CDCs更远。
因此,推测CDCs可能是CF细胞状态的转变。为了验证这一点,试图使用单细胞轨迹分析。在CDCs的两个集群中(Cl7: CDC和Cl2: CF-1/CDC),检测到三个轨迹分支(编号为1、2和3) (Fig. 3D)。CDCs和CFs建立了三个主要的轨迹,其中cdc在伪空间的一端,CFs在另一端。为了了解其轨迹分支,研究了相关基因。为此,作者在Seurat中进行了额外的亚群分析,并分析了聚类0(映射到轨迹1)、7(映射到轨迹2)和12(映射到轨迹3)中的前25个特定基因(Fig. 3E)。GSEA表明,轨迹1主要与External encapsulating structure和ECM organization有关。轨迹2与locomotion and development有关。轨迹3,CDCs轨迹,与response to cytokine,immune system processes,secretion有关。
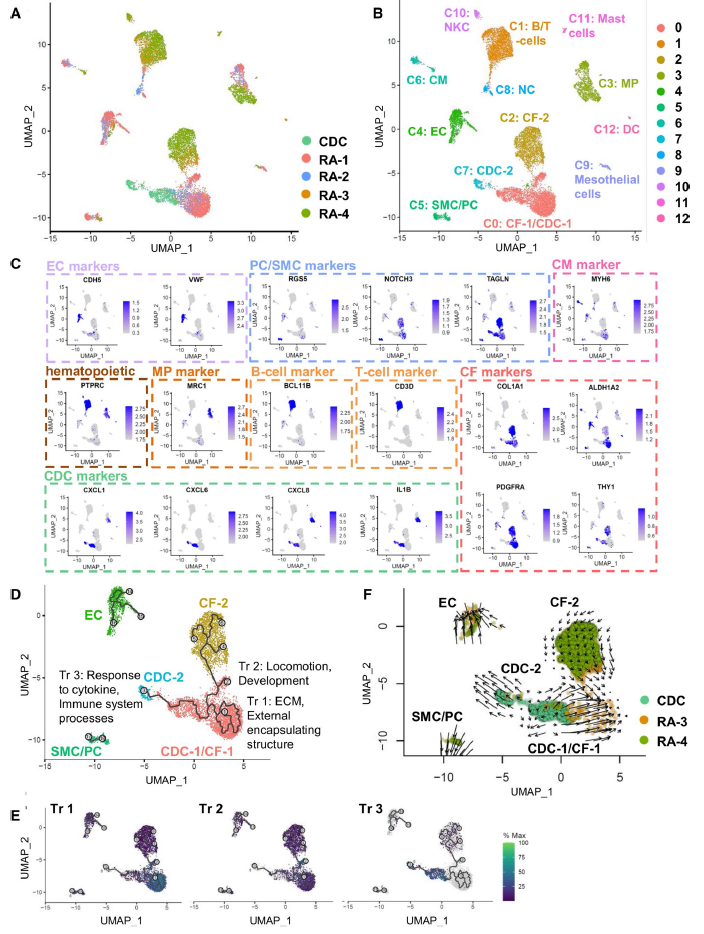
图3 sc-/sn- RNAseq对CDC和人心房活检的比较。
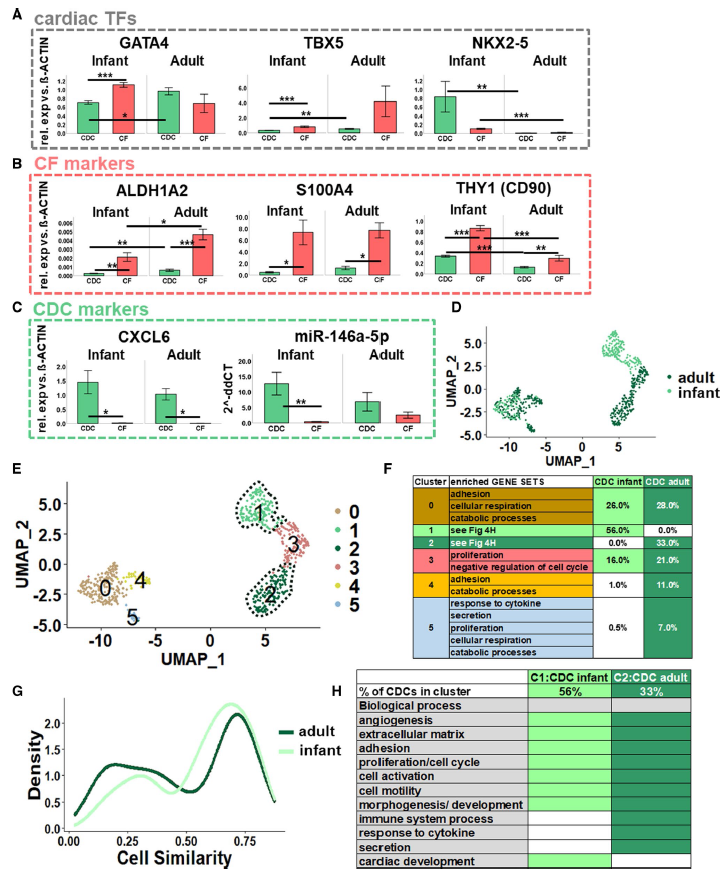
对来自新生儿或成人心房的人心肌细胞的再临床研究表明,在免疫缺陷梗死大鼠心脏移植后,新生儿心肌细胞比成人心肌细胞具有更强的修复能力。新生儿CDCs维持心肌功能,防止不良重塑,促进血管生成。所以作者试图阐明成人与婴儿CDCs的分子特征的区别。有趣的是,基因表达分析显示,与成人CDCs和婴儿CFs相比,婴儿CFs中心脏转录因子GATA4和TBX5的表达较低(Fig. 4A)。相比之下,NKX2-5在婴儿组(CDCs和CFs)的表达显著升高。CF标记物ALDH1A2在两个年龄组中与婴儿细胞相比在成人细胞中上调,与CDCs相比在CF中上调,S100A4在两个年龄组中,与CFs比较,都是在CDCs中上调,THY1 (CD90)也是如此(Fig. 4B)。CXCL6在两个年龄组的CDCs中均具有特异性,而miR-146a仅在婴儿组中与CFs相比在CDCs中具有特异性(Fig. 4C)。两个CDCs样本(婴儿和成人,图4D)的无监督全局聚类,根据其特定的基因表达将CDCs细分为6个聚类(Fig. 4E)。在婴儿和成人样本之间主要有两组(0,3)重叠(Fig. 4F)。通过计算细胞相似性,证实了婴儿和成人CDCs样本具有较高的相似性(Fig. 4G)。有趣的是,GSEA揭示了两个集群的具有几个相似的GO分类(Fig. 4H)。这些结果sc-RNAseq分析显示新生儿CDCs参与心脏发育过程,而成人CDCs更多地参与免疫调节和分泌。
6、CDCs和CF来源的细胞外囊泡(EV)介导的旁分泌效应
分析CDCs的旁分泌作用,如促进血管生成和抗纤维化作用或抑制心肌细胞凋亡。将不同细胞来源的EV和不同类型的心肌细胞共孵育,检测心肌细胞的管腔形成,结果发现,与CF-EV比较,CDC-EV显著促进心肌细胞血管生成和运动能力(Fig. 5A–I)。
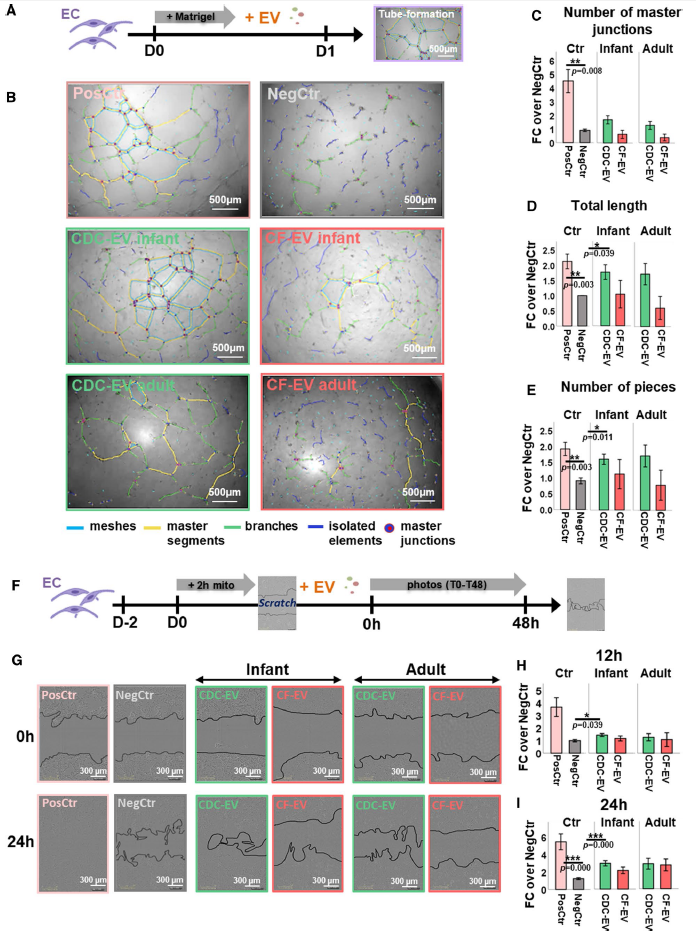
图5 CDC和CF来源的细胞外囊泡介导的旁分泌效应。
综上所述,本研究对培养的人原代细胞(CF、SMCs、ECs和CDCs)进行Sc-RNAseq分析,揭示了其分子特性的详细图像。CDCs是一种线粒体丰富的细胞类型(线粒体基因含量高),与CFs、SMCs和ECs的区别主要在于其分泌和免疫调节特性(Fig. 6)。
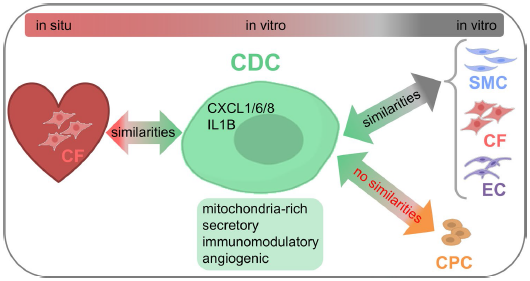
图6 CDCs的分子鉴定
参考文献:
Kogan, PS., Wirth, F., Tomar, A. et al. Uncovering the molecular identity of cardiosphere-derived cells (CDCs) by single-cell RNA sequencing. Basic Res Cardiol 117, 11 (2022). https://doi-org.blk.80599.net/10.1007/s00395-022-00913-y






