Let-7i-5p通过抑制肿瘤抑制性自噬促进鼻咽癌的恶性表型
miRNA调节基因表达,参与肿瘤的发生和发展。因此,识别与miRNA和治疗靶点相关的恶性表型将有助于改善鼻咽癌(NPC)的治疗。在这项研究中,我们证明let-7i-5p的过表达通过靶向NPC中的ATG10和ATG16L1从而促进恶性表型。根据对GEO和TCGA数据库的分析,let-7i-5p在鼻咽癌和头颈癌中的表达水平显著升高。通过对150例鼻咽癌组织的队列研究,我们发现let-7i-5p与晚期、复发、转移、淋巴结转移和不良临床结果相关。除了一系列体外细胞分析外,体内小鼠肿瘤模型显示let-7i-5p通过靶向ATG10和ATG16L1抑制自噬并促进NPC的恶性表型。我们的研究结果表明,let-7i-5p可能是鼻咽癌治疗的一个有希望的治疗靶点。本文于2022年1月发表于“Cancer Letters”(IF= 8.679)上。
技术路线
结果
1)Let-7i-5p在鼻咽癌组织中的表达水平升高,并与不良临床结果相关
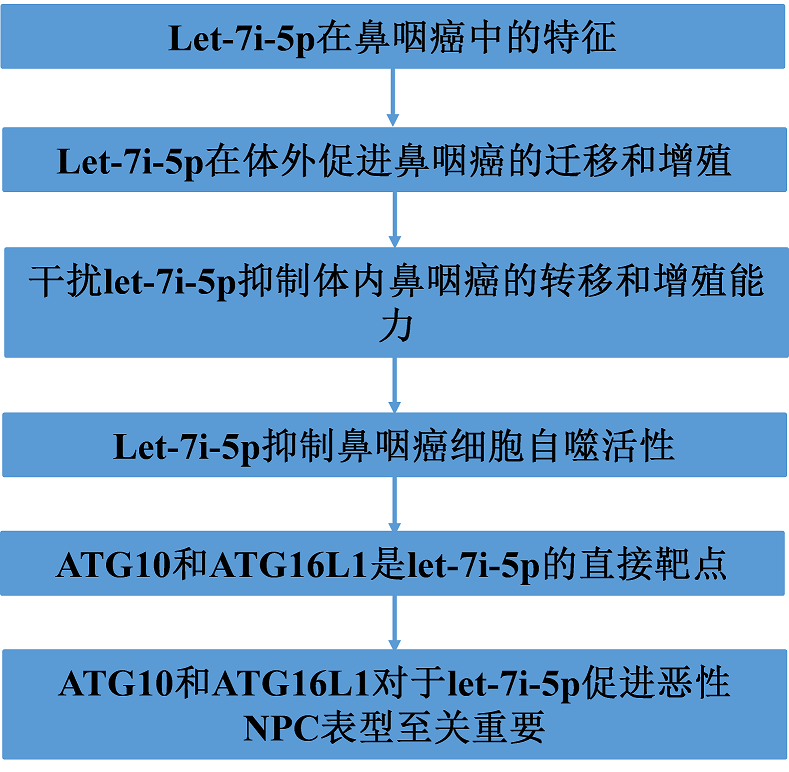
为了评估NPC miRNA表达谱,使用GEO数据库(GSE70970)对246个肿瘤组织和17个非肿瘤组织的微阵列数据集进行分析。这些数据显示,33个miRNA的表达发生了显著改变。排名前1-17位的候选基因是EBV相关的miRNA,第18位是let-7i-5p,它在NPC组织中显著增加,引起了我们的注意(图1A)。TCGA数据库查询用于确认let-7i-5p在头颈癌中的表达增加(图1B和C)。为了评估let-7i-5p在鼻咽癌中的作用,我们使用鼻咽癌组织芯片进行了原位杂交并进行了分析。结果显示,let-7i-5p在终末期疾病患者中显著上调,包括临床IV期、复发、远处转移和淋巴结转移(图1D-G)。Kaplan–Meier分析显示,let-7i-5p高表达患者的总生存率(OS)和无进展生存率(DFS)低于let-7i-5p低表达患者(图1H和I)。这些结果表明let-7i-5p的过表达在NPC进展中作为癌基因发挥作用,并代表一个有价值的预后生物标志物。
2)Let-7i-5p在体外促进鼻咽癌的迁移和增殖
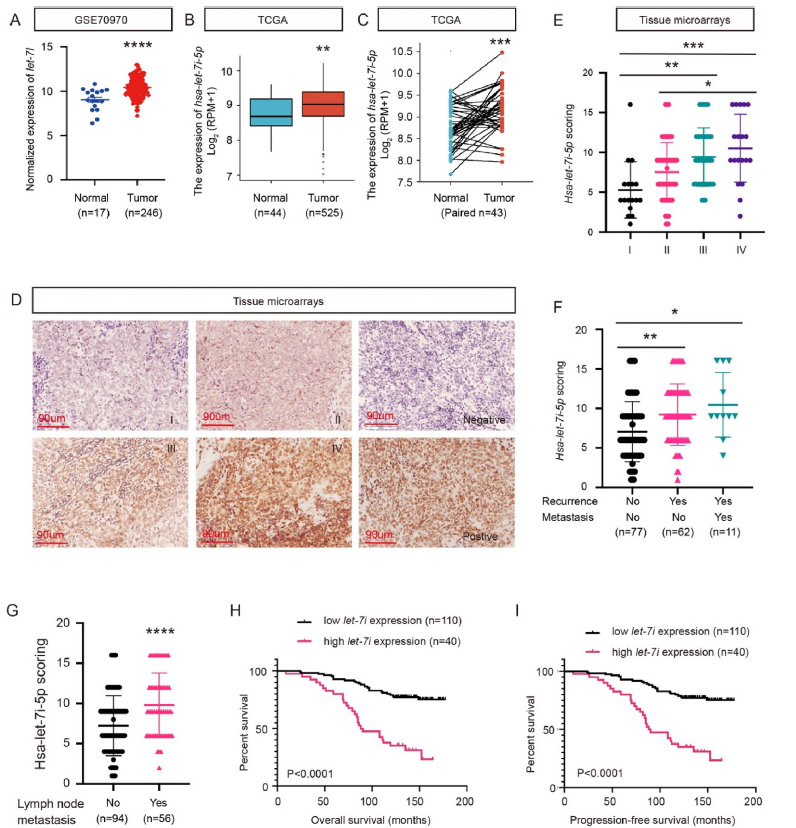
通过一系列细胞分析进一步探讨了let-7i-5p在鼻咽癌中的致癌作用。首先,使用qRT–PCR测定NPC细胞系和非癌鼻咽上皮细胞系NP69中的let-7i-5p水平。let-7i-5p在所有NPC细胞系中显著过表达(图2A)。因为CNE-2和5-8F细胞系的表达量最高,所以它们被用来研究let-7i-5p对鼻咽癌细胞的直接影响。在用let-7i-5p抑制剂转染后,测定干扰效率以确认生成具有低let-7i-5p表达的细胞(图2B和C)。然后使用伤口愈合试验、Transwell试验、菌落形成试验、EdU试验和流式细胞术来确定let-7i-5p对NPC细胞生长和迁移的影响。根据伤口愈合和Transwell分析,let-7i-5p下调抑制了细胞迁移(图2D-G)。此外,基于增殖特性实验,包括集落分析、EdU和流式细胞术,let-7i-5p敲除抑制NPC细胞的增殖能力(图2H-M)。这些发现表明let-7i-5p在体外调节鼻咽癌细胞的迁移和增殖。
3)干扰let-7i-5p表达抑制体内鼻咽癌的转移和增殖能力
为了确定let-7i-5p是否在体内促进鼻咽癌转移和生长,我们建立了小鼠肿瘤异种移植和肿瘤转移模型。在敲除let-7i-5p后,将细胞接种到裸鼠腋窝,以评估let-7i-5p对细胞生长的影响(图3A)。移植后21天,切除异种移植肿瘤并称重。let-7i-5p低表达的细胞增殖减少(图3B和C)。此后,我们使用小鼠肿瘤转移模型来评估NPC转移。通过尾静脉将具有let-7i-5p抑制或对照的细胞注射到裸鼠体内。在实验期间,通过每3天测量一次生物发光来监测转移。注射后45天,NC组的三只裸鼠出现肺转移,而let-7i-5p基因敲除组的小鼠没有出现转移(图3D和E)。肺组织的HE染色显示,let-7i-5p低表达的小鼠表现出减少的癌症病变(图3F)。综上所述,这些数据表明let-7i-5p可加速鼻咽癌的转移和生长。

4)Let-7i-5p抑制鼻咽癌细胞自噬活性
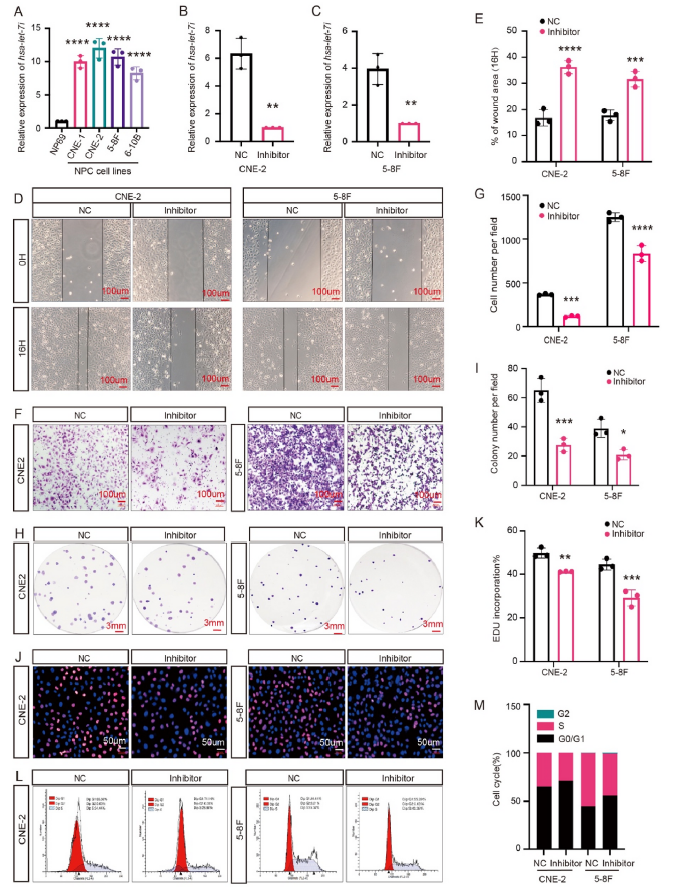
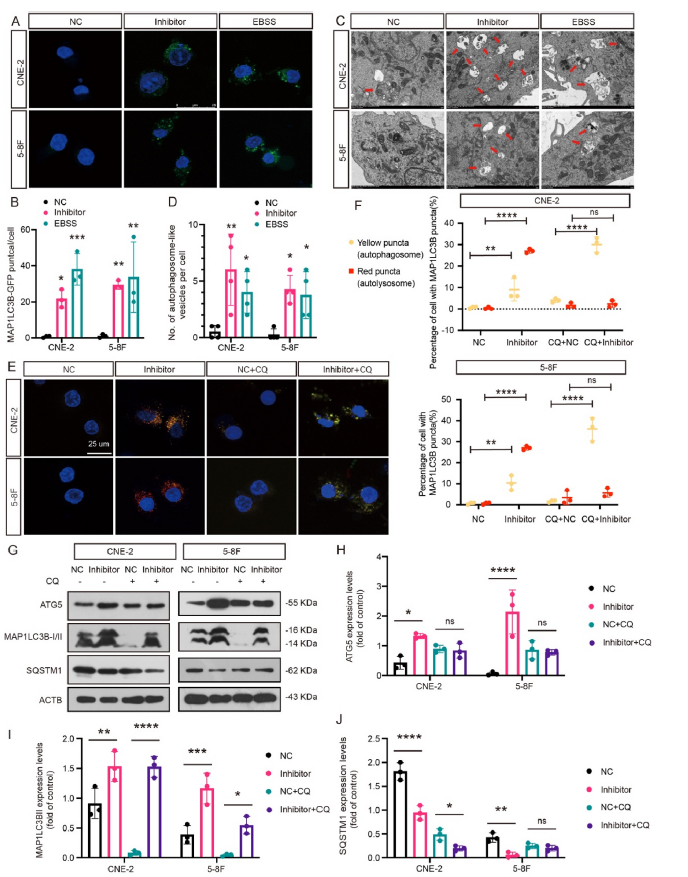
由于一些自噬相关的miRNA已被报道可加速恶性表型,我们研究了let-7i-5p是否调节NPC自噬活性。我们发现沉默let-7i-5p表达导致LC3聚集的显著诱导,表明自噬体形成增加(图4A-D)。然后使用串联单体mRFP-GFP标记的LC3来确定let-7i-5p在自噬通量中的作用。如图4E-F所示,let-7i-5p基因敲除后,黄色荧光自噬体和红色荧光自溶体的数量显著增加(图4E-F)。与单独使用氯喹(CQ)治疗相比,CQ和let-7i-5p敲除联合治疗导致黄色荧光自噬体进一步累积(图4E-F)。这些结果表明let-7i-5p能有效抑制鼻咽癌细胞自噬体的形成和自噬通量。此外,通过免疫印迹检测自噬标记物LC3-I、LC3-II、自噬底物p62和自噬相关基因ATG5。我们观察到,随着let-7i-5p基因敲除,ATG5和LC3-II表达增加,p62水平降低(图4G-J)。总的来说,这些结果表明let-7i-5p能有效抑制鼻咽癌细胞的自噬活性。
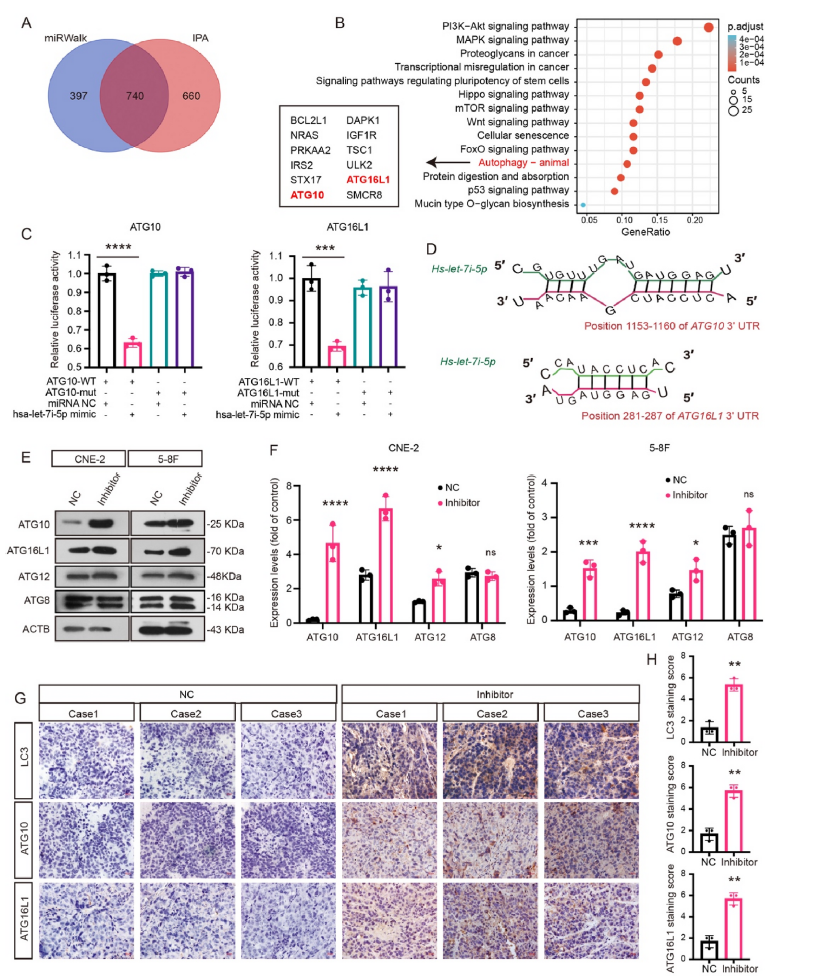
5)ATG10和ATG16L1是let-7i-5p的直接靶点
最近的研究表明,miRNA可以通过靶向自噬相关基因来调节自噬,从而影响恶性转化。因此,我们探索了let-7i-5p是否也通过靶向自噬相关基因来调节鼻咽癌细胞的自噬水平。使用生物信息学工具和两个miRNA数据库,740个基因被确定为let-7i-5p的潜在靶点(图5A)。为了进一步确定let-7i-5p调节自噬的靶基因,我们在对740个预测候选基因进行KEGG通路分析后,重点研究了自噬相关通路(图5B)。在12个自噬相关靶点中,自噬相关基因10(ATG10)和自噬相关基因16 L(ATG16L)因其在调节自噬中的直接作用而被选中。通过将目标基因(WT-3′UTR)的3′UTR或突变序列(mut-3′UTR)克隆到荧光素酶质粒中,使用荧光素酶报告基因分析验证了let-7i-5p与ATG10和ATG16L的3’-UTR之间的生物有效相互作用(图5C)。let-7i-5p、ATG10和ATG16L的潜在结合位点如图5D所示。此外,在let-7i-5p缺失的鼻咽癌细胞和异种移植瘤中,ATG10和ATG16L1表达水平显著升高(图5E-H)。在缺乏let-7i-5p的细胞中,ATG12(ATG12-ATG5-ATG16复合物的一部分)的表达增加,而在ATG8中未观察到明显变化(图5E-F)。由LC3表达确定的自噬活性证实了let-7i-5p对自噬的影响(图5G-H)。这些数据清楚地表明ATG10和ATG16L是let-7i-5p的直接目标。
6)ATG10和ATG16L1对于let-7i-5p促进恶性NPC表型至关重要
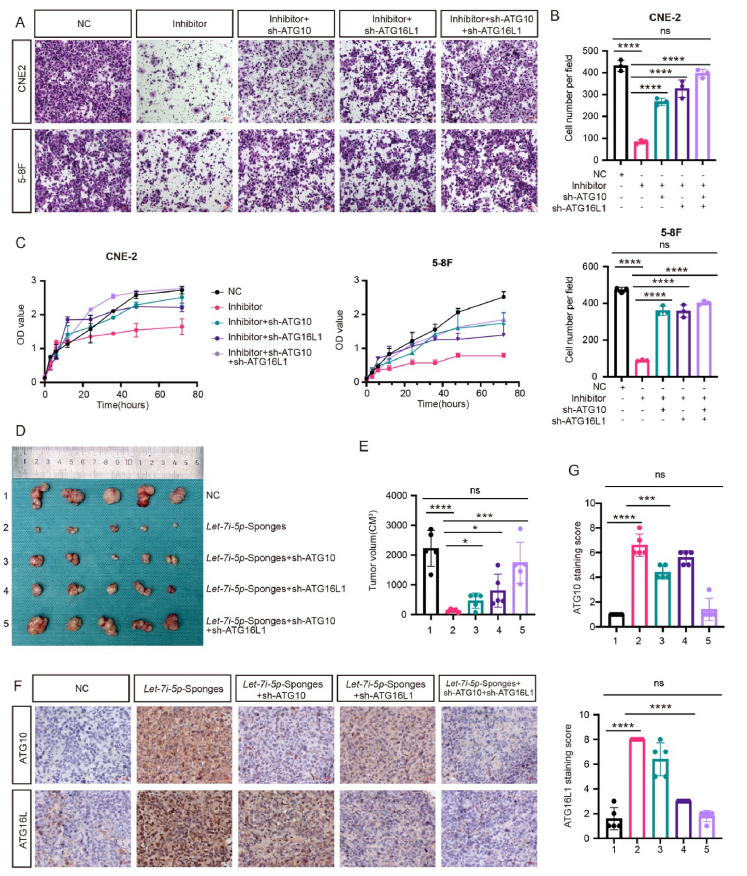
为了研究ATG10和ATG16L1是否逆转let-7i-5p诱导的NPC恶性表型,我们进行了体外和体内拯救实验。ATG10和/或ATG16L1的敲除消除了let-7i-5p抑制增加细胞迁移和增殖的能力(图6A-C)。此外,小鼠异种移植瘤实验结果显示,let-7i-5p抑制降低了鼻咽癌细胞的增殖;然而,这种效应在ATG10和ATG16L1抑制后降低(图6D-E),表明let-7i-5p促进恶性表型取决于其抑制ATG10和ATG16L1表达的能力(图6F-G)。这些结果表明let-7i-5p的促肿瘤作用需要自噬相关基因ATG10和ATG16L1。
结论:我们的研究揭示了let-7i-5p通过靶向ATG10和ATG16L1抑制自噬来促进恶性表型的机制。我们的数据表明,let-7i-5p水平在鼻咽癌晚期显著升高,有助于预测临床结果。我们的研究为基于let-7i-5p的鼻咽癌分子治疗策略的制定提供了潜在的临床应用和新的方向。
参考文献:
You B, Zhang P, Gu M, Yin H, Fan Y, Yao H, Pan S, Xie H, Cheng T, Liu H, You Y, Liu J. Let-7i-5p promotes a malignant phenotype in nasopharyngeal carcinoma via inhibiting tumor-suppressive autophagy. Cancer Lett. 2022 Jan 29;531:14-26. doi: 10.1016/j.canlet.2022.01.019.






