SUMOylation抑制增强多发性骨髓瘤对地塞米松的敏感性
多发性骨髓瘤(MM)是一种浆细胞恶性肿瘤。地塞米松(Dex)是MM治疗中使用最广泛的治疗药物,但患者会产生Dex耐药性,从而导致疾病的进展,因此迫切需要研究Dex耐药的驱动机制,并开发新的试剂来解决这一问题。目前有研究认为SUMO化修饰是调节Dex抗性的潜在机制,而抑制SUMO化修饰可以增强MM对Dex定的敏感性。该研究发表在《Journal of Experimental & Clinical Cancer Research》,IF:11.161。
技术路线:

主要研究结果:
1. 在原发病人样本和细胞系中,抑制SUMOylation增强Dex抗MM的活性
作者前期通过数据库和文献得到MM浆细胞中较高的SUMO E1(UBA2)基因表达与更短的存活时间相关。随后观察到UBA2表达水平与Dex IC50s呈显著正相关,提示UBA2表达与MM细胞Dex耐药相关(图1A)。
用TAK-981(一种新型的选择性SUMO E1酶小分子抑制剂)处理MM1S细胞,检测SUMOylated蛋白(图1B)。TAK-981以剂量依赖的方式抑制整体SUMOylation,并诱导凋亡标志物cleaved PARP。然后,测试TAK-981单药和Dex联合治疗对MM的影响。在从复发骨髓瘤患者分离的原发MM细胞中,TAK-981联合Dex治疗比单药治疗显著增强了对MM细胞的杀伤力 (图1C)。进一步的细胞毒性实验发现TAK-981与Dex在MM1S和MM1R细胞株中均有协同作用(图1D)。Dex对MM1R细胞的诱导凋亡和抑制增殖作用有限。相比之下,TAK-981在两种细胞系中诱导细胞凋亡并降低细胞活力,与Dex联用后效果进一步增强(图1E)。瞬时敲除SAE2、UBC9可显著提高MM1R细胞Dex敏感性(图1F)。稳定敲除SAE2、UBC9的细胞对Dex处理均表现出显著的反应,MM1R cells的IC50s值均下降(图1G)。这些数据表明,SUMOylation与Dex抗性有关,抑制SUMOylation增强了Dex敏感性
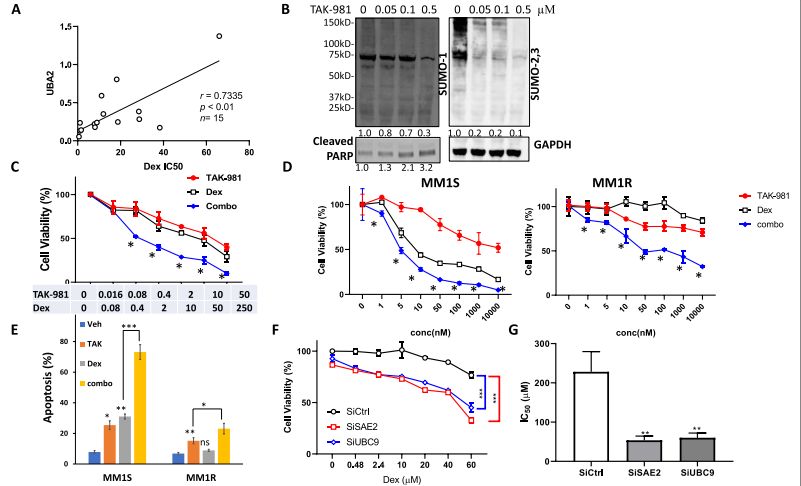
图1在原发性多发性骨髓瘤细胞和MM细胞系中,抑制SUMOylation与Dex协同降低细胞活力
2. TAK-981在体内显示出抗MM活性
通过构建小鼠两种异种移植模型,发现与对照组相比,TAK-981治疗组小鼠骨髓瘤负担显著降低(图2A-B)。另外,与体外实验一致,Dex单独治疗不影响肿瘤生长,而TAK-981与Dex联合治疗时,能显著抑制肿瘤生长,进一步降低肿瘤负荷(图3C)。免疫组化染色分析表明Dex单独处理几乎没有诱导细胞凋亡,而TAK-981处理组明显诱导cleaved PARP表达,Dex联合处理后cleaved PARP表达水平更高(图2D)。结果表明,TAK-981具有较强的体内抗MM活性。
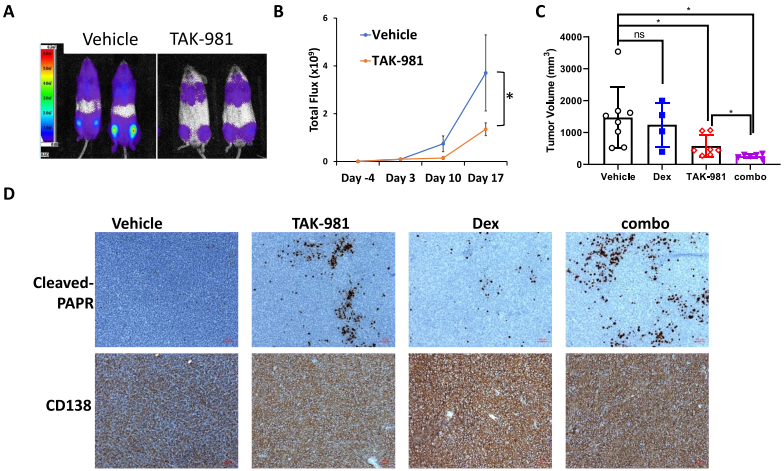
图2 TAK 981在体内抑制MM肿瘤生长并与Dex协同作用
3. 抑制SUMOylation通过下调miR-130b上调GR来提高Dex的敏感性
有报道称GR的表达是Dex反应的主要机制,并与MM患者较好的预后有关。研究发现GR表达与原代MM细胞Dex IC50s值呈负相关 (图3A)。基于SUMOylation抑制增强了Dex的敏感性,进而评估抑制SUMOylation对GR表达的影响:在TAK-981治疗48小时后,剂量依赖性GR (NR3C1) mRNA上调(图3B)。据报道,通过靶向3’-UTR下调GR mRNA水平的miR-130b,在相同的原代MM细胞中,经TAK-981处理后显示出剂量依赖性降低(图3C)。在TAK-981处理的原代MM细胞中也诱导了GR蛋白水平(图3D)。在MM1S和H929细胞系中观察到类似的GR水平诱导和miR-130b降低(图3E和F)。TAK-981降低了MM1S和H929细胞中RRM2水平,并进一步协同降低Dex对RRM2的降低。相应的诱导凋亡标志物cleaved PARP(图3G),表明TAK-981对Dex细胞毒性的增强与GR regulated RRM2的抑制有关。SAE2水平较低(Sumoylization low)的患者GR抑制基因RRM2表达较低,GR激活基因RASD1水平较高。该分析支持了表明SUMO化抑制上调GR途径。
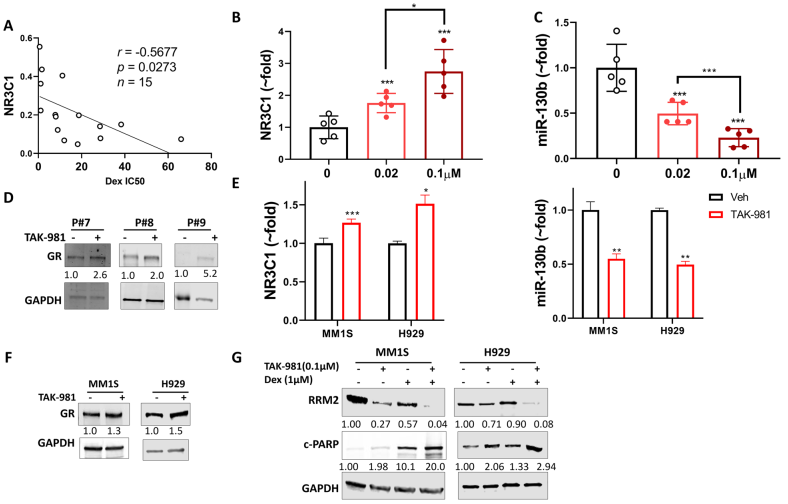
图3 TAK-981通过下调miR-130b上调原发性多发性骨髓瘤和细胞系中GR的表达
4. 抑制SUMOylation通过调控miR-551b和miR-25提高了MM对Dex的敏感性
miR-mimic转染后,过表达miR-551b和miR-25可促进MM细胞增殖并降低MM1S细胞的Dex敏感性,IC50s增加约4倍(图4A-B)。miR抑制剂转染miR-551b和miR-25后,miR-551b和miR-25的下调抑制了MM1R细胞的生长并增强了Dex敏感性,IC50s从875 μM下降到193和142 μM(图4C-D)。这些数据表明,miR-551b和miR-25的表达可能与MM对Dex的耐药有关。
由于PJA1和ZNF280C在MM细胞中没有大量表达,因此ZFP36成为miR-551b的唯一潜在靶点。ZFP36编码的tristtrprolin (TTP)是一种RNA结合蛋白,通过破坏Cyclin D1和E2F1 mRNA的稳定性在癌细胞增殖中发挥重要作用。通过转染miR-551b inhibitor下调miR-551b水平,导致TTP水平升高,Cyclin D1和E2F1水平下降(图4E)。ZFP36与miR-551b在初次MM样本中的表达呈负相关(图4F),进一步表明miR-551b调节ZFP36的水平。miR-25的下调显著提高了ULK1的水平。敲低miR-25导致p27水平升高,这与MM初发样本中p27 mRNA水平与miR-25呈负相关的观察结果一致(图4G-H)。
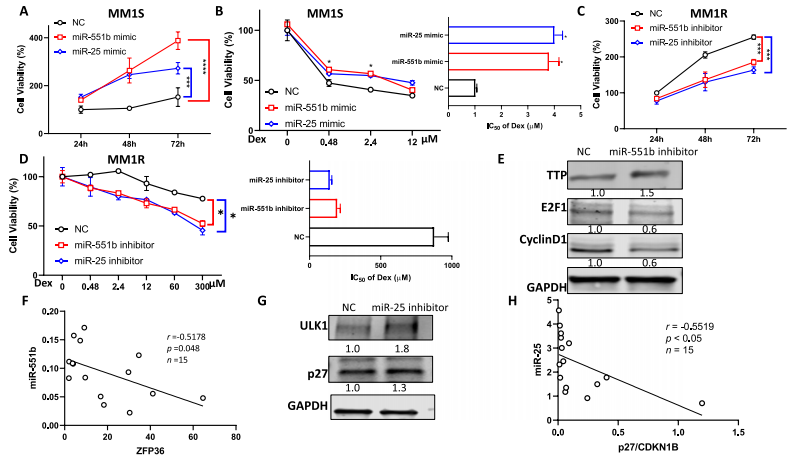
图4 MiR-551b和MiR-25水平对MM Dex敏感性的影响
MM1R细胞的miR-551b和miR-25水平高于MM1S(图5A)。Dex处理降低了MM1S中这两种miRs的水平,但对MM1R没有影响,而TAK-981处理降低了MM1S和MM1R细胞系中这两种miRs的水平,并在与Dex联合时进一步降低(图5A)。通过siRNA瞬时转染,SAE2或UBC9的下调降低了MM1R中miR-551b和miR-25的水平(图5B)。另外,与细胞实验结果一致,TAK-981治疗组miR-551b和miR-25水平降低,并在MM1R异种移植瘤组织中联合Dex治疗后进一步降低(图5C)。用不同浓度的TAK-981、miR-551b和miR-25处理5个原始MM样本,其水平均呈剂量依赖性显著降低,表明SUMOylation对miR-551b和miR-25的调控并不局限于细胞系(图5D)。并且TAKU-981诱导miR-551b靶基因TTP表达,导致MM1R细胞Cyclin D1和E2F1降低,诱导miR-25靶基因ULK1和p27的表达(图5E)。RNA-seq的GSEA分析显示,TAKU-981影响细胞周期、凋亡和自噬基因集(图5F),提示可能是通过这些基因靶向microRNAs- miR-551b和miR-25水平来达到作用。SAE2水平低的患者(UBA2;UBA2low组)的ZFP36(miR-551b靶基因)和ULK1(miR-25靶基因)水平高于SAE2水平高的患者(UBA2;UBA2high组)(图5G)。该分析进一步支持了SUMOylation调控miR-551b, miR-25及其靶基因的表达。
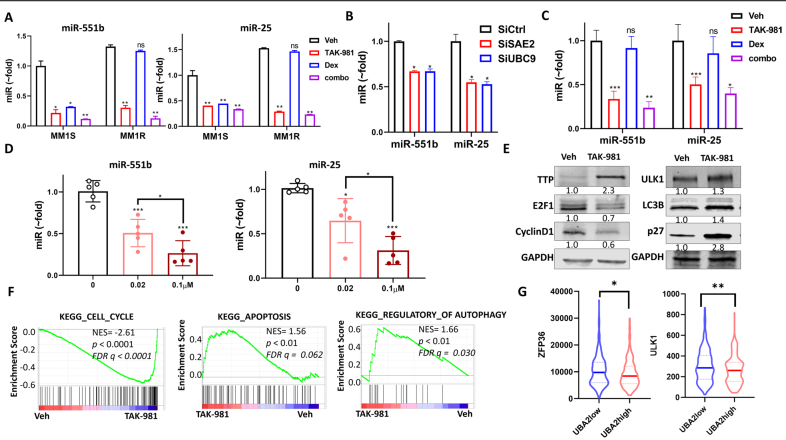
图5抑制SUMOylation降低miR-551b和miR-25水平
5. 抑制SUMOylation通过c-Myc降低miR-551b、miR-25和miR-130b的表达
在MM1S细胞中,c-Myc诱导的miR-551b、miR-25和miR-130b的pri-miR水平的增加可通过添加TAK-981处理来抑制(图6A)。在MM1S细胞中siRNA转染c-Myc (siMyc)导致pri-miRs和成熟miR水平显著降低(图6B)。在Dex诱导的c-Myc敲低后,pri-miRs和成熟miRs下降(图6C)。TAK-981处理显著降低了MM1S和MM1R细胞中这些miRs启动子区域c-Myc结合的占用率(图6D),证明SUMOylation通过c-Myc结合到启动子区域来调节这些miRs的转录。Dex在MM1S细胞中对c-Myc的结合略有降低,而在MM1R细胞中对c-Myc的结合无影响,说明这些miRs参与了MM对Dex的敏感性。通过观察15例复发患者原发MM细胞中c-Myc和SAE2水平与miR-551b、miR-25和miR-130b的表达之间的显著正相关,qPCR进一步证实了miR-551b、miR-25和miR-130b对MM细胞c-Myc和SAE2的调控(图6E-F)。这些都表明,SUMOylation通过介导c-Myc调控miR-551b、miR-25和miR-130b的表达。
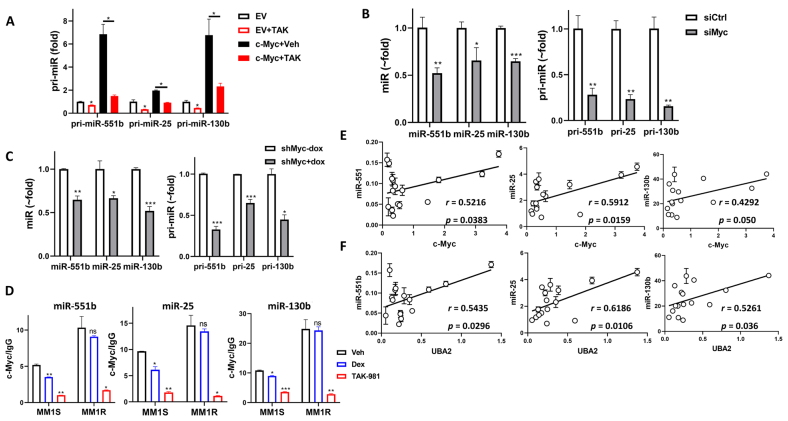
图6 c-Myc是miR-551b、miR-25和miR-130b的主要转录因子
6. 抑制SUMOylation降低了c-Myc水平
Dex降低了Dex敏感的MM1S细胞中的c-Myc蛋白,但对MM1R细胞没有影响。然而,TAK-981处理显示MM1S和MM1R细胞系中的c-Myc蛋白均减少,并且与Dex联合使用时导致进一步减少(图7A)。GSEA显示TAK-981处理抑制了MM1S和MM1R细胞中Myc靶基因集,TAK-981和Dex联合处理比单独处理Dex更能抑制Myc靶基因集(图7B)。并且TAK-981处理MM1R细胞后,c-Myc蛋白水平呈时间依赖性下降(图7C)。与对照相比,TAK-981处理后的骨髓瘤细胞中c-Myc下降更快(图7D),表明抑制SUMOylation通过增强c-Myc的降解而下调了c-Myc。另外,western blot结果显示,TAK-981处理后,SUMOylation的c-Myc明显减少(图7E)。这些结果证明了c-Myc可通过直接SUMOylation进行调控。
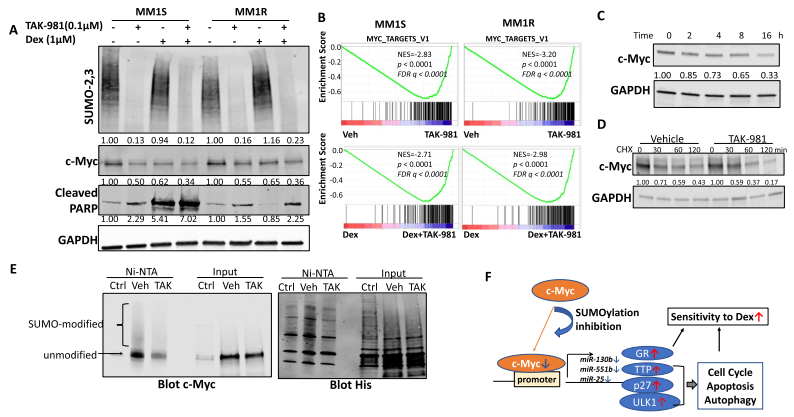
图7 抑制SUMOylation通过调节蛋白稳定性降低了c-Myc蛋白水平
结论
该研究发现,SUMOylation抑制通过增加GR,降低miR-551b和miR-25,提高了MM对Dex的敏感性。SUMO E1抑制剂TAK-981大大提高了MM细胞系、原代样本和小鼠异种移植模型对Dex的敏感性。TAK-981与Dex联用具有明显的体内外协同抗MM作用。






