具核梭杆菌减少METTL3介导的m6A修饰,并有助于结直肠癌转移
近年来的研究表明,微生物与宿主的相互作用在结肠直肠癌(Colorectal cancer,CRC)中发挥重要作用。随着宏基因组测序技术的发展,发现了多种参与CRC致癌的微生物群,其中具核梭杆菌(Fusbacterium nucleatum,Fn)能通过调控机体免疫应答、表观遗传及宿主代谢等多个方面促进结直肠癌的发生发展,然而其潜在的机制仍不清楚。本研究中作者探索在CRC发生发展中的调控机制。本研究于2022年3月发表于《Nature Communications》,IF=14.919。
本文技术路线:
本文主要内容:
1 具核梭杆菌减少了人CRC细胞和移植模型组织中METTL3介导的m6A修饰
斑点杂交分析显示,与对照组和大肠杆菌共培养的细胞相比,与具核梭杆菌共培养的细胞中m6A水平显著降低(Fig 1a)。在另一种CRC细胞LoVo中也观察到具核梭杆菌对m6A修饰的下调。有趣的是,具核梭杆菌短期处理能够诱导mRNA m6A修饰的减少(Fig 1b)。通过超高效液相色谱-四极萃取质谱分析也证实了经具核梭杆菌细胞处理后,m6A在总mRNA中的显著下降 (Fig 1c)。此外具核梭杆菌处理显著促进了细胞迁移 (Fig 1d)。
已经研究证明,m6A写入器和擦除器参与了m6A修饰的动态稳态。Western blot结果显示,在HCT116和LoVoF细胞中,具核梭杆菌处理明显降低了HCT116细胞中 m6A甲基化酶METTL3的表达(Fig 1e)。而具核梭杆菌处理对其他m6A橡皮或读写器的表达无明显影响(Fig 1e),提示m6A修饰的减少可能是由具核梭杆菌下调METTL3所致。
作者建立了CRC移植模型模型PDX (Fig 1f)。发现具核梭杆菌处理的PDX肿瘤组织体外核体m6A整体水平明显下降(Fig 1g)。与大肠杆菌处理或PBS对照相比,具核梭杆菌处理的PDX组织中METTL3 mRNA水平也显著降低(Fig 1h)。
野生型METTL3的异位表达挽救了具核梭杆菌引起的m6A水平下降,而非其催化突变体(Fig 1i)。此外,作者试图确定METTL3介导了m6A修饰是否参与了具核梭杆菌处理诱导的CRC细胞迁移增强。Transwell检测表明,过表达野生型METTL3,而非其催化突变体,明显逆转了具核梭杆菌处理增强的HCT116细胞侵袭能力(Fig 1J)。综上所述,具核梭杆菌通过下调人结直肠癌细胞和PDX组织中METTL3 介导的m6A修饰水平,从而促进结直肠癌细胞的侵袭。
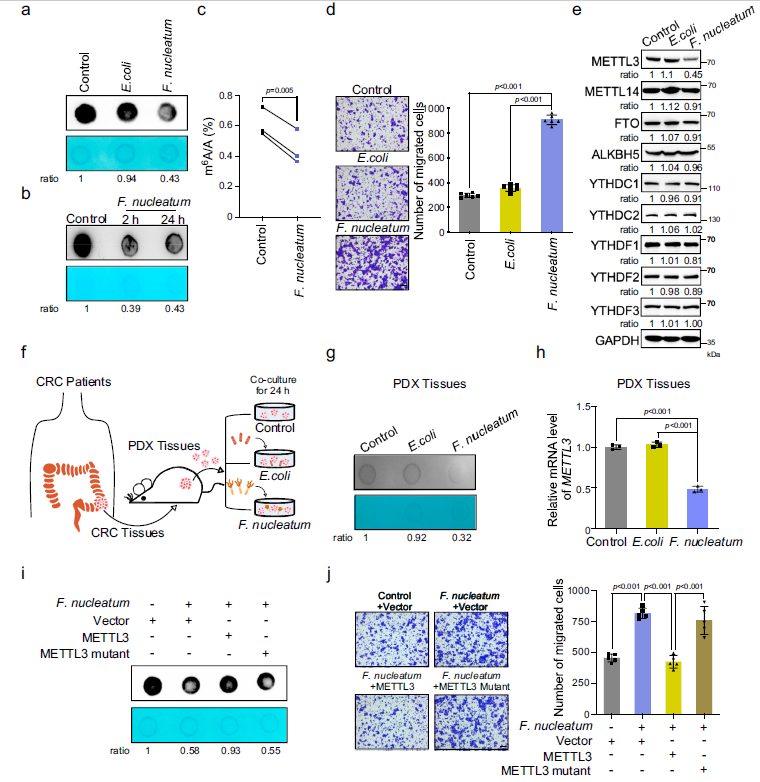
Fig1 具核梭杆菌可减少人CRC细胞和PDX组织中METTL3介导的m6A修饰
2 具核梭杆菌通过调节Hippo-YAP信号通路抑制METTL3
NF-κB和hippoyap信号通路相关基因在HCT116和LoVo细胞中都被激活(Fig 2a,b)。作者分离的细胞质和核成分HCT116细胞,发现具核梭杆菌增加了YAP在细胞核中的比例(Fig 2C)。免疫荧光检测结果也证实了YAP显著升高,Transwell实验表明,YAP基因的敲除可显著逆转具核梭杆菌诱导的HCT116细胞和 LoVo细胞迁移能力的增强(Fig 2g)。于是作者提出YAP是否调控METTL3的表达。当YAP被两种不同的siRNA沉默时,METTL3蛋白水平和m6A水平显著升高(Fig 2 h,i)。相反,YAP异位表达下调METTL3和m6A水平,提示YAP信号通路可能是CRC细胞中METTL3的负向上游调节因子(Fig 2j,k)。此外,过表达METTL3可以抑制YAP异位表达引起的细胞迁移(Fig 2l)。作者还验证了在具核梭杆菌存在下,YAP在调控基因表达中的作用对METTL3的调控作用。结果表明,具核梭杆菌处理降低了METTL3的表达,而YAP却几乎完全挽救了下调(Fig 2m),提示在CRC细胞中,YAP信号通路参与了具核梭杆菌诱导的METTL3表达下调。
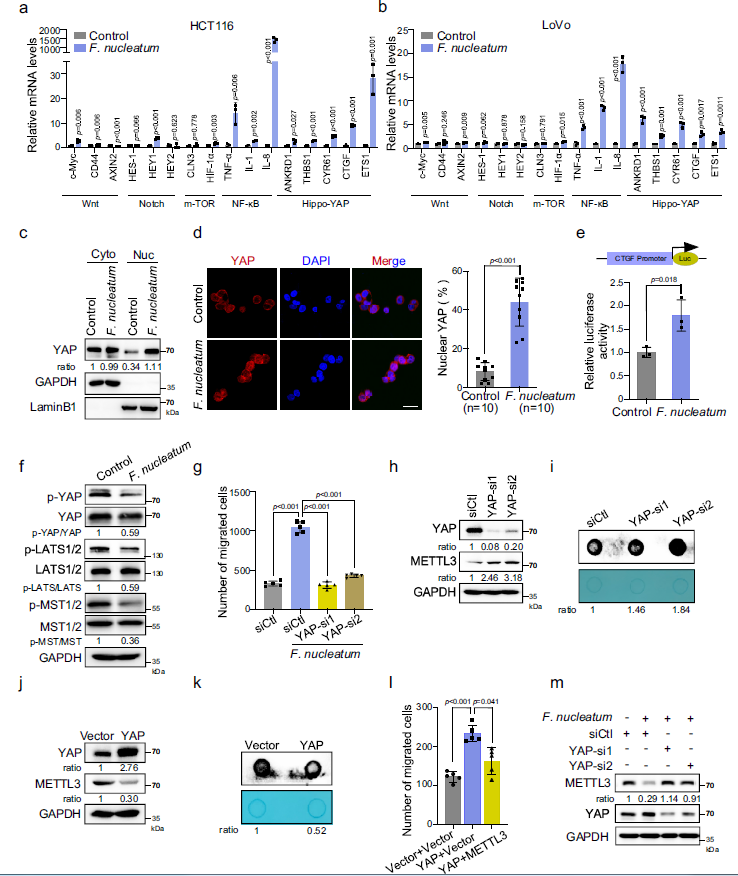
Fig2具核梭杆菌通过调节hippo-YAP信号通路抑制METTL3
3 FOXD3是METTL3的转录因子
Venn图显示在METTL3的启动子区域有很多FOXD3的结合位点(−1778 -−1957 bp),暗示FOXD3可能是METTL3的转录因子(Fig 3a)。
FOXD3的异位表达显著增加的METTL3蛋白水平(Fig 3b)。FOXD3的敲低显著的降低了METTL3蛋白的表达(Fig 3c)。此外,FOXD3过表达增加了m6A水平(Fig 3d),翘除FOXD3降低了m6A水平(Fig 3e),这表明FOXD3是METTL3的正向调节因子。为了验证FOXD3是否是METTL3的直接转录因子,采用染色质免疫沉淀(ChIP)检测,结果表明FOXD3与METTL3启动子结合(Fig 3f)。 此外,双荧光素酶报告基因实验证实FOXD3的过表达显著增强了HCT116细胞中METTL3-荧光素酶活性(Fig 3g)。提示FOXD3是METTL3的一种正转录因子。
有趣的是,ChIP实验显示具核梭杆菌处理显著降低了FOXD3与METTL3启动子区域的相互作用,这表明具核梭杆菌处理抑制了FOXD3介导的METTL3的转录(Fig 3h)。双荧光素酶报告基因检测证实,具核梭杆菌处理确实降低了FOXD3刺激METTL3的转录活性(Fig 3i)。作者进一步发现,具核梭杆菌处理显著降低了PDX组织中的FOXD3水平(Fig 3j)。具核梭杆菌处理的HCT116和LoVo细胞也得到相似的结果(Fig 3k)。接下来,作者在HCT116细胞中敲低YAP,发现FOXD3升高(Fig 3l)。Western blot检测证实,YAP的缺失增加了FOXD3的表达(Fig 3m)。总的来说,作者的工作揭示了FOXD3是METTL3的转录因子。具核梭杆菌可能通过YAP/ FOXD3轴下调METTL3的表达。
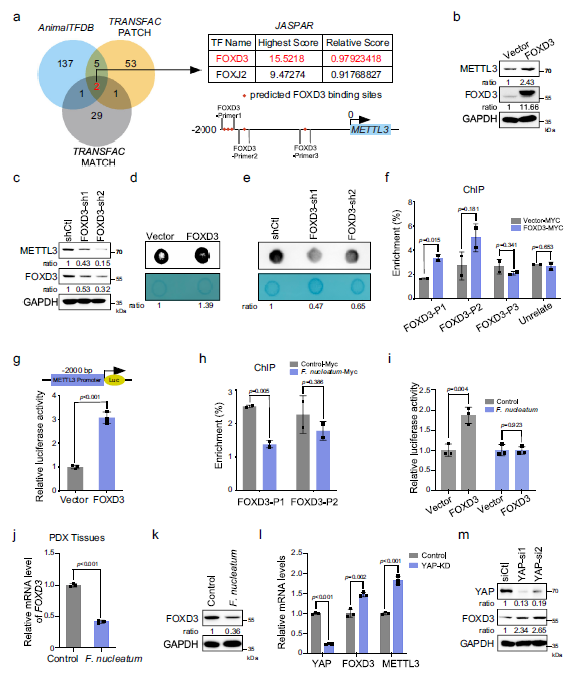
Fig 3 FOXD3是METTL3的转录因子
为了研究特定基因中m6A修饰的变化,作者在具核梭杆菌处理的HCT116细胞中进行了全转录组的m6A测序,m6A测序分析发现,与未处理的细胞相比,经具核梭杆菌处理的HCT116细胞中发生了5841个m6A峰的变化,包括2835个m6A- up峰和3006个m6A- down峰。一个特殊的WGGAM motif (W = A/T, M= A/C)在未处理组的m6A位点中高度富集,而AVWGGA (V = C/G/A, W= A/T)基序只存在于具核梭杆菌处理的细胞中(Fig 4a)。此外,作者还观察到m6A峰在起始密码子和终止密码子附近特别丰富。具核梭杆菌处理的细胞中m6A峰明显下降(Fig 4b)。基于m6A-seq结果,作者进一步分析了总的m6A mRNA分布模式。作者观察到具核梭杆菌处理后细胞中mRNA的5'UTR附近的m6A峰和CDS区减少,但3'UTR区保持了类似的丰度(Fig 4c)。
在具核梭杆菌处理的细胞中共鉴定出3589个基因,m6A水平有显著差异。其中1585个基因m6A表达上调,2004个基因m6A表达下调。基于这些差异基因,KEGG通路富集分析显示,具核梭杆菌影响CRC细胞的多个方面,包括局灶性黏着、紧密连接和Hippo信号通路。在具核梭杆菌处理的细胞中共鉴定出3589个基因,其中1585个基因m6A表达上调,2004个基因m6A表达下调。此外,基因本体论(GO)富集分析显示,在具核梭杆菌处理的CRC细胞中,少数与GTPase活性调节、细胞骨架组织和细胞极性重塑相关的基因发生了m6A修饰((Fig 4e)。
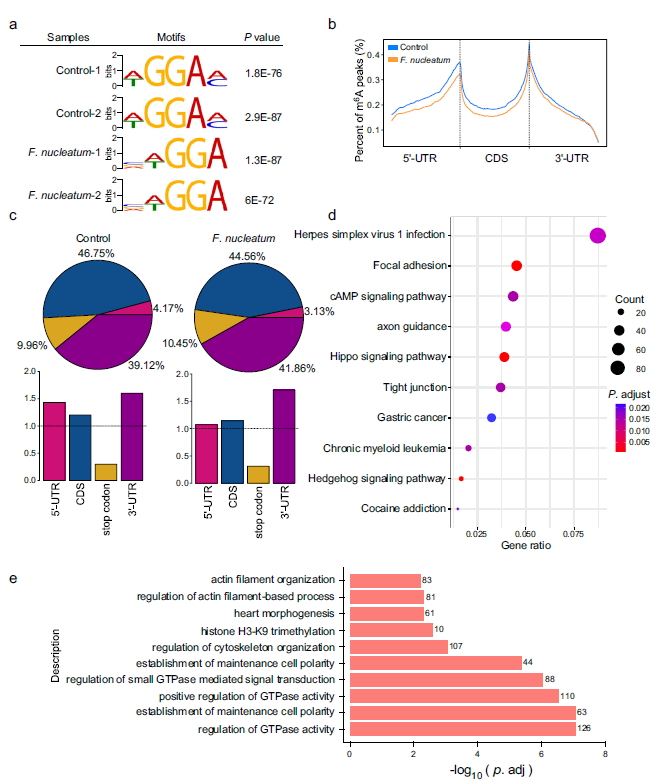
Fig4具核梭杆菌处理后,结直肠癌细胞中m6a调控基因发生变异
5 m6A-seq和RNA-seq显示KIF26B是和METTL3的下游靶点
为了确定具核梭杆菌刺激m6a调控的CRC侵袭性的潜在下游靶点,作者对具核梭杆菌处理的HCT116细胞进行了mRNA测序。表达谱分析发现155个基因上调,88个基因下调基因(Fig 5a)。作者发现在2004个m6a下调基因和155个mRNA上调基因之间有5个基因重叠(Fig 5b)。在鉴定的5个基因中,驱动蛋白家族成员26B (KIF26B)参与细胞骨架重组,氧化石墨烯分析表明,细胞骨架重组,对CRC侵袭性至关重要(Fig 4e)。m6A测序显示,具核梭杆菌处理后的kif26b mRNA中终止密码子附近的m6A峰值显著下降(Fig 5c)。m6A qpcr检测结果表明,m6A的富集经具核梭杆菌处理后,KIF26B mRNA确实减少(Fig 5d)。同时,作者的数据证实了具核梭杆菌处理的HCT116和LoVo细胞中KIF26B的mRNA和蛋白水平均显著升高(图5e, f)。因此,作者选择KIF26B作为METTL3介导的m6A修饰在CRC细胞中的候选靶点。
为了验证KIF26B mRNA是METTL3的靶点,作者进行了RNA免疫沉淀(RIP),以METTL3靶基因CREBBP为阳性对照,HPRT1为阴性对照。结果显示,KIF26B mRNA与METTL3之间存在明显的相互作用,表明KIF26B mRNA作为METTL3的直接靶点(Fig 5g)。敲除METTL3可显著增加表达KIF26B在HCT116和LoVo细胞中的表达(Fig 5h,i)。这些数据表明KIF26B的表达受YAP/FOXD3/METTL3轴的调控。此外,具核梭杆菌诱导的KIF26B的上调被野生型METTL3的异位表达所逆转,而不是其催化突变体,这表明具核梭杆菌的KIF26B的上调被野生型METTL3的异位表达所逆转,具核梭杆菌对KIF26B的上调依赖于METTL3的m6A甲基转移酶活性(Fig 5j)。
为了进一步证实m6A修饰有助于调控KIF26B的表达,作者用甲基化抑制剂DAA处理HCT116细胞。发现DAA处理诱导明显增加KIF26B mRNA和蛋白表达 (Fig 5k, l)。具核梭杆菌处理诱导KIF26B mRNA和蛋白通过METTL3介导的m6A修饰上调KIF26B表达。qRT-PCR结果显示,具核梭杆菌显著延长了HCT116和LoVo细胞中KIF26B mRNA的半衰期(Fig 5m)。以往的研究报道,YTHDF2特异性识别m6a修饰的mRNA,调节其稳定性。基于此,作者进行了RIP实验并发现YTHDF2与KIF26B mRNA结合(Fig 5n)。YTHDF2诱导KIF26B mRNA显著升高(Fig 5o)。
综上所述,这些结果表明具核梭杆菌诱导的METTL3下调降低KIF26B的m6A修饰水平,进一步减少YTHDF2依赖的mRNA降解,从而促进KIF26B在CRC细胞中的表达。
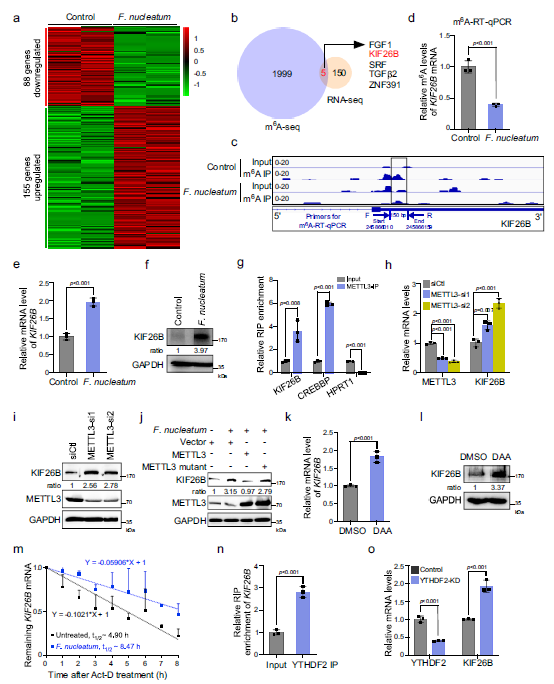
Fig 5 KIF26B是和METTL3的下游靶点
6具核梭杆菌通过上调KIF26B促进CRC侵袭和转移
最近的研究报道,KIF26B作为一种癌基因参与胃癌和乳腺癌的发病。然而,KIF26B在CRC侵袭性和转移中的潜在作用尚未被研究。作者敲除了HCT116细胞中的KIF26B,并进行了mRNA测序(Fig 6a)。转录组分析揭示KIF26B与细胞-细胞连接和对生长因子刺激的反应有关(Fig 6b), 这对CRC细胞的侵袭性很重要。Go和KEGG通路富集分析表明,Hippo信号通路在kif26b调控的基因签名中显著富集(Fig 6C)。此外, 具核梭杆菌可显促进细胞迁移,而KIF26B的下调则可明显降低具核梭杆菌诱导的细胞迁移能力(Fig 6d,e )。此外,METTL3敲低的 HCT116细胞中沉默KIF26B,发现KIF26B的缺失显著逆转了METTL3敲除引起的细胞迁移增强(Fig 6g), 提示KIF26B,至少部分地,介导了METTL3在CRC侵袭性中的功能。
在另外两种CRC细胞,RKO和SW620细胞中进一步验证KIF26B在CRC转移中的重要作用。HE染色观察到,注射CRC细胞的小鼠肝脏出现严重的转移性结节(Fig 6h)。KIF26B基因的下调显著减少了肝转移(Fig 6h,i)。与大肠杆菌处理过的对照细胞相比,注射具核梭杆菌细胞的小鼠形成了明显的肝转移结节,KIF26B基因敲低显著降低具核梭杆菌诱导的肝转移(Fig 6j,k)。
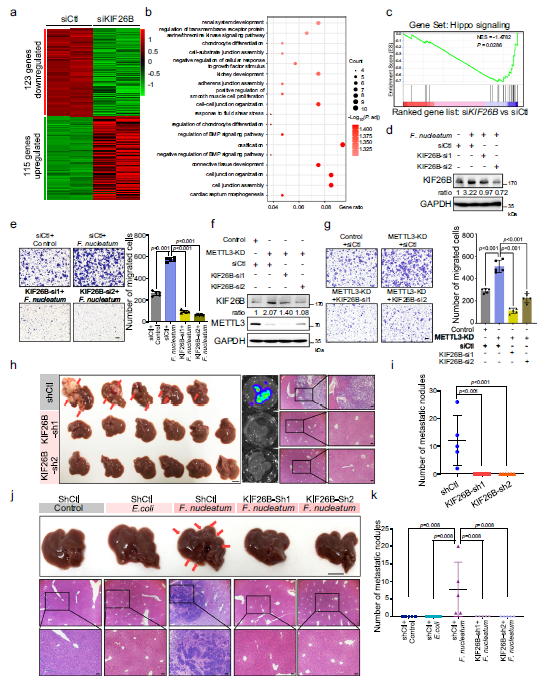
Fig6具核梭杆菌通过上调KIF26B促进CRC侵袭和转移
7具核梭杆菌与CRC患者METTL3和KIF26B的表达相关
为了在结肠直肠中建立高具核梭杆菌环境,C57BL/6小鼠在接受抗生素链霉素治疗3天后,每天进行具核梭杆菌或大肠杆菌处理(Fig 7a)。治疗15天后,作者观察到小鼠结肠直肠中有具核梭杆菌富集(Fig 7b)。值得注意的是,qRT-PCR分析显示,与大肠杆菌组相比经具核梭杆菌处理的小鼠结肠组织中METTL3 mRNA显著下降,KIF26B mRNA表达增加(Fig 7c,d)。
为探讨核仁具核梭杆菌/METTL3/KIF26B在晚期CRC患者中的临床意义,进行了CRC样本收集。作者的研究结果表明,具核梭杆菌在肿瘤组织中的丰度显著高于匹配的非肿瘤组织(Fig 7e)。有趣的是,METTL3在肿瘤组织中的表达水平被下调(Fig 7f),而KIF26B在肿瘤组织中的表达水平显著高于匹配的非肿瘤组织(Fig 7g)。在CRC肿瘤组织中,核仁芽孢杆菌(具核梭杆菌)的丰度与METTL3的含量呈负相关(Fig 7h)。在CRC肿瘤组织中,METTL3和KIF26B的表达水平呈负相关(Fig 7i)。此外,作者还分析了KIF26B表达对患者预后的影响。Cancer Genome Atlas (TCGA)数据库的Kaplan-Meier分析显示,KIF26B高表达与CRC患者较短的总生存时间显著相关(Fig 7j)。多因素Cox分析证实KIF26B高表达与CRC患者不良预后独立相关(Fig 7k)。
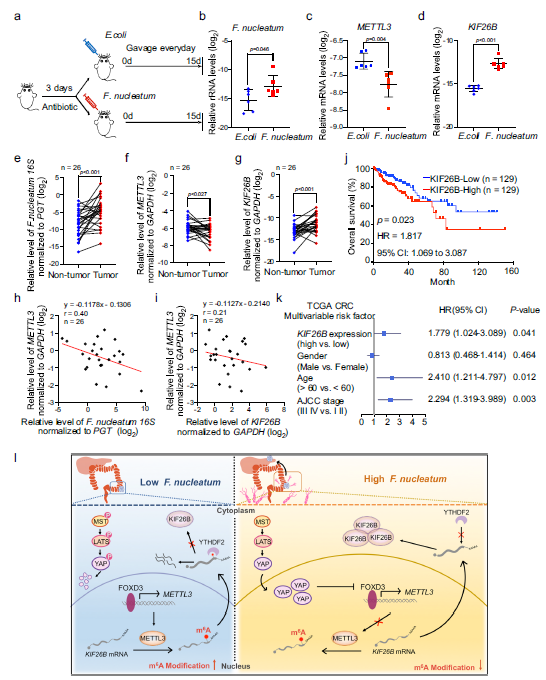
本研究为肠道菌群对人m6A转录组的影响及其在促进CRC转移中的作用提供了关键的见解。具核梭杆菌通过YAP/FOXD3/METTL3轴诱导m6A修饰的减少,导致KIF26B上调,增强CRC细胞的侵袭性。提供了一种潜在的一种潜在的靶向具核梭杆菌或KIF26B的治疗策略。
参考文献:
Chen, S., et al., Fusobacterium nucleatum reduces METTL3-mediated m(6)A modification and contributes to colorectal cancer metastasis. Nat Commun, 2022. 13(1): p. 1248.






