TIGAR通过ROS/AMPK/SCD1途径驱动结直肠癌铁死亡抗性
结直肠癌(CRC)是世界上第三常见的恶性肿瘤,也是癌症死亡的主要原因。铁死亡是最近发现的一种调节性细胞死亡。越来越多的证据表明,铁死亡在癌症的发生和发展中起着重要的调节作用。本研究确定TIGAR是CRC发展过程中抗铁死亡的潜在调节因子。我们发现TIGAR在结肠癌组织中的表达明显高于癌旁正常组织。TIGAR敲除显著增加了erastin诱导的SW620和HCT116细胞铁死亡。值得注意的是,TIGAR敲除显著降低了GSH/GSSG比率,增加了脂质过氧化的产生,促进了脂质过氧化产物丙二醛(MDA)的积累,并使CRC细胞对erastin诱导的铁死亡更加敏感。此外,TIGAR抑制以氧化还原和AMPK依赖的方式抑制SCD1的表达。因此,这些结果表明TIGAR通过ROS/AMPK/SCD1信号通路诱导结肠癌细胞的铁死亡抗性。本文于2022年3月发表于“Free Radical Biology And Medicine”(IF= 7.376)上。
技术路线

结果
1)TIGAR在结肠癌中高表达
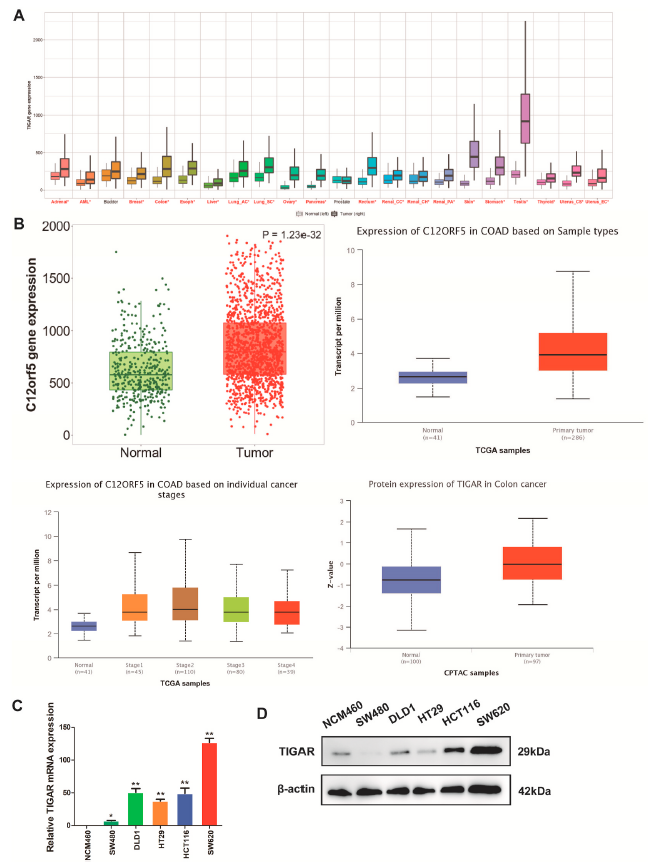
我们首先分析了TIGAR在不同细胞和非肿瘤组织中的表达模式。应用TNMplot分析TIGAR在不同肿瘤类型TCGA中的表达状态。如图1A所示,TIGAR在乳腺、结肠、肝脏、肺、胃、前列腺、皮肤、肾脏等肿瘤组织中的表达水平高于相应的邻近正常组织。接下来,从TCGA数据库中研究TIGAR在结肠癌组织中的表达。如图1B所示,未配对和配对分析均表明,与相邻正常组相比,结肠癌肿瘤组织中TIGAR mRNA表达上调,以及TCGA数据库中各个癌症阶段的TIGAR mRNA表达上调。UALCAN的CPTAC数据集的结果显示,结肠癌原发组织中TIGAR总蛋白的表达高于癌旁正常组织(图1B)。此外,我们还检测了一组结肠癌细胞中TIGAR的mRNA和蛋白。与正常结直肠细胞系NCM460相比,SW620、HCT116和DLD1细胞中TIGAR mRNA和蛋白质表达上调(图1C和D)。总之,这些数据表明TIGAR在CRC的进展中起着关键作用。
2)铁死亡与CRC的发展有关
我们研究了478例COAD患者TIGAR的生物学功能。基因集富集分析(GSEA)表明,许多与TIGAR相关的基因位于铁死亡、氧化磷酸化和脂肪酸代谢中(NES>1.8, FDR<0.05)。(图2A)。在这项研究中,我们分析了在结肠癌组织和正常邻近组织中调节铁死亡的关键基因的差异表达。结果表明,TCGA数据库中22个基因在结肠癌组织和正常癌旁组织中的表达存在显著差异。热图分析结果显示,LPCAT3、ACO1、IREB2、NCOA4和HMOX1在结肠癌细胞中下调(图2B)。而SLC3A2和GPX4在结肠癌细胞中上调(图2B)。此外,我们在TCGA数据库中使用UALCAN对铁死亡的关键基因进行分类,并分析其在CRC组织和正常相邻组织中的表达情况。结果显示,与正常邻近组织相比,CRC组织中SLC7A11、GPX4、ACSL4、TFRC和SLC11A2表达上调,而HMOX1、LPCAT3、ALOX12和SLC40A1表达下调(图2C)。所有这些都表明,很多与铁死亡相关的基因在结肠癌组织中异常表达。

为了确定erastin在结肠癌细胞活力中的作用,我们首先在五种结肠癌细胞系DLD1、HT29、HCT116、SW480和SW620中测量了erastin对细胞活力的影响。我们发现erastin以剂量相关的方式抑制细胞增殖(图3A)。为了进一步证实erastin对结肠癌细胞活力的影响,选择2μM erastin处理不同的结肠癌细胞。HT29和SW480对2μM erastin处理的erastin诱导的铁死亡高度敏感;DLD1、HCT116和SW620对经2μM erastin处理的铁死亡具有抵抗力(图3B)。由于SW620和HCT116细胞在所测试的CRC细胞系中具有最高水平的TIGAR,因此在以下实验中选择了HCT116和SW620细胞。这些数据表明TIGAR可能与HCT116和SW620细胞的铁死亡抗性有关。

4)TIGAR敲除增强erastin诱导的SW620和HCT116细胞死亡
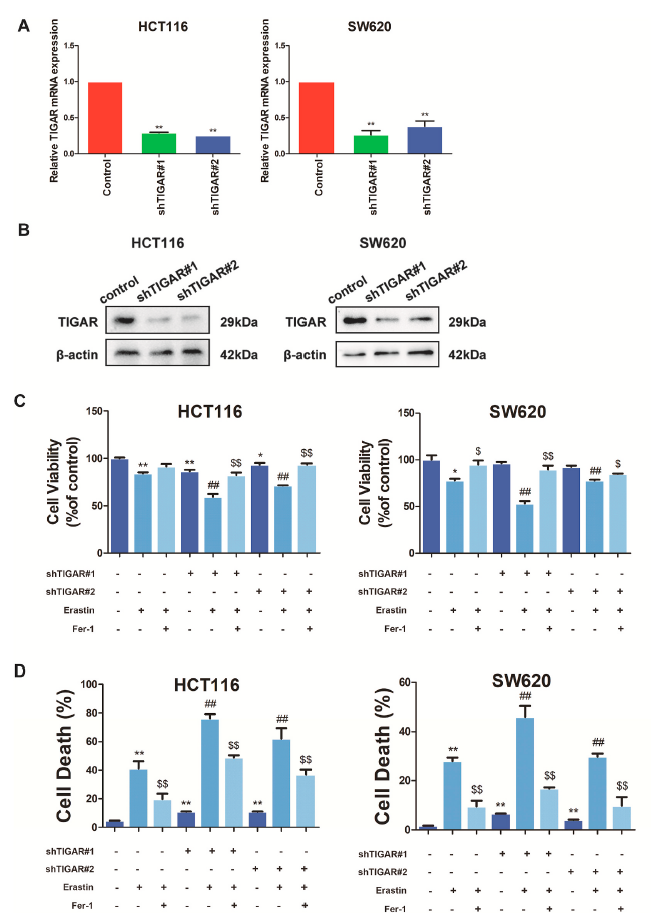
尽管TIGAR在氧化还原和代谢调节中起着重要作用,但对于TIGAR在结肠癌细胞中的抗铁死亡性知之甚少。为了探讨TIGAR对结肠癌细胞铁死亡的影响,在HCT116和SW620细胞中用shRNA#1和#2敲除TIGAR。RT-qPCR和western blot证实,在HCT116和SW620细胞中,TIGAR的mRNA(图4A)和蛋白质(图4B)表达显著下调。为了研究TIGAR在结肠癌细胞铁死亡中的作用,用MTS法和细胞死亡法对HCT116和SW620细胞的细胞活力和细胞死亡进行了评估。HCT116和SW620细胞用铁死亡诱导剂erastin和铁死亡抑制剂ferrostatin-1处理24小时。如图4C所示,TIGAR的敲除显著增加了erastin诱导的生长抑制,这种效应可通过HCT116和SW620细胞中的ferrostatin-1逆转。类似地,erastin治疗增加了TIGAR敲除的HCT116和SW620细胞的细胞死亡,ferrostatin-1治疗逆转了TIGAR敲除的HCT116和SW620细胞的细胞死亡水平(图4D)。这些结果表明,TIGAR敲除增加了HCT116和SW620细胞对铁死亡的敏感性,TIGAR是铁死亡的潜在负调节因子。
5)TIGAR敲除促进HCT116和SW620细胞的铁死亡
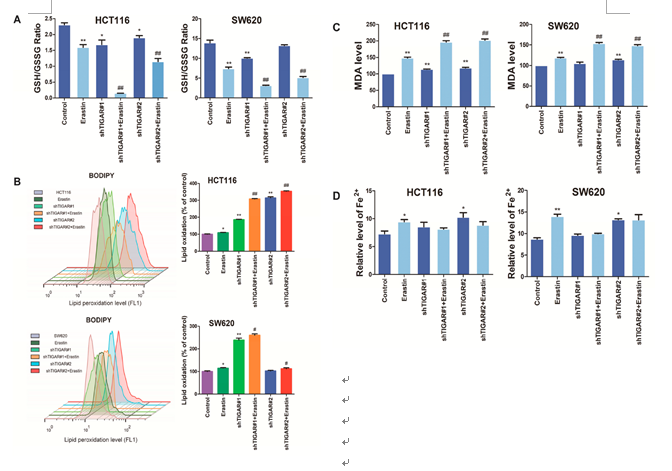
脂质过氧化和铁积累是铁死亡的两个主要生化特征。C11-BODIPY染色流式细胞术检测脂质过氧化。如图5A所示,shTIGAR#1和#2对TIGAR的敲除显著降低了经erastin处理的HCT116和SW620细胞中的GSH/GSSG比率。此外,我们还进一步研究了TIGAR敲除对脂质过氧化和脂质过氧化终产物丙二醛(MDA)的影响。结果显示,shTIGAR#1和#2对TIGAR的敲除显著增加了HCT116和SW620细胞的脂质过氧化和MDA水平(图5B和C)。有趣的是,在TIGAR敲除细胞中,铁的相对水平没有明显变化(图5D)。结果提示TIGAR敲除可诱导结肠癌细胞铁死亡。
6)TIGAR敲除以ROS/AMPK依赖的方式抑制SCD1的表达
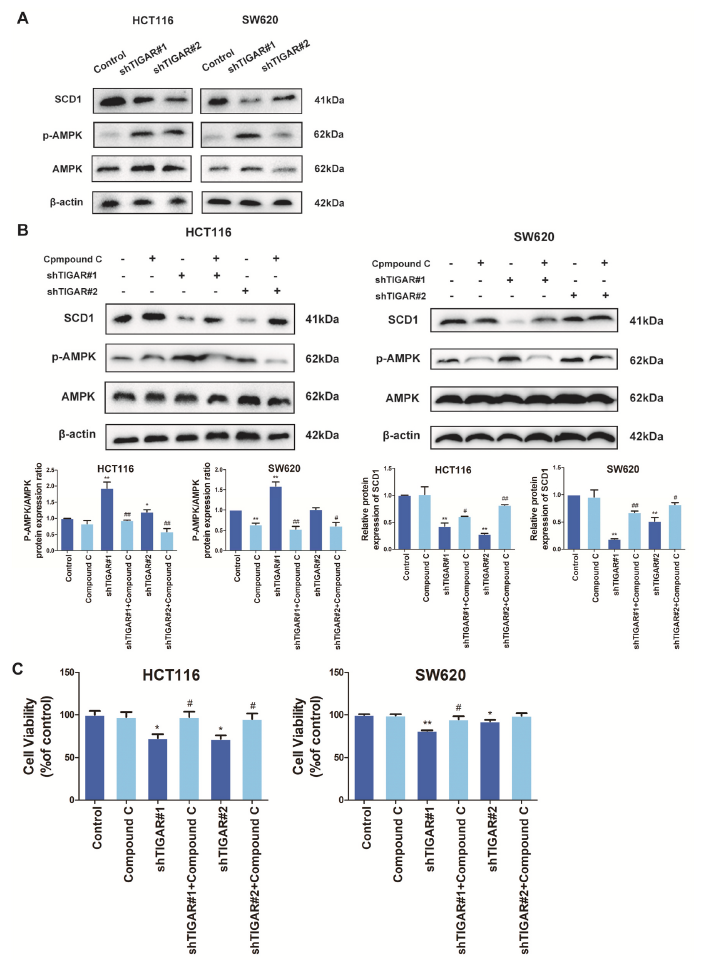
AMPK是细胞能量水平的关键传感器,协调多种代谢途径以维持能量平衡,包括脂质代谢。为了进一步确定TIGAR在脂质过氧化中的作用机制,我们研究了TIGAR对AMPK信号通路的影响。如图6A所示,在HCT116和SW620细胞中,TIGAR的敲除显著诱导AMPK的激活和SCD1表达的下调。为了了解AMPK信号通路的潜在作用,将AMPK抑制剂化合物C用于HCT116和SW620细胞。TIGAR敲除导致SCD1蛋白表达降低,而SCD1的蛋白表达随着化合物C的处理而增加(图6B)。化合物C的处理显著增加了TIGAR敲除HCT116和SW620细胞的细胞活力(图6C)。这些结果表明,敲除TIGAR可以以AMPK依赖的方式抑制SCD1的表达,从而促进铁死亡。
在以前的研究中,TIGAR显示出强大的抗氧化作用,并显著降低细胞内的ROS水平。用DCFH-DA和DHR123流式细胞术观察活性氧。在erastin治疗后,TIGAR敲除增加了ROS水平(图7A)。为了进一步证明TIGAR通过活性氧影响铁死亡,我们在HCT116和SW620细胞中添加了抗氧化剂NAC。在HCT116和SW620细胞中,TIGAR敲除导致SCD1的减少和p-AMPK蛋白表达的增加,而NAC处理使SCD1的蛋白表达增加,p-AMPK的蛋白表达降低(图7B)。NAC治疗显著降低了TIGAR敲除的HCT116和SW620细胞的细胞死亡(图7C)。这些结果表明TIGAR通过ROS/AMPK调节增强了结肠癌细胞对铁死亡的抵抗力。

结论:我们的工作揭示了TIGAR抑制结肠癌细胞铁死亡的调节机制。结肠癌细胞中TIGAR的缺失通过增加ROS产生和促进ROS/AMPK介导的SCD1下调表达促进脂质过氧化。因此,靶向TIGAR可能是一种潜在的基于铁死亡的结肠癌的治疗方法。
参考文献:
Liu MY, Li HM, Wang XY, Xia R, Li X, Ma YJ, Wang M, Zhang HS. TIGAR drives colorectal cancer ferroptosis resistance through ROS/AMPK/SCD1 pathway. Free Radic Biol Med. 2022 Mar 7;182:219-231. doi: 10.1016/j.freeradbiomed.2022.03.002.






