抑制线粒体蛋白OPA1可抑制乳腺癌的生长
线粒体融合和裂变蛋白已被提名为癌症的药物靶点。而由于三阴性乳腺癌(TNBC)几乎总是发生化疗耐药性,它们的抑制作用对TNBC是否有效尚不清楚。目前,有研究发现靶向抑制线粒体融合蛋白OPA1可抑制TNBC的生长,并将OPA1指定为TNBC中的药物靶点。该研究发表在《Journal of Experimental & Clinical Cancer Research》,IF:11.161。
技术路线:
主要研究结果:
1.乳腺癌中OPA1水平升高与预后差有关
作者首先在TNMplot数据库中比较了OPA1, MFN1和MFN2在健康组织和肿瘤组织中的表达。分析表明,在融合基因中,OPA1在AML、乳腺癌、结肠癌、食管癌、肺癌、卵巢癌、胰腺癌、直肠癌、肾癌、胃癌、睾丸和子宫癌组织中显著过度表达(图1a)。同样, OPA1 mRNA在乳腺癌中上调(图1b),不同乳腺癌亚型之间没有任何差异(图1c),而MFN1和MFN2差异不明显。另外,OPA1水平越高,乳腺癌预后越差(图1d),MFN1表达水平也与较差的预后相关,而MFN2表达水平与预后无关。这些分析表明,在乳腺癌中,当这两个线粒体融合基因水平降低时,OPA1和MFN1上调,预后更差,而MFN2水平降低,但与不同的预后无关。
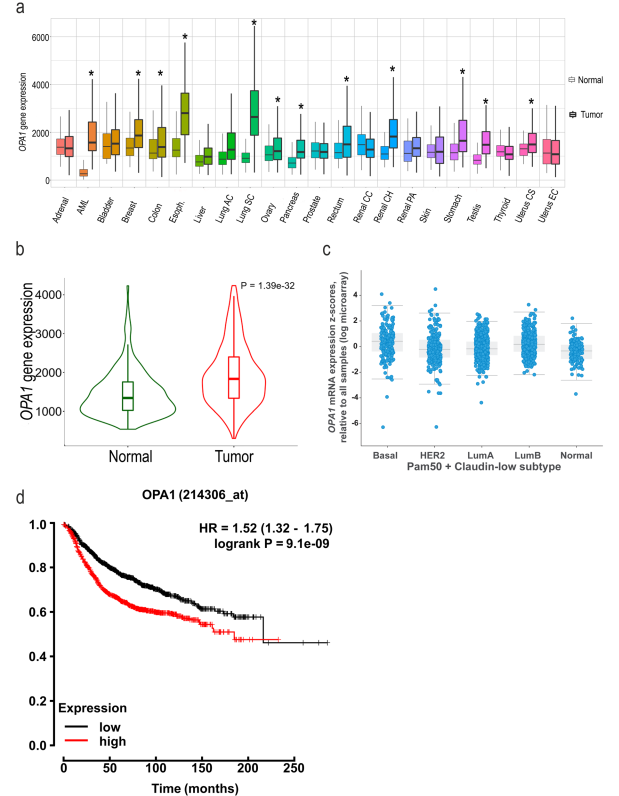
图1 OPA1在乳腺组织中过表达
2.OPA1是乳腺癌细胞多种癌症特征所必需的
鉴于MFNs的水平与较差的乳腺癌预后有明确的关联,作者选择研究OPA1在乳腺癌中的作用上。作者选OPA1两种不同的siRNA研究对MDA-MB-231影响(图2a,b),发现siRNA-OPA1减少了MDA-MB-231细胞迁移能力(图2c-f),降低了细胞增殖(图2g)、侵袭(图2h-i)和纤维连接蛋白的粘附(图2j),而不影响细胞在明胶上的粘附(图2k),且CrispR/ Cas9生成的MDA-MB-231 OPA1敲除细胞株(MDA-MB-231 OPA1 -/-)也得到了验证。在其他乳腺癌亚型中,沉默OPA1也抑制了其他乳腺癌细胞的迁移、增殖和粘附(图2l-q)。另外,无毒剂量的MYLS22(OPA1抑制剂)可以抑制乳腺癌细胞的迁移、增殖和粘附(图3a-f)。这些结果表明,基因或药理抑制OPA1可降低乳腺癌细胞的增殖、迁移和侵袭能力。
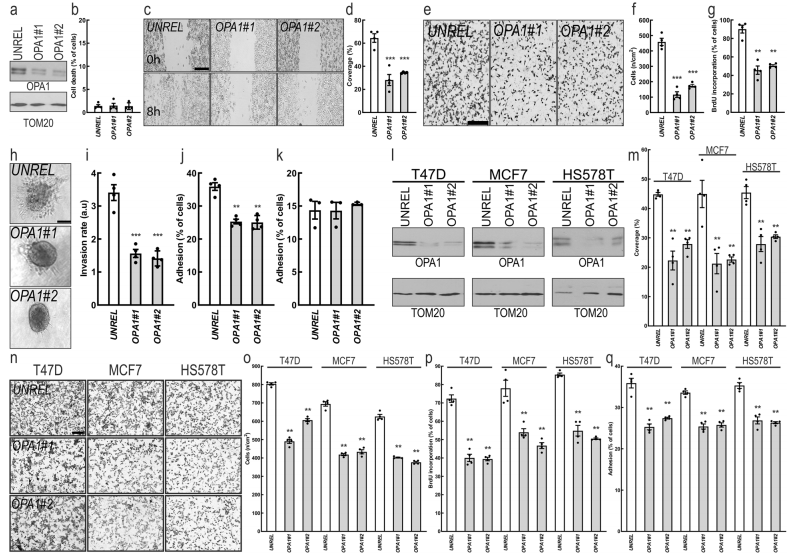
图2 OPA1是乳腺癌细胞特征所必需的
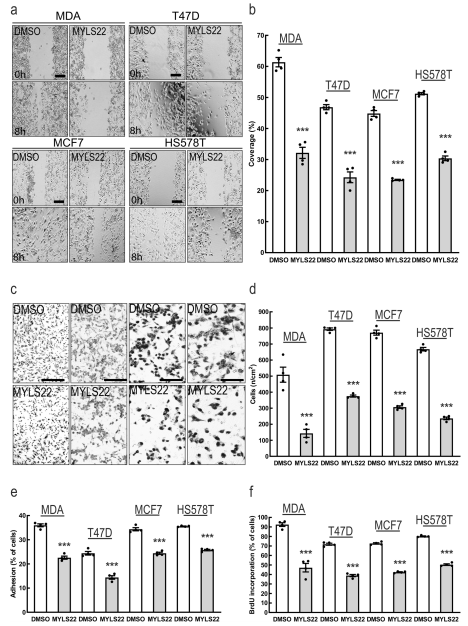
图3 体外研究表明,药理抑制OPA1可以降低乳腺癌的特征
3.OPA1消融会损害乳腺癌体内生长
下一步研究TNBC细胞在体内生长是否需要OPA1。将MDA-MB-231 OPA1 -/-和MDA-MB-231 OPA1 -/-:OPA1原位植入6周龄NOD-SCID小鼠的乳腺。结果发现,没有观察到MDA-MB-231 OPA1 -/-细胞的生长,和MDA-MB-231 OPA1 -/-:OPA1的移植和生长(图4a)。为了避免植入问题,将MDA-MB-231 OPA1 -/-和MDA-MB-231 OPA1 -/-:OPA1细胞植入母体基质细胞 (3/8 engrafted MDA-MB-231 OPA1 -/- vs. 8/8 MDA-MB-231 OPA1 -/-:OPA1),但由于37.5%的植入物附着,可以比较MDA-MB-231 OPA1 -/-与MDA-MB-231 OPA1 -/-:OPA1移植物几乎为零的肿瘤生长(图4b,c)。一段时间后,移植肿瘤并测量细胞周期蛋白D(Cyclin D),与MDA-MB-231 OPA1 -/-相比,MDA-MB-231 OPA1 -/-:OPA1中几乎没有Cyclin D (图4d)。此外,当通过乳腺癌免疫染色观察内皮标记物CD31的肿瘤血管时,发现MDA-MB-231 OPA1 -/-肿瘤中血管直径减少而血管数量没有减少(图4e-g)。这些数据表明,急性抑制OPA1可以抑制肿瘤的生长。因此,后续建立一个原则性实验来验证急性药物OPA1抑制是否可以抑制肿瘤生长。MDA-MB-231被原位植入乳腺,21天后,每隔一天通过瘤周注射10 mg/kg MYLS22进行分娩,发现足以抑制MDA-MB-231肿瘤的生长(图4h-i)。因此,靶向抑制OPA1可以有效减弱体内乳腺癌的生长。
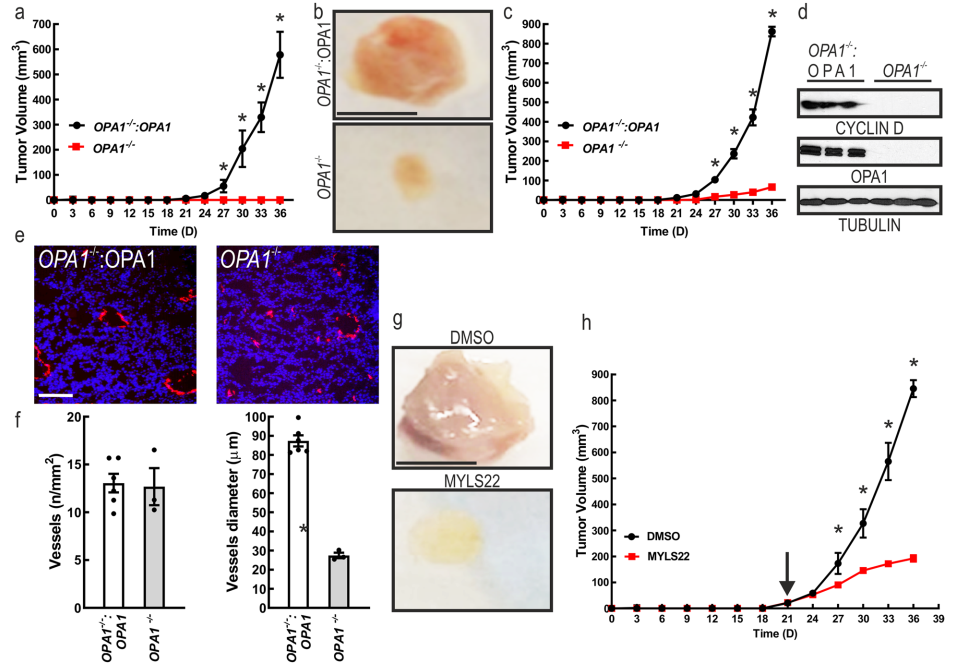
图4 基因或药理抑制OPA1抑制肿瘤生长
4.MicroRNA图谱鉴定了OPA1抑制后上调的miRNA
进一步研究OPA1调控乳腺癌的分子机制。首先发现,基因或药理抑制OPA1可诱导MDA-MB-231细胞线粒体破碎(图5a-g),但在OPA1沉默和OPA1消融的MDA-MB-231细胞中,线粒体膜电位、ATP水平和线粒体呼吸没有受到影响(图5 h-j)。有多篇文献已报道在乳腺癌中,已经发现了几种miRNAs可以调节由OPA1缺失引起的相同的生物学效应。因此,作者通过miRCURY LNA Cancer Focus PCR Panel对miRNA进行了分析,以研究OPA1缺失是否影响了miRNA的表达。最终发现对照和去除OPA1中84个miRNA中只有6个差异表达(图6a)。结合miR-148a-3p和miR-152是上调量最高的两个miRNAs,并属于同一个miRNA148/152家族:MiR-148/152家族的成熟成员长度为21-22个核苷酸,相同的种子序列为6-7个核苷酸(图6b)。qPCR证实,在所有测试的乳腺癌细胞类型中,随着OPA1下调或药理抑制,miRNAs-148a、148b和152的水平都有所增加(图6c-h)。在MDA-MB-231 OPA1+/+细胞中过表达OPA1时(MDA-MB-231 OPA1 OPA1+/+:OPA1),这些miRNA的水平进一步降低(图6i-k)。总之,这些结果表明,148/152家族的miRNAs水平与OPA1呈负相关。
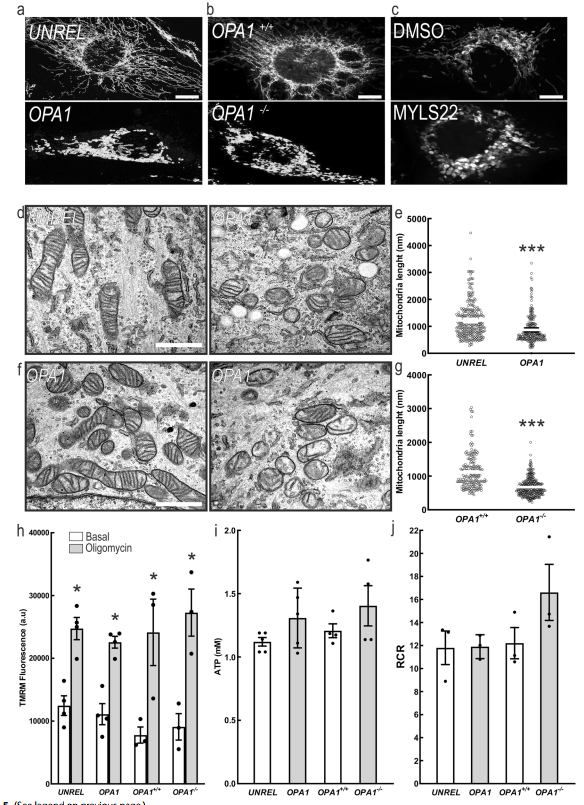
图5体外切除OPA1不影响乳腺癌细胞线粒体代谢

图6 OPA1消融提高miR-148a、miR-148b和miR-152表达水平
5.148/152家族的miRNAs介导MDA-MB-231细胞中OPA1下调的作用
为了确定miR-148a、148b和152过表达是否可以解释MDA-MB-231细胞中OPA1下调的表型,首先通过miRpaths (microT-CDS)分析了这三种miRNAs表达水平变化可能干扰的信号通路和细胞功能:miR-148a、148b和152具有调控RAS和PI3K/AKT信号通路的潜能。此外,miR-148a、148b和152还可以控制细胞外基质(ECM)与受体的相互作用、局灶性粘连和聚糖降解作用(图7a)。实验分析表明,这些miRNA的过表达降低了MDA-MB-231细胞的迁移、增殖和粘附(图7b-d),降低了CYCLIN D2和D3, INTEGRIN-β mRNA和蛋白的水平,从而降低了ERK磷酸化(图7e)。相反,沉默miR-148a、miR-148b或miR-152可以拯救沉默了OPA1的乳腺癌细胞的迁移、增殖和粘附(图7f-t)。这些结果证实了148/152家族的miRNAs在乳腺癌细胞中作为OPA1沉默的媒介的作用。

图7 OPA1消融通过增加miRNA 148a、148b和152的表达来抑制乳腺癌细胞的特征
结论:
总之,作者证明了OPA1在乳腺癌中高表达,而其水平与较差的预后相关。多种实验证实,抑制OPA1可以抑制肿瘤生长、侵袭性和新生血管的形成,抑制TNBC在体外和体内的生长。确定了OPA1在调节148/152家族miRNAs表达中的作用,这是OPA1在调节乳腺癌特征中的上位性作用。该研究将OPA1作为癌症治疗提供了一个潜在靶点。
参考文献:
Zamberlan M, Boeckx A, Muller F, Vinelli F, Ek O, Vianello C, Coart E, Shibata K, Christian A, Grespi F, Giacomello M, Struman I, Scorrano L, Herkenne S. Inhibition of the mitochondrial protein Opa1 curtails breast cancer growth. J Exp Clin Cancer Res. 2022; 41:95.






