lncRNA MIR100HG促进结直肠癌进展
上皮-间充质转化(EMT)是一个与转移和耐药性相关的过程,非编码RNA(ncRNAs)起着关键作用。我们之前的研究表明,嵌入ncRNA宿主基因MIR100HG第三内含子的miR-100和miR-125b在结直肠癌(CRC)中对西妥昔单抗产生耐药性。然而,MIR100HG转录本本身是否在西妥昔单抗耐药性或EMT中起作用尚不清楚。MIR100HG的表达与EMT标记物密切相关,并作为EMT的阳性调节因子。MIR100HG在体外和体内均能维持西妥昔单抗耐药性,促进结直肠癌细胞的侵袭和转移。hnRNPA2B1被鉴定为MIR100HG的结合蛋白。在机制上,MIR100HG通过与hnRNPA2B1相互作用,维持了TCF7L2的mRNA稳定性,TCF7L2是Wnt/β-catenin的主要转录辅激活因子。hnRNPA2B1在MIR100HG存在下识别TCF7L2 mRNA的m6A位点。TCF7L2反过来激活MIR100HG转录,形成前馈调节回路。MIR100HG/hnRNPA2B1/TCF7L2轴在出现局部或远处转移或与西妥昔单抗耐药相关的疾病进展的CRC患者中得到增强。我们的研究发现,MIR100HG是结肠癌中一种有效的EMT诱导剂,通过激活MIR100HG/hnRNPA2B1/TCF7L2反馈回路,可能有助于西妥昔单抗耐药性和转移。本文于2021年3月发表于Molecular Cancer(IF=27.401)上。
技术路线

结果
1)MIR100HG与结肠癌EMT密切相关,并参与其调节
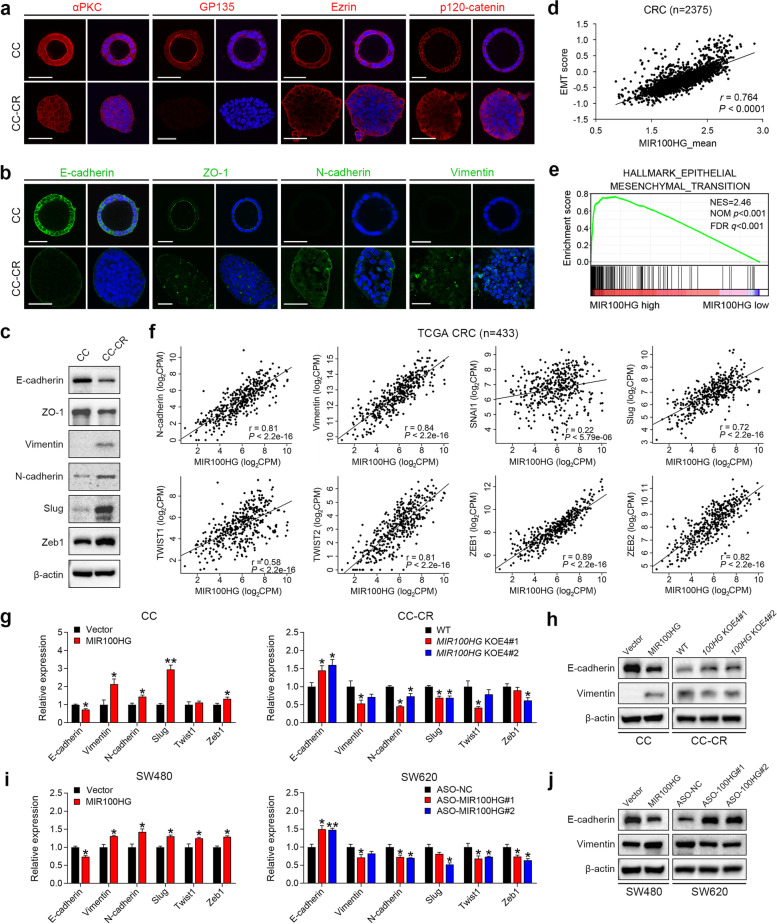
我们之前描述了从人类HCA-7细胞中产生西妥昔单抗敏感CC细胞和西妥昔单抗耐药CC-CR细胞。使用1型胶原在3D培养中培养的CC细胞产生中空的全极化结构。相比之下,大多数CC-CR细胞表现出坚实、无组织的结构,失去了顶-基底极性(图1a)。细胞极性的丧失被认为是癌症进展的标志,上皮细胞经历间质转化是一个重要步骤。与CC细胞相比,CC-CR细胞显示E-钙粘蛋白介导的粘附连接缺失,紧密连接蛋白ZO-1减少,间充质标记物N-钙粘蛋白和波形蛋白表达增加(图1b、c)。包括Snail、Twist和ZEB家族成员在内的EMT诱导转录因子(EMT-TFs)在CC-CR细胞中的表达也升高(图1c)。这些特征表明EMT发生在3D培养的CC-CR细胞中。
由于与CC相比,MIR100HG是CC-CR中过表达最多的转录本,因此我们研究了MIR100HG是否参与了EMT。我们首先在一个大的人类CRC数据集中分析了MIR100HG和EMT基因表达特征列表之间的相关性,发现MIR100HG和EMT高度相关(图1d)。通过使用分子特征数据库中的EMT-hallmark基因集,我们通过GSEA证明EMT基因表达模式在高水平MIR100HG的结肠癌样本中显著富集(图1e)。此外,对TCGA CRC数据库的分析显示,MIR100HG与间充质基因或EMT-TF的表达之间存在很强的正相关(图1f)。此外,MIR100HG过表达的CC细胞显示E-钙粘蛋白表达减少,间充质基因和EMT-TFs表达增加;相比之下,在MIR100HGKOE4细胞中观察到这些基因的表达增加(图1g和h)。在通过反义寡核苷酸(ASOs)转染MIR100HG过表达或敲除后,SW480(低内源性MIR100HG表达)和SW620(中度内源性MIR100HG表达)细胞中观察到类似的结果(图1i、j)。总之,这些结果表明MIR100HG在结肠癌中诱导EMT。
2)MIR100HG对维持西妥昔单抗耐药性和促进结直肠癌细胞转移很重要
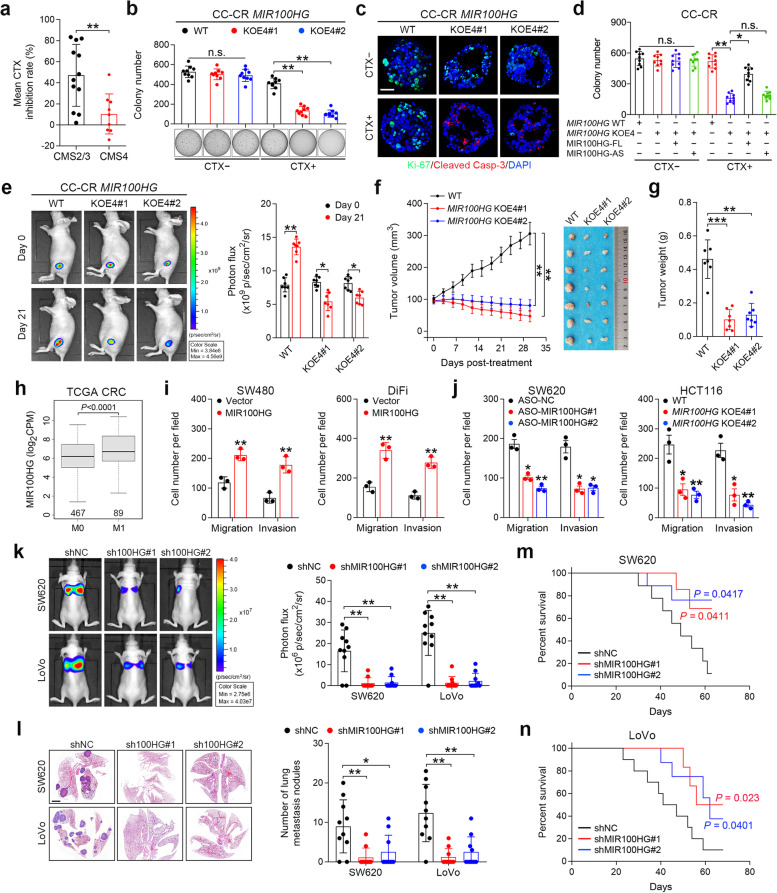
我们研究了MIR100HG是否参与了结肠癌的耐药性和转移,以及与EMT密切相关的表型。我们首先分析了29个结直肠癌细胞系中西妥昔单抗的反应性,这些细胞系由基于基因表达的共识分子分型(CMS)分层。我们发现CMS2和CMS3分类中的细胞对西妥昔单抗治疗有反应,而CMS4间充质组中的细胞表现出西妥昔单抗耐药性(图2a),支持EMT在结肠癌中赋予西妥昔单抗耐药性。在3D培养中,MIR100HGKOE4 CC-CR细胞的菌落数与WT细胞相当;然而,在西妥昔单抗存在的情况下,与WT相比,MIR100HGKOE4细胞的菌落数量显著减少(图2b)。西妥昔单抗治疗后,在MIR100HGKOE4 CC-CR细胞中观察到Ki-67减少和cleaved caspase-3染色增加(图2c)。恢复全长MIR100HG转录本(MIR100HG-FL)在很大程度上消除了MIR100HGKOE4 CC-CR细胞对西妥昔单抗的反应性(图2d)。为了确定这些发现是否可以在体内重现,我们用表达荧光素酶的慢病毒载体转导的MIR100HGKOE4 CC-CR细胞在裸鼠皮下建立异种移植物,然后用西妥昔单抗治疗小鼠(图2e)。与对照组相比,西妥昔单抗治疗后MIR100HGKOE4组的体内生物发光以及肿瘤体积和重量显著降低(图2f和g)。这些结果表明,MIR100HG对维持结直肠癌细胞对西妥昔单抗的耐药性很重要,降低MIR100HG水平可以恢复药物敏感性。
接下来我们确定MIR100HG是否与结肠癌转移有关。对TCGA数据库的分析显示,有转移的结直肠癌患者的MIR100HG表达显著高于无转移的患者(图2h)。MIR100HG在SW480细胞和DIF细胞中的上调显著增加迁移和侵袭(图2i)。相比之下,SW620细胞和HCT116细胞中MIR100HG的敲除阻碍了它们的迁移和侵袭能力(图2j)。此外,我们通过将MIR100HG沉默的SW620或LoVo细胞注射到裸鼠的尾静脉中来进行体内转移试验。与对照组相比,注射MIR100HG沉默细胞的小鼠表现出转移减少,整体生物发光信号和肺转移的数量表明了这一点,并提高了存活率(图2k-n)。这些结果表明MIR100HG促进了肿瘤的侵袭,增强了结直肠癌细胞的转移能力。
3)hnRNPA2B1是MIR100HG的直接功能性结合伙伴
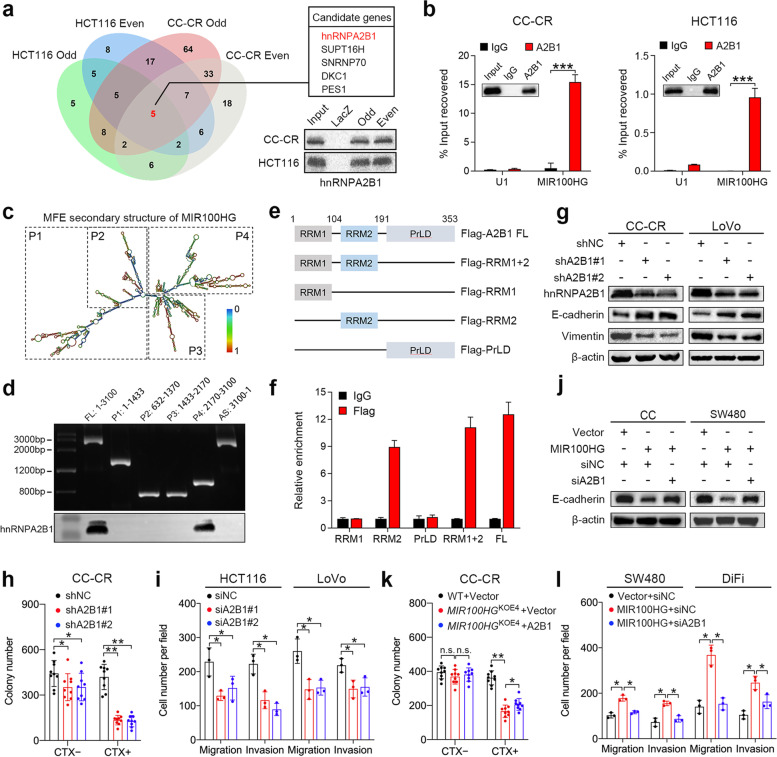
lncRNAs发挥作用的方式之一是直接与RNA结合蛋白相互作用。由于MIR100HG主要位于细胞核内,我们通过ChIRP结合质谱分析,以确定CRC细胞中MIR100HG的核定位相互作用伙伴。我们从CC-CR和HCT116细胞中分别分离出173和76个纯化蛋白(图3a)。其中,五个候选基因hnRNPA2B1、SUPT16H、SNRNP70、DKC1和PES1在所有组中均富集(图3a)。hnRNPA2B1被选为进一步研究的对象,因为据报道它是各种癌症类型中的EMT调节因子。在CC-CR和HCT116细胞中证实了MIR100HG探针富集hnRNPA2B1(图3a),并通过RIP分析进一步验证,与对照IgG相比,使用抗hnRNPA2B1的抗体,MIR100HG在下拉中显著富集(图3b)。为了确定与hnRNPA2B1结合的MIR100HG的特定区域,根据RNA fold web服务器(图3c)预测的MIR100HG二级结构生成了一系列MIR100HG片段,然后将这些构建体用于生物素标记的RNA下拉分析。结果表明,hnRNPA2B1主要与从核苷酸2170到3100转录的MIR100HG片段结合(图3d)。此外,使用带有Flag标签的全长或截短hnRNPA2B1抗体进行RIP分析,以阐明hnRNPA2B1介导与MIR100HG相互作用的特定结构域(图3e)。结果显示hnRNPA2B1的RNA识别基序2(RRM2)结构域主要负责与MIR100HG的相互作用(图3f)。然后我们研究了hnRNPA2B1在结肠癌进展中的作用。hnRNPA2B1的沉默增加了CC-CR和LoVo细胞中E-钙粘蛋白的表达,降低了波形蛋白的表达,这与MIR100HG对EMT的影响一致(图3g)。在3D培养中,敲除CC-CR细胞中的hnRNPA2B1可减少总菌落数,而西妥昔单抗治疗的减少更为明显,这表明hnRNPA2B1可促进西妥昔单抗耐药性(图3h)。同时,hnRNPA2B1的敲除显著阻碍了细胞迁移和侵袭(图3i)。接下来,我们试图阐明hnRNPA2B1在MIR100HG介导的西妥昔单抗耐药性和转移中的作用。沉默hnRNPA2B1可逆转CC和SW480细胞中MIR100HG过表达介导的E-cadherin减少(图3j)。在西妥昔单抗存在的情况下,MIR100HGKOE4 CC-CR细胞的集落数减少,这部分被hnRNPA2B1过表达所抵消(图3k)。敲除hnRNPA2B1也消除了MIR100HG过表达细胞的迁移和侵袭能力增强(图3l)。总的来说,这些结果表明MIR100HG通过与hnRNPA2B1的相互作用促进CRC进展。
4)MIR100HG和hnRNPA2B1调节TCF7L2 mRNA的稳定性并激活Wnt信号
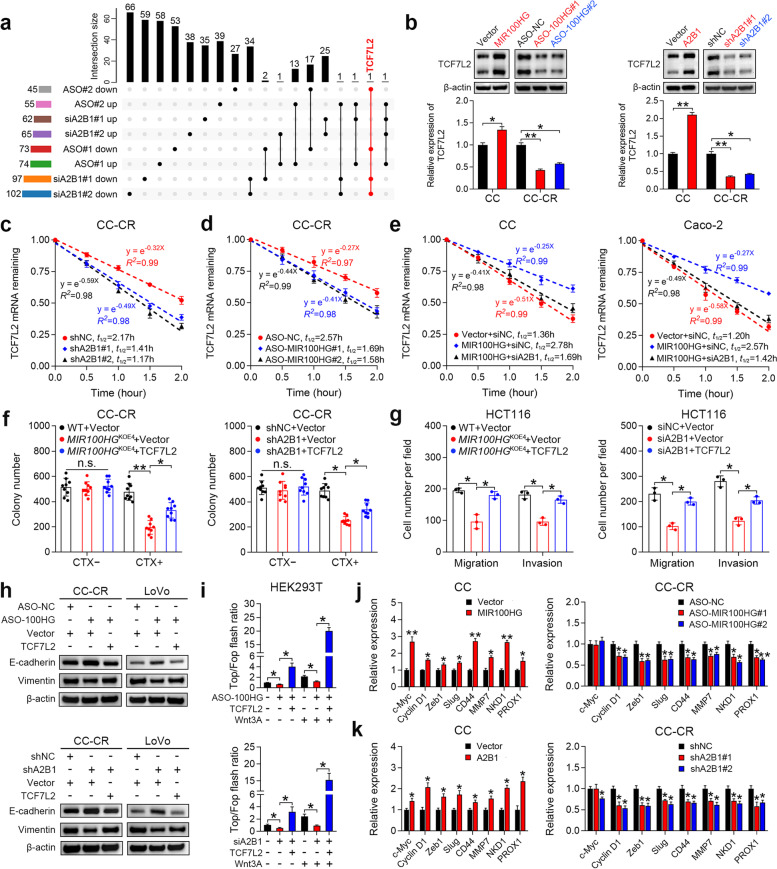
我们推测某些mRNAs可能受到MIR100HG和hnRNPA2B1之间相互作用的影响。为了分析受MIR100HG和hnRNPA2B1调节的候选mRNA,我们沉默了MIR100HG或hnRNPA2B1,并进行了RNA测序。值得注意的是,TCF7L2被确定为所有MIR100HG-和hnRNPA2B1沉默组中唯一一个显著下调的基因(图4a)。因为我们之前的研究表明MIR100HG和Wnt信号之间存在正相关,我们决定集中精力研究TCF7L2,因为它是Wnt信号的关键转录辅激活因子,与耐药性、转移和EMT密切相关。如图4b所示,敲除MIR100HG或hnRNPA2B1可降低CC-CR和HCT116细胞中TCF7L2 mRNA和蛋白质的表达,而MIR100HG或hnRNPA2B1的过表达增加了CC和SW480细胞中TCF7L2 mRNA和蛋白质水平。hnRNPs是已知的RNA稳定性调节因子。为了测试HRNPA2B1是否会影响TCF7L2 mRNA的稳定性,我们用放线菌素D处理细胞,并检测TCF7L2 mRNA水平。在CC-CR和HCT116细胞(图4c)中证实了hnRNPA2B1敲除后TCF7L2 mRNA的加速衰变,表明hnRNPA2B1起到稳定TCF7L2 mRNA的作用。MIR100HG的敲除也增强了TCF7L2 mRNA的降解(图4d)。MIR100HG的过表达延长了CC和Caco-2细胞中TCF7L2 mRNA的半衰期,但hnRNPA2B1的沉默消除了MIR100HG的稳定作用(图4e)。这些结果表明HRNPA2B1和MIR100HG通过增强mRNA稳定性协同上调TCF7L2的表达。接下来我们确定TCF7L2是否参与MIR100HG或hnRNPA2B1介导的CRC进展。TCF7L2在MIR100HG或hnRNPA2B1缺失的CRC细胞中的过表达挽救了西妥昔单抗耐药性、细胞迁移和侵袭(图4f、g)。恢复TCF7L2诱导的EMT,其被MIR100HG或hnRNPA2B1下调抑制(图4h)。接下来,我们研究了MIR100HG/hnRNPA2B1/TCF7L2轴的功能是否通过激活Wnt信号来介导。在MIR100HG或hnRNPA2B1敲除后,TOP/FOP flash活性受到显著抑制,而TCF7L2过表达可缓解这种抑制,尤其是在给予标准Wnt配体Wnt3A后(图4i)。此外,与细胞生长(c-Myc和Cyclin D1)和EMT(ZEB1和Slug)相关的Wnt靶基因子集在MIR100HG-和hnRNPA2B1过表达的CC细胞中显著上调(图4j,k)。相反,MIR100HG和hnRNPA2B1的敲除导致CC-CR细胞中这些Wnt靶基因的减少(图4j,k)。总之,这些结果表明MIR100HG通过与hnRNPA2B1相互作用增强TCF7L2 mRNA的稳定性,并随后激活Wnt信号通路。
5)hnRNPA2B1和MIR100HG对TCF7L2 mRNA的稳定作用依赖于m6A
由于hnRNPA2B1是m6A依赖性核RNA处理事件的介质,我们推测hnRNPA2B1可能以m6A依赖性的方式调节TCF7L2 mRNA的稳定性。我们发现CC-CR和HCT116细胞中m6A甲基转移酶METTL3的沉默降低了TCF7L2 mRNA水平(图5a)。MeRIP检测进一步证实,METTL3沉默降低了TCF7L2 mRNA的m6A修饰水平(图5b)。使用SRAMP在线工具确定了TCF7L2 mRNA中五个预测的m6A位点,然后通过MeRIP分析进行验证(图5c)。用m6A抗体下拉后,TCF7L2 mRNA的最大富集是终止密码子附近3’UTR中的+2133位点(图5c)。接下来,我们确定hnRNPA2B1和TCF7L2之间的相互作用是否取决于m6A修饰。RIP检测表明,在CC-CR和HCT116细胞中,hnRNPA2B1抗体可富集TCF7L2 mRNA(图5d),表明hnRNPA2B1和TCF7L2 mRNA之间存在相互作用。METTL3的敲除降低了这种富集(图5e),表明TCF7L2 mRNA上的m6A修饰对于其与hnRNPA2B1的相互作用是必要的。值得注意的是,在MIR100HGKOE4 CC-CR和HCT116细胞中,HRNPA2B1沉淀的TCF7L2 mRNA显著减少(图5f),这意味着HRNPA2B1和TCF7L2之间的相互作用也依赖于MIR100HG。此外,我们进行了体内RNA沉淀分析,以验证hnRNPA2B1和TCF7L2之间的相互作用是否依赖于m6A。在这种情况下,含有WT或突变+2133 m6A修饰位点的TCF7L2片段被S1m标记(图5g),S1m是一种修饰的链霉亲和素结合适体,其作用类似于生物素,但具有更高的亲和力。利用将S1m标记的TCF7L2构建物转染CC和HCT8细胞的系统,可以在体内进行m6A修饰。基于链霉亲和素适体的捕获显示TCF7L2的m6A位点突变消除了与hnRNPA2B1的关联(图5g)。这表明TCF7L2 mRNA的m6A修饰对于其与hnRNPA2B1的关联至关重要。此外,我们构建了携带WT或突变体TCF7L2序列的荧光素酶报告基因。异位hnRNPA2B1诱导WT报告基因的荧光素酶活性显著增加,但这种增加被HCT8和HEK293T细胞m6A位点突变削弱(图5h和i)。hnRNPA2B1介导的荧光素酶活性的增加被METTL3或MIR100HG敲除所阻断(图5j和k)。总的来说,这些数据表明TCF7L2 mRNA的m6A修饰是其与hnRNPA2B1结合所必需的,MIR100HG是相互作用不可或缺的伙伴。
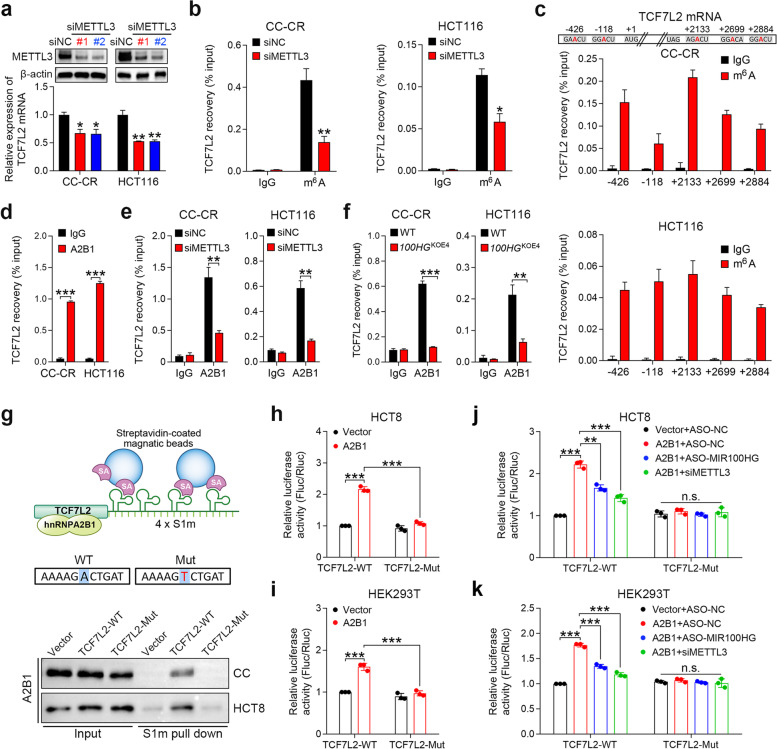
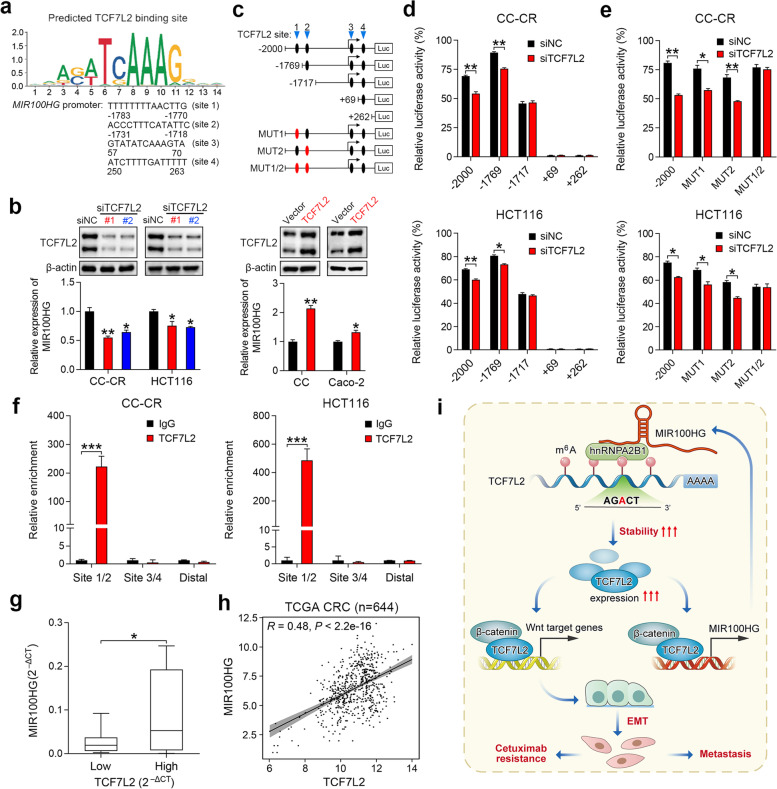
6)TCF7L2激活MIR100HG转录并形成一个互惠的正反馈回路
为了进一步探索MIR100HG在CC-CR细胞中上调的机制,我们使用JASPAR数据库分析了MIR100HG 2-kb启动子区域中预测的TF结合基序。值得注意的是,在MIR100HG启动子中发现了四个TCF7L2结合位点(图6a)。与此一致,CC-CR和HCT116细胞中TCF7L2的沉默导致MIR100HG表达减少(图6b),表明TCF7L2可能是MIR100HG的转录调节器。TCF7L2的过表达增强了CC和Caco-2细胞中MIR100HG的表达(图6b)。为了确定TCF7L2是否激活MIR100HG转录,将含有MIR100HG启动子中TCF7L2结合位点的荧光素酶报告构建体转导到CC-CR和HCT116细胞中(图6c)。MIR100HG启动子的序列缺失分析和定点突变表明,TCF7L2结合位点1和2是TCF7L2介导的转录激活的主要位点(图6d和e)。染色质免疫沉淀(ChIP)分析证实TCF7L2蛋白在TCF7L2结合位点1和2直接结合到MIR100HG启动子(图6f)。此外,在一组CRC细胞系以及TCGA数据库中观察到TCF7L2和MIR100HG表达之间存在正相关(图6g和h)。总的来说,这些结果表明MIR100HG和TCF7L2之间存在相互调节机制,其中MIR100HG和hnRNPA2B1稳定TCF7L2 mRNA,而TCF7L2通过转录激活提高MIR100HG丰度(图6i)。
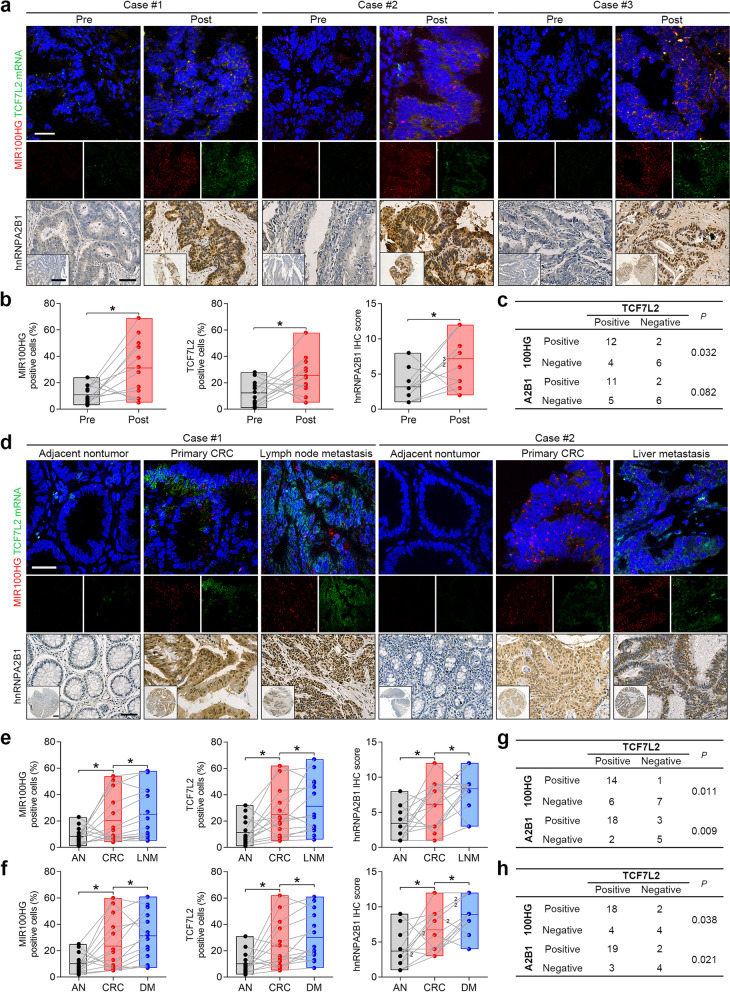
7)结肠癌标本中MIR100HG、hnRNPA2B1和TCF7L2表达的验证
为了检测MIR100HG/hnRNPA2B1/TCF7L2轴是否在结肠癌患者的西妥昔单抗耐药性中起作用,我们在西妥昔单抗治疗开始前和肿瘤进展时从12名个体中获得了成对的肿瘤标本。使用显色RNAscope原位杂交,我们发现,与治疗前相比,西妥昔单抗治疗进展的肿瘤中,MIR100HG和TCF7L2显著过表达(图7a和b)。在使用西妥昔单抗进展的肿瘤的连续切片中也观察到hnRNPA2B1免疫反应性增加(图7a和b)。观察到MIR100HG或hnRNPA2B1与TCF7L2表达之间存在正相关(图7c)。这些结果表明,在结肠癌患者中,西妥昔单抗耐药时,MIR100HG、hnRNPA2B1和TCF7L2的表达上调。接下来,我们分析了14对原发性结直肠癌组织、邻近非肿瘤组织及其匹配的淋巴结或远处转移样本中MIR100HG、hnRNPA2B1和TCF7L2的表达。与原发性病变相比,淋巴结和远处转移的MIR100HG、hnRNPA2B1和TCF7L2的表达显著增加(图7d-f)。在原发性结直肠癌组织和转移性病变中,MIR100HG或hnRNPA2B1与TCF7L2表达之间也存在正相关性(图7g和h)。这些结果提示MIR100HG、hnRNPA2B1和TCF7L2在这些CRC患者的转移灶中较原发灶表达增加。
结论:我们的研究结果揭示了一个以前未知的作用—MIR100HG通过形成涉及hnRNPA2B1和TCF7L2的调控回路,调控CRC中EMT相关的西妥昔单抗耐药和转移。
参考文献:
Liu H, Li D, Sun L, Qin H, Fan A, Meng L, Graves-Deal R, Glass SE, Franklin JL, Liu Q, Wang J, Yeatman TJ, Guo H, Zong H, Jin S, Chen Z, Deng T, Fang Y, Li C, Karijolich J, Patton JG, Wang X, Nie Y, Fan D, Coffey RJ, Zhao X, Lu Y. Interaction of lncRNA MIR100HG with hnRNPA2B1 facilitates m6A-dependent stabilization of TCF7L2 mRNA and colorectal cancer progression. Mol Cancer. 2022 Mar 12;21(1):74. doi: 10.1186/s12943-022-01555-3.






