microRNA-142通过控制Treg细胞稳态和功能来对抗自身免疫
调节性T (Treg)细胞在预防异常的免疫反应中起关键作用,microRNA (miRNA)对基因表达的转录后控制已成为Treg细胞功能的重要遗传因素。目前,有研究发现miR-142作为Treg细胞稳态不可或缺的调节因子,通过减弱IFNγ反应发挥其功能。该研究于2022年2月发表在《PLoS biology》,IF:8.029。
技术路线:

主要研究结果:
1. Treg细胞特异性miR-142缺失小鼠的致死性自身免疫疾病
作者前期发现miR-142在T细胞中动态表达,其整体消融导致Treg细胞特异性缺陷。为了确定miR-142在Treg细胞功能中的作用,构建Treg细胞特异性消融miR-142的小鼠(Foxp3CremiR-142fl/fl小鼠)。Foxp3CremiR-142fl/fl小鼠表现出明显的发育障碍:寿命短(图1A),体型较小(图1B),体重显著低于野生型(WT;Foxp3Cre)同窝小鼠(图1C)。形态学分析显示,Foxp3CremiR-142fl/fl小鼠出现了系统性淋巴增生性自身免疫性疾病,其特征为显著的淋巴结病(图1D),轻度脾肿大(图1D),皮炎(图1B),以及大量免疫细胞浸润到周围器官(图1E)。综上所述,Foxp3CremiR-142fl/fl小鼠的表型结果与严重Treg细胞缺陷小鼠的自身免疫病理相似,提示miR-142参与调节Treg细胞稳态或稳定性。
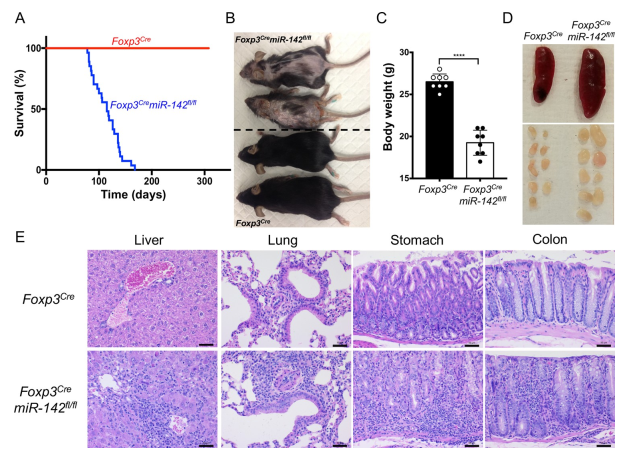
图1 Treg细胞特异性破坏miR-142小鼠的致命自身免疫性疾病
2. Foxp3CremiR-142fl/fl小鼠的Treg细胞缺损和T细胞异常激活
Foxp3CremiR-142fl/fl脾脏中Treg细胞数量显著减少(图2A)。用流式细胞仪检测了Foxp3CremiR-142fl/fl小鼠外周血T细胞的激活状态:与WT老鼠相比,CD4 +和CD8 + T细胞的数量与内存/效应表型(CD44hiCD62Llo)明显高于在脾脏和淋巴结Foxp3CremiR-142fl/fl的老鼠,而在KO动物中,原始的(CD44loCD62Lhi) CD4 +和CD8 + T细胞大大减少(图2 B和2C)。此外,从Foxp3CremiR-142fl/fl小鼠中分离的CD4+和CD8+ T细胞都显示出IFNγ的产生急剧增加(图2D和2E)。因此,条件下敲除miR-142会损害Treg细胞的功能,进而导致Teff反应的严重失调。
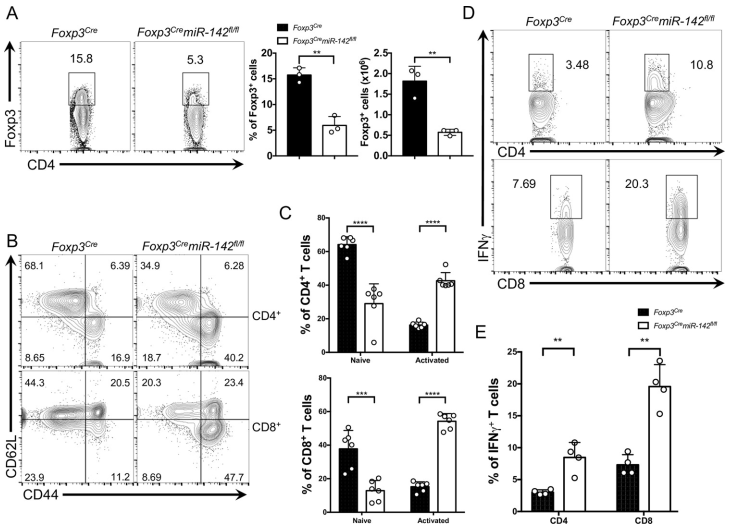
图2 miR-142是维持Treg细胞介导的免疫耐受所必需的
3. miR-142对于Treg细胞的稳态和抑制活性至关重要
将纯化的缺失miR-142和充足miR-142的Treg细胞与经抗原受体刺激诱导增殖的WT Tconv细胞共培养。发现与miR-142充足的Treg细胞相比,miR-142不足的Treg细胞表现出抑制活化Tconv细胞增殖的能力(图3A)。另外,用来自C57BL/6的同种异体CD4+ Tconv细胞(H2b)移植的BALB/c小鼠(H2d)受到致命照射后,迅速发生亚致死aGVHD,表现为宿主小鼠驼背、严重腹泻和体重减轻(图3B和3C)。WT Treg细胞与异体供体T细胞同时移植可减轻宿主小鼠的腹泻和体重减轻(图3C),从而减轻aGVHD症状的严重程度。相比之下,miR-142缺失的Treg细胞未能保护宿主小鼠免受aGVHD的发展,并可能通过加剧炎症反应导致死亡(图3B和3C),这表明miR-142在调节体内Treg细胞抑制活性中起着重要作用。此外,移植后17天,宿主小鼠脾脏中供体miR-142缺陷型Treg细胞的频率显著降低(图3D),表明miR-142缺陷型Treg细胞的存活或体内平衡缺陷。
为了测试miR-142消融是否影响Treg细胞的存活,比较miR-142充分和miR-142缺乏的Treg细胞对TCR刺激的诱导凋亡。发现纯化的脾miR-142 KO Treg细胞更容易激活诱导细胞死亡(图3E)。此外,镶嵌小鼠脾脏YFP+miR-142缺陷型Treg细胞的频率显著降低(图3F),表明miR-142在Treg细胞内环境稳定中发挥细胞自主作用。此外,BrdU体内标记实验显示,miR-142缺失的Treg细胞的增殖能力几乎比WT Treg细胞低2倍(图3G)。miR-142缺失的Treg细胞表现出几种t细胞激活标志物的上调 (图3H)。并且在miR-142缺失的Treg细胞中,保护Treg细胞免受凋亡的程序性死亡-1 (PD-1)受体的水平显著降低(图3H)。总的来说,这些发现表明miR-142在调节Treg细胞的稳态维持和增殖中起重要作用。
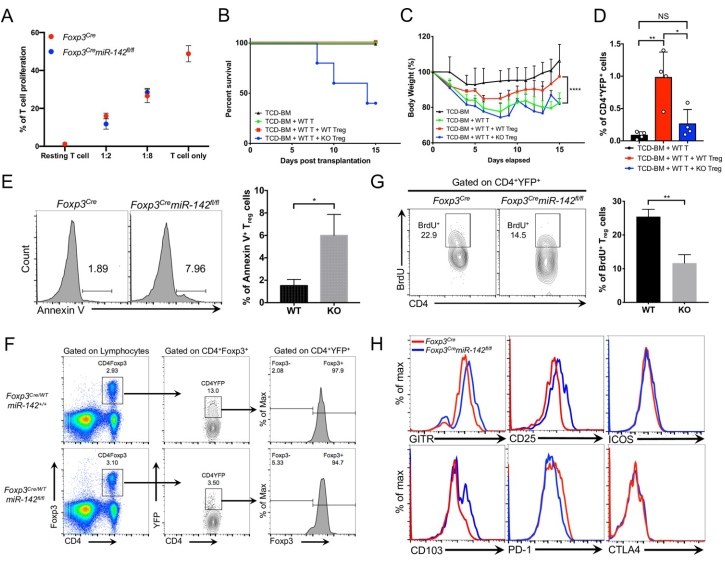
图3 miR-142消融会损害Treg细胞的抑制功能和稳态
4. Treg细胞中miR-142的特异性缺失导致miR-142-3p靶点的整体抑制
为了揭示miR-142控制Treg细胞功能的分子机制,使用RNA测序对脾CD4+YFP+ miR-142充足和miR-142缺乏的Treg细胞进行了整体转录组分析:共1520个基因在miR-142消融后表达发生统计学显著变化,在miR-142缺失的Treg细胞中,988个基因表达上调,532个基因表达下调(图4A)。另外,miR-142缺陷的Treg细胞中的差异表达基因进行分析,发现miR-142-3p显著富集,而miR-142-5p在上调基因中的直接靶基因中没有显著富集(图4B)。提示Foxp3CremiR-142fl/fl小鼠中,Treg细胞稳态和功能受损很可能是由于成熟miR-142-3p表达缺失所致。根据Enrichment软件算法和基因集富集分析(GSEA) (图4C),miR-142缺失的Treg细胞中上调的转录本富集了来自IFNγ信号网络的基因。同样地,miR-142缺失的Treg细胞与WT细胞相比产生了更多的IFNγ(图4D和4E),IFNγ信号转导失调,表现为Stat1激活显著增加(图4D和4E)。另外,检测IFNγ刺激对Treg细胞存活的影响,发现IFNγ处理显著增强了miR-142缺失的Treg细胞的体外凋亡(图4G和4H)。

图4 miR-142缺失的Treg细胞中,miR-142-3p靶点整体去抑制和IFNγ信号异常
5. Ifng消融可挽救Foxp3CremiR-142fl/fl小鼠的Treg稳态缺陷并缓解系统性自身免疫性疾病的发展
为了确定IFNγ信号异常如何影响miR-142缺陷的Treg细胞的稳态,构建Foxp3CremiR-142fl/flIfng /双KO小鼠。在双KO小鼠中,Treg稳态缺陷完全恢复(图5A)。此外,Ifng缺失减轻了Foxp3CremiR-142fl/fl小鼠系统性淋巴增生性和致命自身免疫性疾病的发展。这一结论在Foxp3CremiR-142fl/flIfng /小鼠上得到支持(图5B-F)。需要注意的是,双KO小鼠显示出组织炎症减轻,免疫细胞浸润到外周组织的数量明显减少(图5G)。这些形态学变化与Foxp3CremiR-142fl/flIfng/小鼠周围naive Tconv细胞数量的适度增加相关(图5H),表明miR-142-IFNγ信号轴对维持Treg细胞稳态至关重要。尽管Foxp3CremiR-142fl/flIfng/小鼠中Treg细胞频率恢复,但双KO小鼠中剩余的CD4+ T转换细胞过度激活暗示miR-142在调节Treg细胞免疫抑制活性中可能发挥作用。

图5在Foxp3CremiR-142fl/fl小鼠中,阻断IFNγ的产生可以修复Treg细胞稳态缺陷并减轻系统自身免疫
6. miR-142-3p靶向多种IFNγ相关基因
在miR-142缺失的Treg细胞中,几个与IFNγ相关的基因被TargetScan算法预测为miR-142-3p的假定直接靶点(图4C)。对HITS-CLIP数据库的扩展分析显示,缺氧诱导因子1 alpha (Hif1a)是miR-142-3p的潜在靶点(图6A)。通过荧光素酶报告基因检测,证实了miR-142-3p通过直接结合的3'-UTR序列来减弱Hif1a和Ifnγr2表达的能力(图6B)。同时,miR-142缺失的Treg细胞中Hif1α和IFNγR2蛋白水平显著升高,而CD4+Tconv细胞中Hif1α表达保持不变(图6C)。但是在缺乏miR-142表达的Treg细胞中,没有观察到Hif1a mRNA表达的变化。
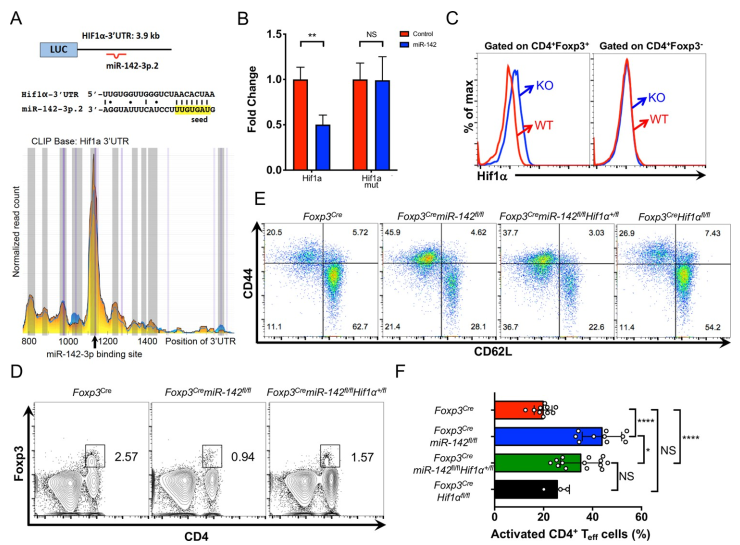
图6在Foxp3CremiR-142fl/fl小鼠中,降低Hif1a基因剂量可部分恢复Treg群体的正常大小,并减弱外周血T细胞的过度激活
7. 在Foxp3CremiR-142fl/fl小鼠中,Hif1a单倍体不足挽救了Treg细胞稳态缺陷
为了确定miR-142-Hif1a轴在Treg细胞稳态和功能中的作用,通过将Foxp3CremiR-142fl/fl小鼠与携带条件性Hif1a等位基因(Hif1afl/fl)的小鼠杂交,降低了miR-142缺陷型Treg细胞中Hif1a基因的剂量,产生的Foxp3CremiR-142fl/flHif1a+/fl小鼠显示Treg细胞丰度的部分恢复(图6D)。此外,Foxp3CremiR-142fl/flHif1a+/fl小鼠显示出外围激活/效应CD4+ T细胞频率的部分降低(图6E和6F)。
结论
miR-142作为Treg细胞发育、稳态和抑制活性的中心调节因子,部分通过限制IFNγ的产生和应答来介导其在Treg细胞中的功能。该研究促进对Treg细胞生物学的理解,这些新的见解可能为癌症免疫治疗和自身免疫性疾病中Treg细胞活性的靶向药理操作开辟新的途径。






