tRF3008A以AGO依赖的方式使FOXK1失稳,从而抑制结直肠癌的进展和转移
tRNA衍生的片段(tRFs)已被证明在癌症生物学中具有重要的调节作用。然而,tRF对结直肠癌(CRC)的贡献仍在很大程度上未知。近日,有研究发现tRF3008A以AGO依赖的方式使FOXK1失稳,从而抑制结直肠癌的转移和进展。该研究于2022年1月发表在《Journal of Experimental & Clinical Cancer Research》,IF:11.161。
技术路线:
主要研究结果:
1.系统性识别CRC中与癌症相关的tRF
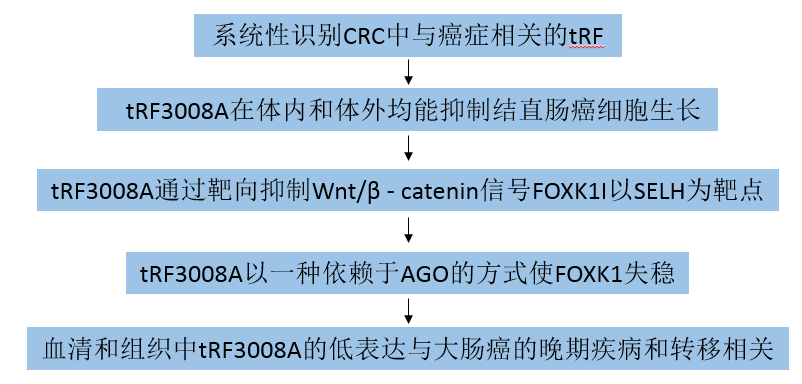
根据3对人类CRC和邻近非肿瘤组织中的tRF和tiRNA-seq分析,用分层聚类热图和火山图显示(图1A和B),条形图来显示序列读取长度分布(图1C)。研究发现tRF-5在大肠癌组织和ANT中的表达最高,并且tRF-3在邻近非肿瘤组织中的表达高于在大肠癌组织中的表达(图1D和E)。为了验证RNA-seq结果,选取差异最大的前3个tRF (tRF3008A、tRF1001和tRF3001)作为候选tRF,发现tRF3008A(AS-tDR-000076)表达差异最显著,且CRC组织的RT-qPCR证实了这一发现(图1F)。
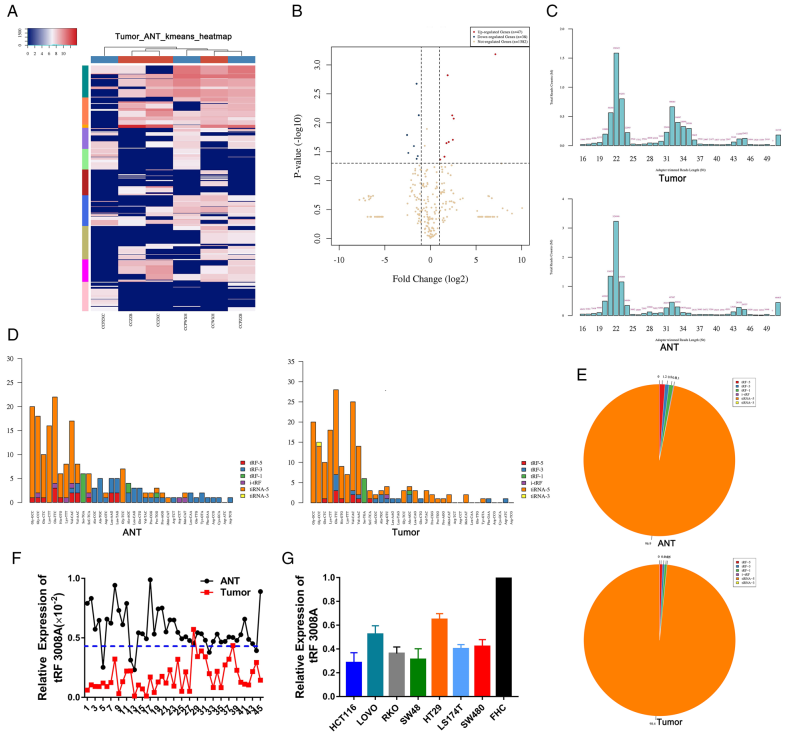
图1结直肠癌中tRF基因的全基因组图谱
2. tRF3008A在体内和体外均能抑制结直肠癌细胞生长
RT-qPCR检测tRF3008A在FHC细胞株(胎结肠细胞株)和7株人CRC细胞株中的表达。在8个细胞系中,tRF3008A在FHC细胞中表达量最高,在CRC细胞中,HCT116细胞表达量最低,HT29细胞表达量最高(图1G),综合功能研究选择HCT116细胞和HT29细胞。
CCK8和EdU检测细胞增殖,结果显示,与阴性对照相比,tRF3008A模拟物的生长显著减少,而tRF3008A敲除后的生长增加(图2A 和B)。此外,在HCT116和HT29细胞系中,tRF3008A相对较高组的凋亡细胞数比tRF3008A相对较低组的凋亡细胞数更多(图2C)。此外, tRF3008A沉默显著改善了HT29细胞的迁移和侵袭,而tRF3008A模拟物则阻碍了HCT116细胞的迁移和侵袭(图2D)。这些数据共同表明过表达tRF3008A可以延迟CRC细胞的进展。
动物实验中,高tRF3008A组的肿瘤生长明显受到抑制(图2E 和 F)。而另外HCT116对照组观察到肺转移,但HCT116 tRF3008A模拟组的肺转移明显减少(图2G)。免疫组化染色检测Ki67(增殖),cleaved caspase-3(凋亡)和MMP-9(侵袭)进一步证实了tRF3008A对肿瘤进展的抑制作用(图2H)。
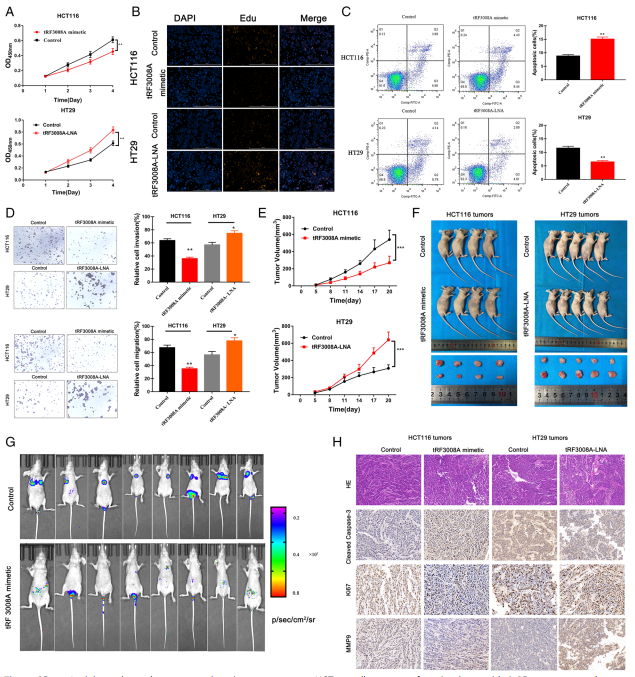
图2 tRF3008A在体外抑制结直肠癌生长和迁移
3. tRF3008A通过靶向抑制Wnt/β - catenin信号FOXK1
为了选择和识别tRF3008A的下游靶点,采用mRNA靶点预测算法进行生物信息学分析(图3A),发现重叠程度最高的相关基因为ADAMTS4、DDA1、HOXC13和FOXK1。检测了这些基因在HCT116细胞和HT29细胞中的表达水平:ADAMTS4和FOXK1在tRF3008A-Low HCT116细胞和tRF3008A-High HT29细胞中的表达差异最显著(图3B)。相关性结果显示FOXK1在CRC中与tRF3008A表达呈负相关,而ADAMTS4与tRF3008A表达呈显著相关性,但相关性较差(图3C)。为了,通过双荧光素证实tRF3008A与预测靶基因之间的直接关系载体中(图3D和E)。与对照组相比,tRF3008A模拟物降低了Luc-FOXK1荧光素酶报告酶活性,但没有降低Luc-ADAMTS4的荧光素酶报告酶活性(图3E,左)。验证了tRF3008A通过调控FOXK1的作用3'UTR但不是ADAMTS4。结合位点突变,使tRF3008A-FOXK1失效3'UTR相互作用,发现tRF3008A选择性抑制了FOXK1的WT-3'UTR驱动的报告基因(图3E)。进一步tRF3008A模拟物降低了FOXK1的蛋白水平,在HCT116细胞中,tRF3008-LNA的作用增加了HT29细胞中FOXK1的水平 (图3)。根据之前的报道,FOXK1正向调控Wnt/β- catenin信号通路。由于Wnt/β- catenin信号通路中的下游靶点(c-JUN、c-Myc、cyclin D1、CD44和Axin2)可以促进结直肠癌的生长。因此选择了三个确定的靶点(C-JUN, c-Myc, cyclin D1),并发现在tRF3008A模拟处理下,它们的表达在HCT116细胞中显著下调,而在HT29细胞中,在tRF3008A敲除后表达上调(图3G)。
为了测试tRF3008A/FOXK1轴在Wnt信号转导中的作用,用sh-FOXK1转染HCT116细胞,发现它在tRF3008A模拟治疗中显著抑制了Wnt信号转导,Wnt激动剂1减弱了这一作用(S8178)(图4A)。相反,HT29细胞中过表达FOXK1 (OE-FOXK1)诱导的Wnt信号通路与tRF3008ALNA类似,Wnt通路抑制剂IWR-1-endo可改善Wnt信号通路(S7086) (图4A)。HCT116细胞的生长被sh-FOXK1抑制,凋亡增加,这与tRF3008A模拟处理相似,Wnt激活剂处理降低了HCT116细胞的生长(图4B-F)。OE-FOXK1可促进HT29细胞的生长,减少细胞凋亡,类似于tRF3008A-LNA, Wnt抑制剂可减少细胞凋亡(图4B-F)。总的来说,这些观察结果表明tRF3008A通过FOXK1/WNT通路至少部分抑制CRC的生长。
图3 tRF3008A调控FOXK1表达
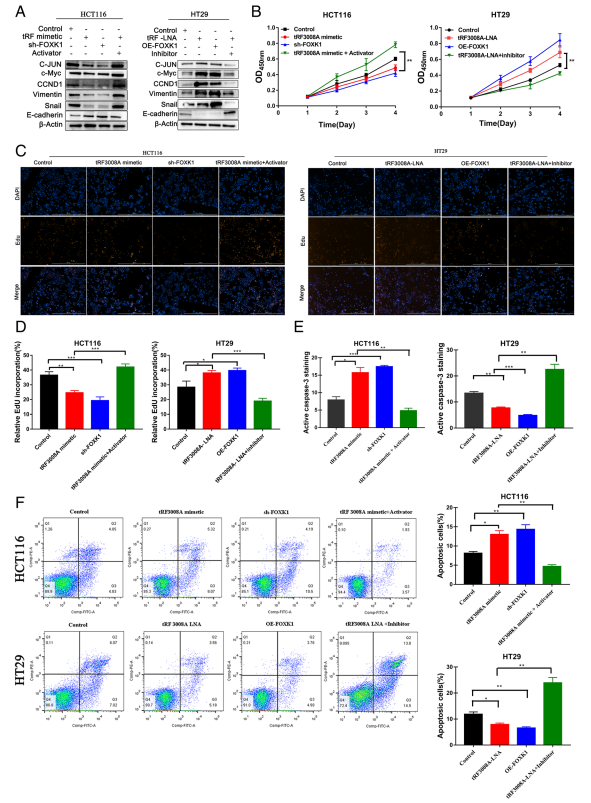
图4 tRF3008A通过FOXK1/Wnt通路抑制CRC的生长和EMT
4. tRF3008A以一种依赖于AGO的方式使FOXK1失稳
通过合成和生物素标记的tRF3008A mimic,进行了sRAP-MS(小RNA亲和纯化-质谱)来评估tRF3008A相互作用的蛋白。根据各种结合评分(图5A和B),tRF-3008A被发现与Argonaute蛋白高度相关。GO表明,RNA剪接和加工是这些蛋白质的共同功能(图5C),WB进一步证明了tRF3008A与AGO之间的相互作用 (图5D)。RT-PCR分析证实tRF3008A在pan-Ago免疫沉淀(IP)部分相对于对照IP富集(图5E)。此外,tRF3008A特异性地结合到包含四个Argonaute蛋白的沉默复合物中(图5E)。AGO沉默逆转了tRF3008A诱导的FOXK1在蛋白和mRNA水平上的下调(图5F)。因此,AGO对于tRF3008A的基因抑制是必要的。
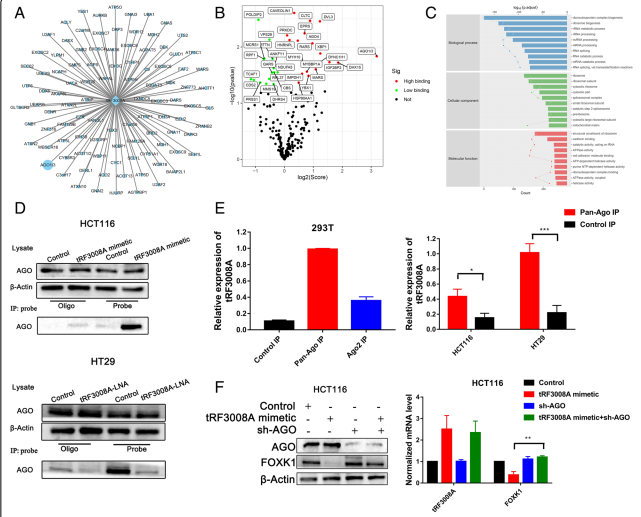
图5 tRF3008A依赖于AGO调节FOXK1
5. 血清和组织中tRF3008A的低表达与大肠癌的晚期疾病和转移相关
表1显示利用单独的训练队列(n=45)和验证队列(n=34)检测tRF3008A表达的潜在临床意义,低tRF3008A表达与较大的肿瘤大小和较晚期的临床分期相关。tRF3008A高表达组的DFS较好,而FOXK1高表达组的DFS较差 (图6A)。多因素Cox回归分析显示,tRF3008A高表达是两个临床训练队列中较好的预后的独立预测因子(HR: 0.701, 95% CI: 0.458 - 1.005, P=0.002,表2)。另外,术前和术后患者血液样本(血浆)中,tRF3008A在术后表达增加(图6B)。同时,tRF3008A表达越低,临床期越早,提示tRF3008A在CRC中起抑癌作用(图6C),tRF3008A和FOXK1在CRC组织中呈负相关 (图6D)。综上所述,这些发现支持tRF3008A表达降低可能是CRC患者预后不良的潜在生物标志物。
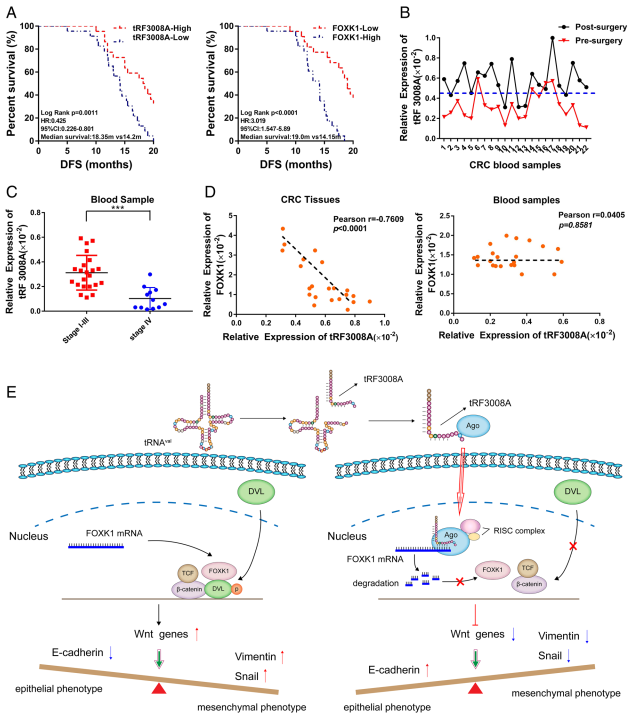
图6 tRF3008A作为结直肠癌的新型预测性生物标志物

结论:
特定的tRNA衍生片段可能是结直肠癌发生的肿瘤抑制调节剂:tRNA衍生的tRF3008A,通过与AGO结合,降低结肠癌细胞中致癌转录本FOXK1的稳定性,并在转录后沉默中发挥指导作用(图6E),表明活性的tRF在结直肠癌中可以作为调节因子和潜在的生物标志物和治疗靶点。






