在16q22.1位点的增强子变体通过调节PRMT7的表达使其更易发生肝细胞癌
大多数癌症的致病变异是在基因调控元件中发现的,例如增强子。然而,易导致肝细胞癌(HCC)的增强子变异仍未被报道。本研究中对HCC增强子进行筛选并研究其分子机制,本研究于2022年4月发表于《Nature communicate》, IF=12.121。
本文技术路线:

主要结果:
1. 增强区SNP rs73613962与HCC风险显著相关
为了获取存在于增强子中的HCC风险相关SNPs,筛选出总计4898个HCC SNPs和7060例非HCC对照,并对其中的6个候选SNPs进行验证 (Fig. 1a)。在第1个复制阶段,这6个筛选的候选SNPs都被评估为与HCC风险的相关,其中只有rs73613962位于PRMT7的16q22.1位点的内含子区域 (Fig. 1b)。在第2个复制阶段, rs73613962被一致证实与HCC风险显著相关,rs73613962在GWAS显著水平上被确定为一个HCC易感位点 (Fig. 1C)。
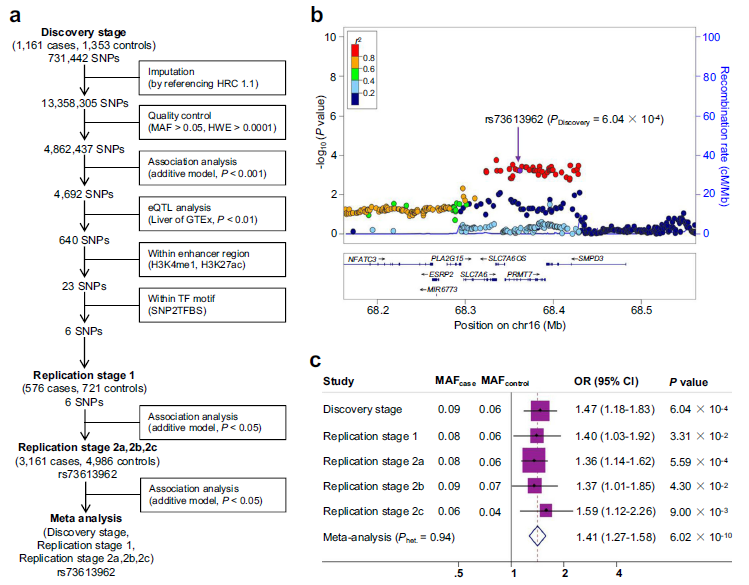
Fig1 筛选并验证了候选增强子变体rs73613962与HCC风险显著相关
2. 含有rs73613962的区域具有等位基因特异性增强子活性
在HepG2细胞中,rs73613962位点附近的H3K4me1和H3K27ac明显的表观遗传信号验证了rs73613962位点包含增强子活性的存在(Fig. 2a)。高信号的转录因子结合和rs73613962附近的DNase簇可能增强了增强子活性(Fig. 2a)。
为了实验验证含有rs73613962的增强子活性,作者进行了增强子双荧光素酶报告基因检测,发现在肝癌细胞系中,以rs73613962为中心的DNA序列在正向和反向方向均显示出高于对照序列的荧光素酶活性 (Fig. 2b–g)。接下来,作者研究了rs73613962是否会影响增强子的活性。结果表明,在这些HCC细胞系中,具有危险等位基因G的序列与具有非危险等位基因T的序列相比,具有显著的荧光素酶活性 (Fig. 2b-g),提示该区域可能是一个具有等位基因特异性活性的增强子。
综上所述,这些数据表明含有HCC易感基因rs73613962的PRMT7内含子区域具有等位基因特异性增强子活性,而rs73613962的风险等位基因G相对于非风险等位基因T具有更高的增强子活性。
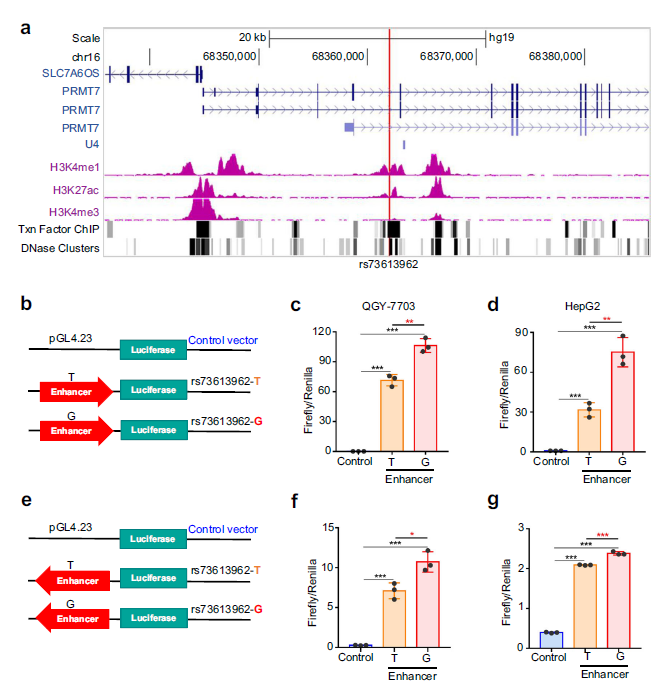
Fig2含有rs73613962的区域具有增强子信号和等位基因特异性增强子活性
3. 增强子变体rs73613962调节PRMT7的表达
为了探究rs73613962是否与其附近基因的表达相关,肝脏组织进行了cis-eQTL分析,发现rs73613962仅与PRMT7的表达水平显著相关 (Fig 3a)。有趣的是,PRMT7是rs73613962的宿主基因,这表明该内含子增强子可能直接调控PRMT7的转录。此外,rs73613962的风险等位基因G被发现与PRMT7表达增加密切相关,与上述荧光素酶检测结果一致。通过分析rs73613962基因型和rs73613962的表达数据,发现所有的肝细胞癌(LIHC)受试者、TCGA肿瘤和癌症基因中表达模式相同 (Fig 3b)。
为研究包含rs73613962的区域是否在CRISPR-Cas9, dCAS9-KRAB顺式突变、抑制和激活PRMT7表达中起因果作用,利用CRISPR-Cas9对rs73613962周围区域进行基因编辑。在CRISPR-Cas9实验中,作者选择了rs73613962位点三个不同突变的单克隆和该区域两个无突变的克隆进行后续调查。如图3c所示,与两个对照相比,在三个突变的克隆中,PRMT7的表达量明显下降,这表明PRMT7的表达受rs73613962的直接调控(Fig 3C),与此结果一致的是,CRISPRi检测结果显示,在QGY-7703和HepG2细胞系中,当sgRNAs靶向rs73613962的上下游序列时,从QGY-7703和HepG2细胞系中PRMT7的表达均降低,说明包含rs73613962的增强子活性可能减弱, (Fig. 3d–f)。在CRISPRa试验中,作者检测到PRMT7 mRNA水平和蛋白水平在QGY-7703和HepG2细胞系中均显著升高(Fig. 3g–i)。表明该区域的增强子活性可能通过dCAS9-融合转录激活域VP48增强。
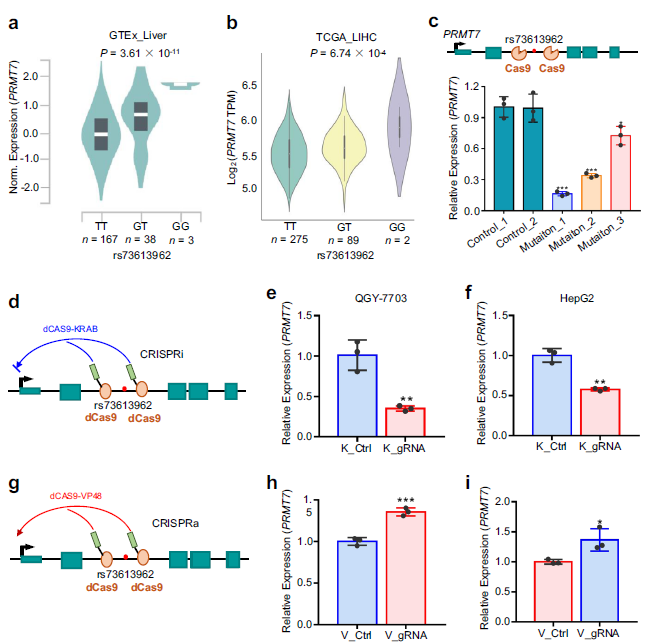
Fig 3 rs73613962通过调节增强子活性来调节PRMT7的表达
4. rs73613962的风险等位基因G提高了HNF4A基因的结合能力
在竞争结合实验中观察到,等位基因G的寡核苷酸对核提取物的竞争能力高于等位基因T的寡核苷酸 (Fig. 4a)。
作者首先通过对含有rs73613962的增强子序列进行ChIP实验,确定了HNF4A是否能与驻留在rs73613962的增强子结合。如图4b所示,当HNF4A特异性抗体与对照抗体免疫球蛋白G相比较时,通过ChIP与定量聚合酶链反应(ChIPqPCR)在QGY-7703细胞株中检测到HNF4A结合在该区域的强富集。此外,ChIP-PCR也证实了HNF4A与QGY-7703和HepG2细胞株中含有rs73613962增强子区域的结合(Fig. 4c)。
随着HNF4A与等位基因G的结合增多,HNF4A基因的敲除预计会对含等位基因G的增强子活性产生更大的影响。利用增强子双荧光素酶报告基因检测,作者发现当siRNA下调HNF4A时,含有等位基因G的增强子的荧光素酶活性显著降低。相比之下,含有等位基因的增强子的荧光素酶活性在HNF4A基因敲除后几乎没有变化(Fig. 4d)。此外,在核提取物中加入anti-HNF4A后,两种肝癌细胞系中HNF4A与含等位基因G的序列的结合消失了(Fig. 4e)。
由于rs73613962与PRMT7的表达有关,作者推测,如果rs73613962相关增强子结合需要该转录因子,则下调该转录因子将降低靶基因PRMT7的表达。作者在QGY-7703和HepG2细胞系中敲除了HNF4A,并发现这些细胞中PRMT7的表达下降 (Fig. 4f)。此外,作者发现PRMT7 RNA水平与HNF4A的表达呈正相关 (Fig. 4g)。有趣的是,携带G等位基因的受试者比携带TT纯合子的受试者具有更高的相关性 (Fig. 4h,i)。
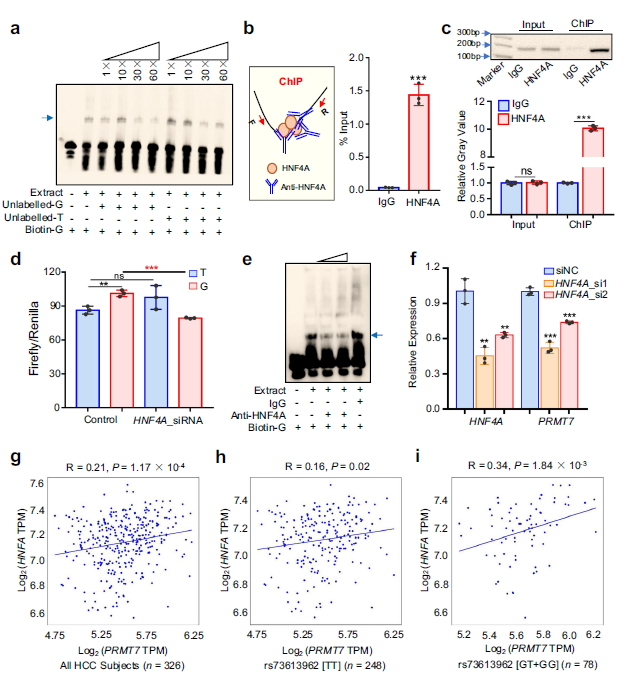
Fig 4.:rs73613962的风险等位基因G增强了转录因子HNF4A的结合能力,促进PRMT7的表达
5. PRMT7促进癌症相关表型
作者发现目的基因PRMT7内含子内的HCC风险等位基因rs73613962 G增强了HNF4A的结合,而HNF4A反过来促进了PRMT7的表达。因此,作者想知道PRMT7的高表达是否有助于癌症相关的细胞表型,从而导致高HCC风险。在QGY-7703细胞中,用两个短发夹敲低PRMT7 RNAs均降低了QGY-细胞的增殖速率(Fig. 5a,b)。PRMT7-下调的细胞集落形成能力也低于对照组细胞(Fig. 5c)。此外,细胞耗尽与对照细胞相比,PRMT7表达明显阻滞G1期,显著降低S期(Fig. 5d)。此外,在HCC细胞株QGY-7703中,敲除PRMT7可显著降低细胞迁移和侵袭能力(Fig. 5e,f)。
体内致瘤实验进一步表明,PRMT7下调可降低异种移植瘤的生长(Fig. 5g–i)。通过免疫组化(IHC)检测发现,yu与癌旁组织相比,PRMT7在HCC组织中表达更高 (Fig. 5j,k)。此外,在TCGA LIHC中,肿瘤组织中PRMT7的表达高于正常组织(Fig. 5l)。
综上所述, PRMT7的表达由含有rs73613962的内含子调控的,可以解释rs73613962和HCC风险之间的关联,至少在一定程度上是这样的。
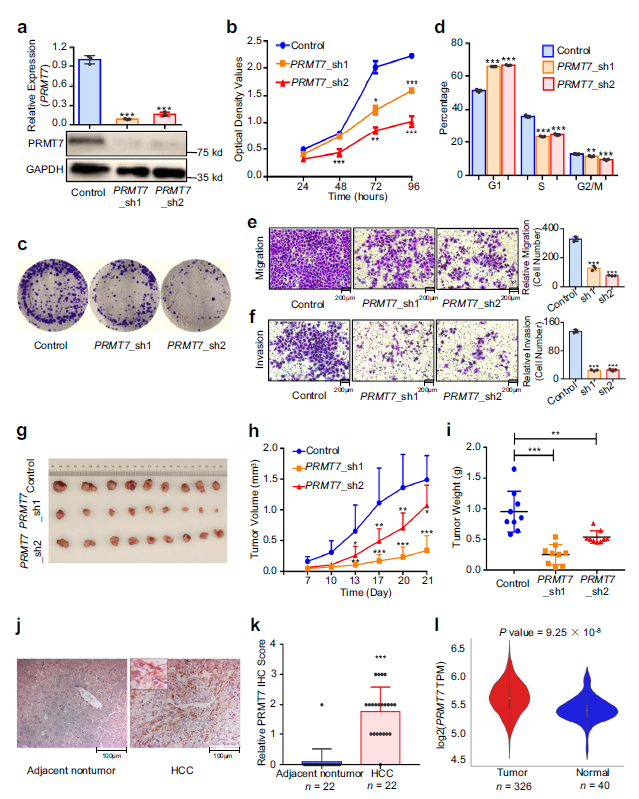
Fig 5. PRMT7下调降低了癌症相关表型,而在HCC肿瘤中PRMT7上调
6. PRMT7通过H4R3me2s修饰调节p53信号通路
对差异表达基因进行功能富集分析,作者发现在癌症发展中发挥重要作用的p53信号通路排在前1位,暗示这些在该通路中富集的基因可能参与了prmt7介导的HCC发展(Fig 6a,b)。作者通过实时定量聚合酶链反应(qRT-PCR)验证了CDKN1A、GADD45B、FAS、PMAIP1等基因属于p53信号通路 (Fig. 6c)。
据报道,PRMT7介导的组蛋白4的精氨酸上的单甲基精氨酸(MMA)可催化建立抑制性组蛋白标记。作者通过Western blot检测了H4R3me2s修饰对prmt7下调的细胞和对照组的信号。
作者通过WB检测了PRMT7下调细胞和对照组细胞中H4R3me2s修饰的信号。检测到H4R3me2s信号显著降低,但与对照组相比,PRMT7耗尽样品的H4没有明显变化 (Fig. 6d),表明PRMT7对H4R3me2s修饰基因的调控。 CAGCTG基序是H4R3me2s 结合区显著富集的序列,因此,作者扫描这些富集于p53信号通路的核心启动子基因,以获取CAGCTG motif的分布。,作者通过RNA-seq数据对PRMT7下调细胞中上调的4个基因进行了研究,并通过qRT-PCR进行了验证。如图6e-h,我们发现p53信号通路中富集的基因H4R3me2s修饰区包括CAGCTG基序。
因此,这些结果综合提示富集于p53信号通路的基因,其H4R3me2s修饰受PRMT7调控,可能参与了PRMT7介导的癌症相关表型。
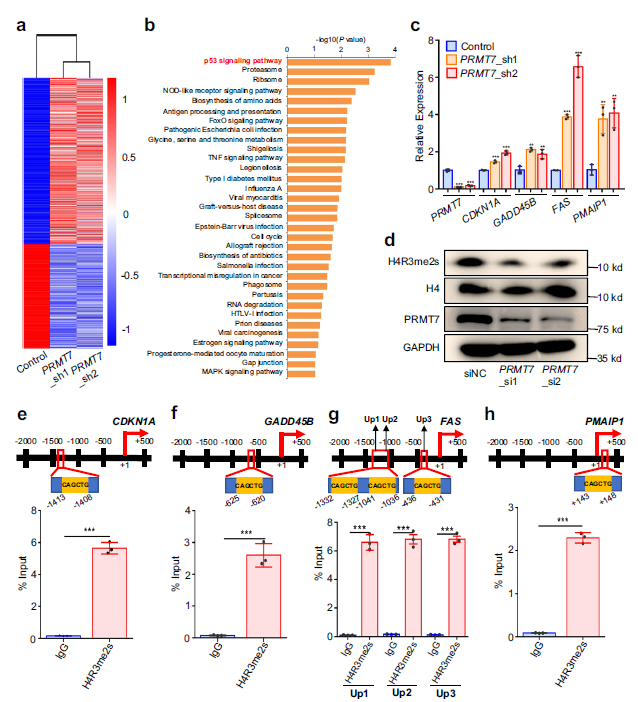
Fig. 6在HCC细胞中p53信号通路受PRMT7调控
在PRMT7的一个内含子增强区发现了一个肝癌易感SNP rs73613962,并证实了其在癌症相关表型中的因果作用。转录因子HNF4A被发现与含有rs73613962的增强子区域结合,促进宿主基因PRMT7的表达,最终参与了HCC的发病机制。这一研究成果可能有助于阐明肝癌的发病机制,并对肝癌的预防和治疗具有潜在的意义。
参考文献:
Shen, T., et al., An enhancer variant at 16q22.1 predisposes to hepatocellular carcinoma via regulating PRMT7 expression. Nat Commun, 2022. 13(1): p. 1232.






