CircVPS13C促进垂体腺瘤的生长
垂体腺瘤(NFPA)是最常见的颅内肿瘤之一。CircRNA通过充当miRNA海绵和蛋白质支架或编码功能性蛋白质在多种生物过程中发挥重要作用。然而,circRNA在NFPA进展中的作用尚不清楚。在本文中,CircVPS13C在NFPA样本和细胞系中显著上调。功能获得和功能丧失实验表明,在体外和体内,沉默circVPS13C抑制垂体瘤细胞的增殖。在机制上,circVPS13C沉默增加IFITM1的表达,并随后激活其参与MAPK和凋亡相关信号通路的下游基因。拯救实验表明IFITM1的过表达部分逆转了circVPS13C的生物学效应。进一步研究表明,circVPS13C通过与RRBP1竞争性相互作用抑制IFITM1的表达,从而减轻IFITM1 mRNA的稳定性。临床上,高风险NFPA样本中circVPS13C的表达明显较高,经蝶窦腺瘤切除术后7天患者血清中circVPS13C表达下调。我们的研究结果表明,circVPS13C通过一种新的机制,即通过与内质网膜上的核糖体结合蛋白相互作用来调节mRNA的稳定性在NFPA的增殖和发育中起着关键的调节作用。本文于2022年1月发表于Oncogene(IF=9.867)上。
技术路线

结果
1)NFPA样本中circVPS13C表达显著增加
使用CircRNA微阵列比较年龄和性别配对的NFPA和NP组织的CircRNA表达谱。微阵列强度值的箱线图显示样本之间的差异较小,表明两组之间的circRNA表达模式相似(图1a)。热图(图1b)和火山图(图1c)用于显示两组中差异表达的CircRNA。两组共有1493个circRNAs差异表达。其中,在NFPA样本中,990个显著上调,503个显著下调。我们重点研究了具有较高绝对表达水平的上调circRNA。我们选择了其中10个circRNAs进行进一步研究,因为据报道它们的亲本基因参与细胞增殖的调节。与NP组织相比,NFPA样本中的所有circRNAs均被证实显著上调(图1d)。然后,选择qRT-PCR周期阈值最低的前5个circRNAs,采用CCK-8法评价其在垂体肿瘤衍生滤泡星状细胞(PDFS)中的生物学功能。如图1e所示,circVPS13C沉默后对细胞增殖的抑制效果最好。综上所述,这些结果促使我们进一步研究circVPS13C在NFPA发生和发展中的作用。
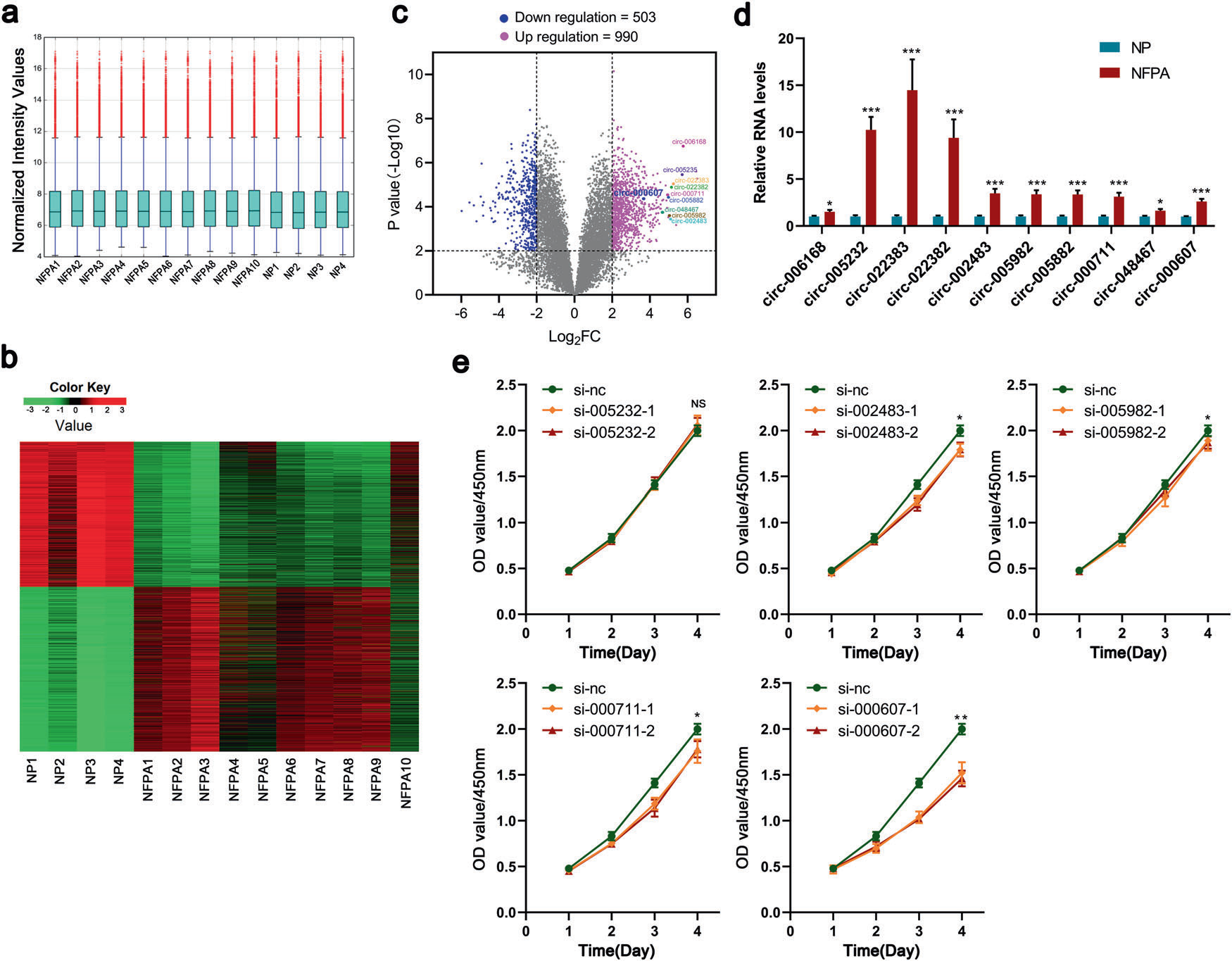
2)circVPS13C在垂体腺瘤细胞中的鉴定与验证
CircVPS13C转录自VPS13C基因位点,位于人类第15号染色体上。其长度为608 bp,包含8-13外显子。为了确认circVPS13C是一个circRNA,我们进行了Sanger测序来识别头尾剪接(图2a)。然后,设计不同的引物,以PDFS细胞中提取的cDNA或gDNA为模板,扩增内源性circVPS13C的头尾剪接位点(图2b)。最后,RNase R耐受试验和琼脂糖电泳分析证实circVPS13C对RNase R耐受(图2c)。综上所述,这些数据证实了circVPS13C是一个真正的circRNA。为了表征circVPS13C的亚细胞位置,我们用RNA-FISH方法对circVPS13C进行了测定,发现在PDFS细胞中,circVPS13C在细胞质和核中都富集。亚细胞分离分析和半定量PCR进一步验证了circVPS13C在细胞质和核中的富集(图2d)。此外,我们用RNA-FISH检测了circVPS13C在NFPA和正常垂体样本中的分布。与qRT-PCR检测结果一致,circVPS13C染色在NFPA样本中比在正常垂体组织中更集中(图2e)。
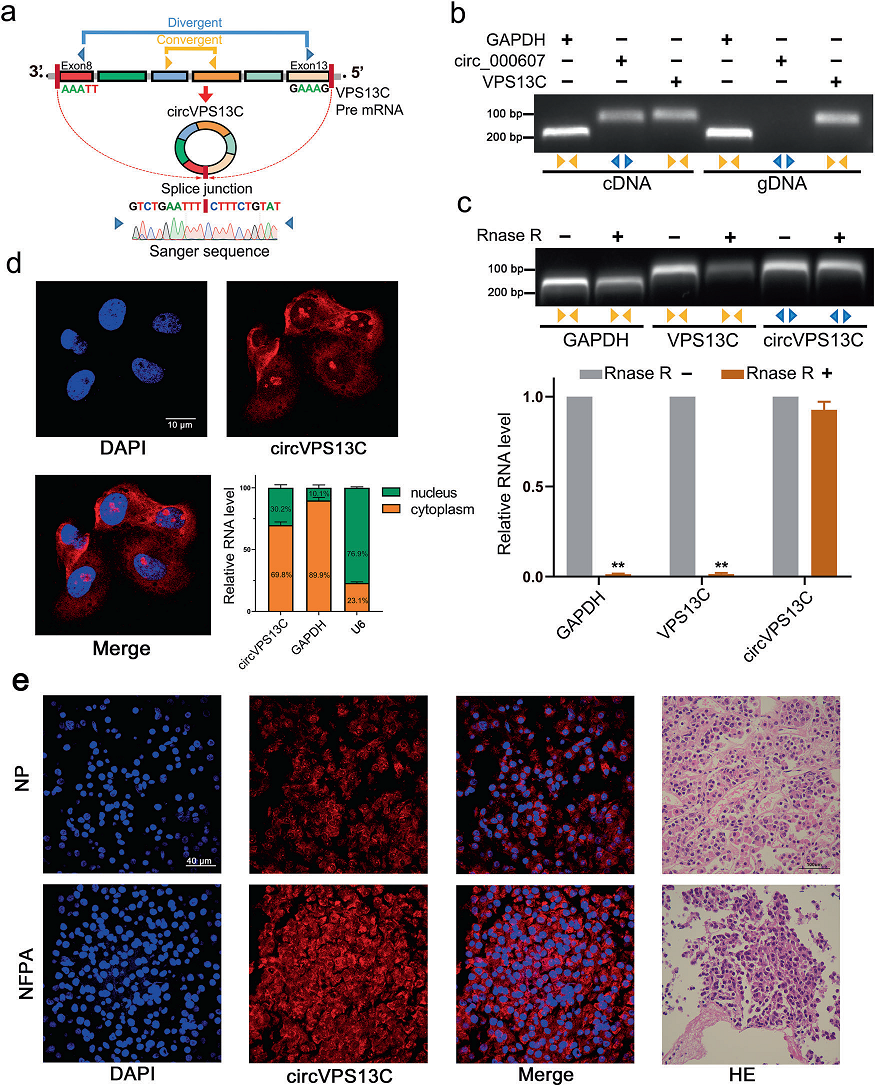
3)CircVPS13C沉默部分通过增加凋亡抑制NFPA细胞的增殖
为了评价circVPS13C在NFPA发育中的生物学功能,我们利用PDFS和人源性NFPA原代细胞进行了功能获得和功能丧失实验。结果显示,circVPS13C的表达被两种shRNAs有效地沉默,在转染circVPS13C载体的PDFS细胞中稳定上调(图3a)。CCK-8实验显示,沉默circVPS13C显著削弱了PDFS细胞和人源NFPA细胞的增殖,而过表达circVPS13C则有相反的效果(图3b)。然后,我们进一步确定了circVPS13C对另外6个人源性NFPA原代细胞的影响。CCK-8实验显示,在培养72 h后,circVPS13C沉默均显著抑制了它们的生长(图3c)。同样,敲低circVPS13C后,PDFS细胞的集落形成也受到明显抑制(图3d)。此外,流式细胞术凋亡检测显示,在circVPS13C敲低的细胞中,凋亡细胞的比例显著增加,而在过表达circVPS13C的细胞中,凋亡细胞的比例显著降低(图3e)。为了进一步证明circVPSC13C对垂体腺瘤细胞的作用,我们评估了circVPSC13C对MAPK信号通路的影响,该通路已被证明在包括垂体腺瘤在内的各种肿瘤的细胞增殖中发挥重要作用。一致地,circVPS13C沉默降低了体外Bcl-2、 pERK1/2和p-P38的蛋白水平,增加了cleaved Caspase-3、cleaved Caspase-9和Bax的蛋白水平。CircVPS13C过表达产生了相反的效果(图3f)。最后,为了确定circVPS13C在体内是否影响NFPA细胞的增殖,我们将转染了circVPS13C表达载体或sh-circVPS13C的PDFS细胞注射到裸鼠皮下组织。从circVPS13C敲低细胞中生长的肿瘤明显比从对照细胞中生长的肿瘤更小更轻(图3g)。综上所述,沉默circVPS13C可以抑制体外和体内NFPA细胞的增殖,部分原因是通过增加凋亡。
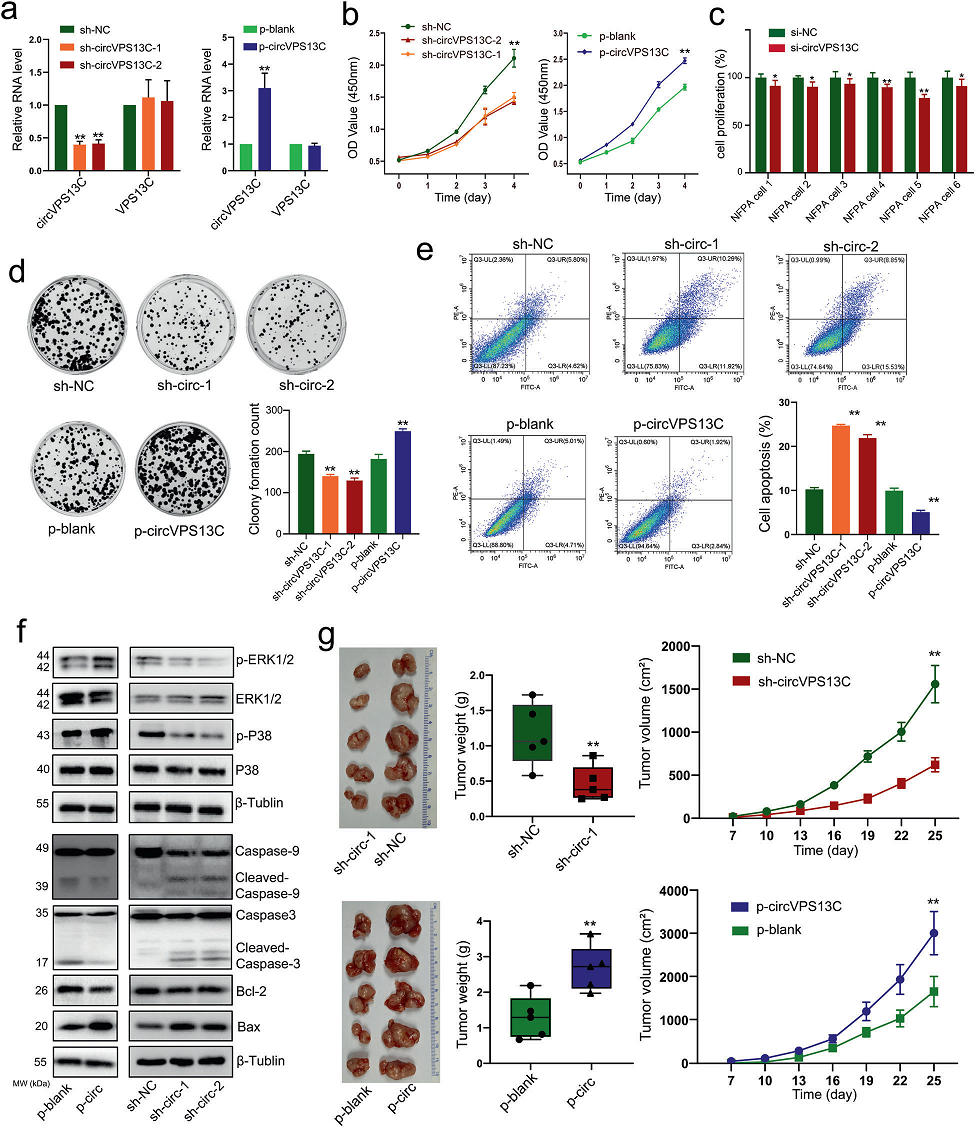
4)CircVPS13C沉默部分通过上调IFITM1表达来抑制细胞增殖
为了研究circVPS13C对NFPA细胞生物学效应的潜在机制,我们对三对circVPS13C沉默的PDFS细胞和对照细胞进行了mRNA-seq分析。结果显示,沉默circVPS13C后,共有429个基因显著上调,19个基因下调(图4a)。在15个NFPA和8个NP样本中进一步验证了表达增加最多的前10个基因和表达减少最多的9个基因,IFITM1是变化最显著的基因之一(图4b)。据报道,IFITM1已被广泛描述参与细胞增殖和迁移。此外,18个样品的western blot和43个NFPA样品的qRT-PCR均证实IFITM1表达下调(图4c),在43个NFPA样本中,circVPS13C和IFITM1显著负相关(图4d)。qRT-PCR和western blotting分析表明,circVPS13C基因的下调增加了IFITM1的表达,而circVPS13C过表达则产生相反的结果(图4e)。为了确定circVPS13C对NFPA细胞的生物学效应是否通过抑制IFITM1介导,我们进行了一项涉及circVPS13C和IFITM1的拯救实验。结果显示,敲低IFITM1可以部分逆转circVPS13C敲低对PDFS细胞增殖和集落形成的抑制作用(图4f-h)。此外,IFITM1的敲除在一定程度上逆转了circVPS13C沉默对凋亡相关蛋白和MAPK通路中蛋白水平的影响(图4i)。总的来说,circVPS13C沉默部分通过增强IFITM1的表达来抑制NFPA细胞的生长。
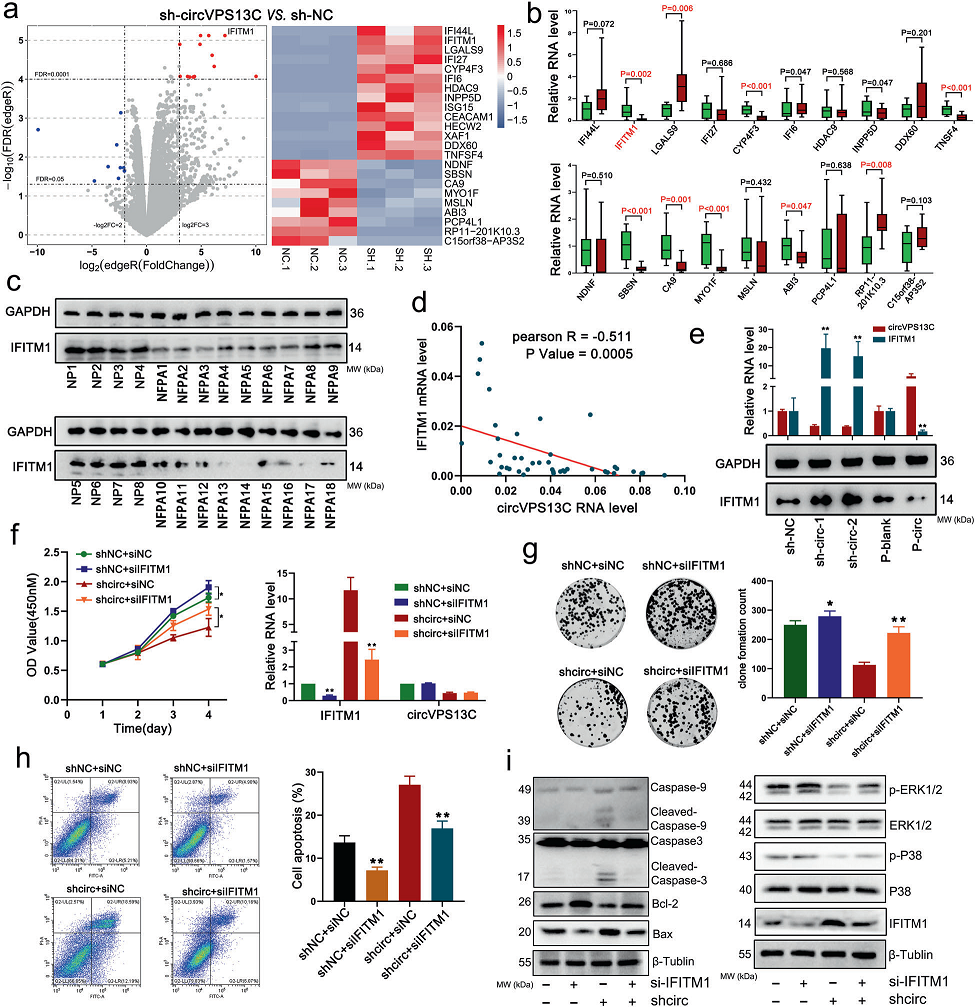
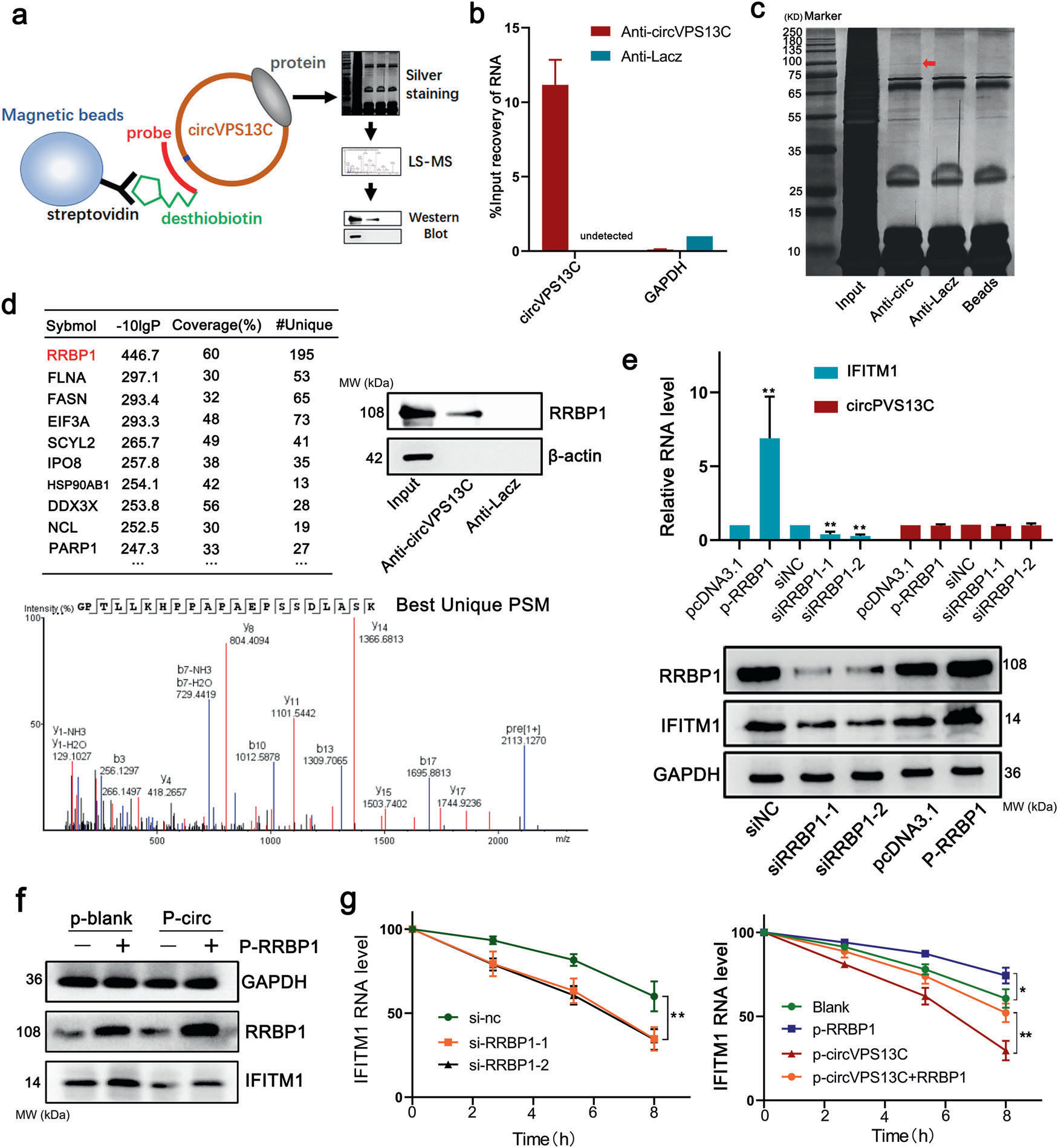
5)circVPS13C通过与RRBP1相互作用降低IFITM1 mRNA的稳定性,从而抑制其表达
我们试图研究circVPS13C如何调节IFITM1的表达。我们进行了ChIRP分析,以识别潜在的circVPS13C相关蛋白,如图5a所示。ChIRP-qPCR验证,circVPS13C-sense探针在处理组的富集效率比NC组高104倍(图5b)。应用琼脂糖电泳和银染色对circVPS13C RNA相关蛋白进行鉴定,发现anti-circVPS13C探针组与NC探针组有明显不同的阳性信号。然后采用LC-MS/MS法对阳性样品中的蛋白进行鉴定(图5c)。在circVPS13C-sense探针组中富含的蛋白中,RRBP1因其在circVPS13C-sense探针组中表达量高而备受关注,因为已有报道称RRBP1与多种恶性肿瘤的发生有关。我们用ChIRP-western blot进一步证实了这一结果(图5d)。然后,我们检测RRBP1是否参与调节IFITM1的表达。如图5e所示,RRBP1沉默后IFITM1 mRNA和蛋白水平均显著降低,而RRBP1过表达细胞IFITM1 mRNA和蛋白水平升高。同样,经western blotting证实,RRBP1过表达增加了IFITM1的水平,并部分挽救了circVPS13C对IFITM1表达的抑制(图5f)。先前的研究证实RRBP1是一种位于内质网膜上的蛋白,可以调节mRNA的稳定性,增强mRNA与核糖体的结合,促进翻译。放线菌素D抑制细胞转录后,在不同时间提取总RNA进行qPCR检测IFITM1 mRNA的稳定性。结果表明,当RRBP1沉默或circVPS13C过表达时,IFITM1 mRNA的降解显著加快。过表达RRBP1部分消除了circVPS13C对IFITM1 mRNA的影响(图5g)。综上所述,circVPS13C可能通过与RRBP1相互作用部分调控IFITM1的表达。
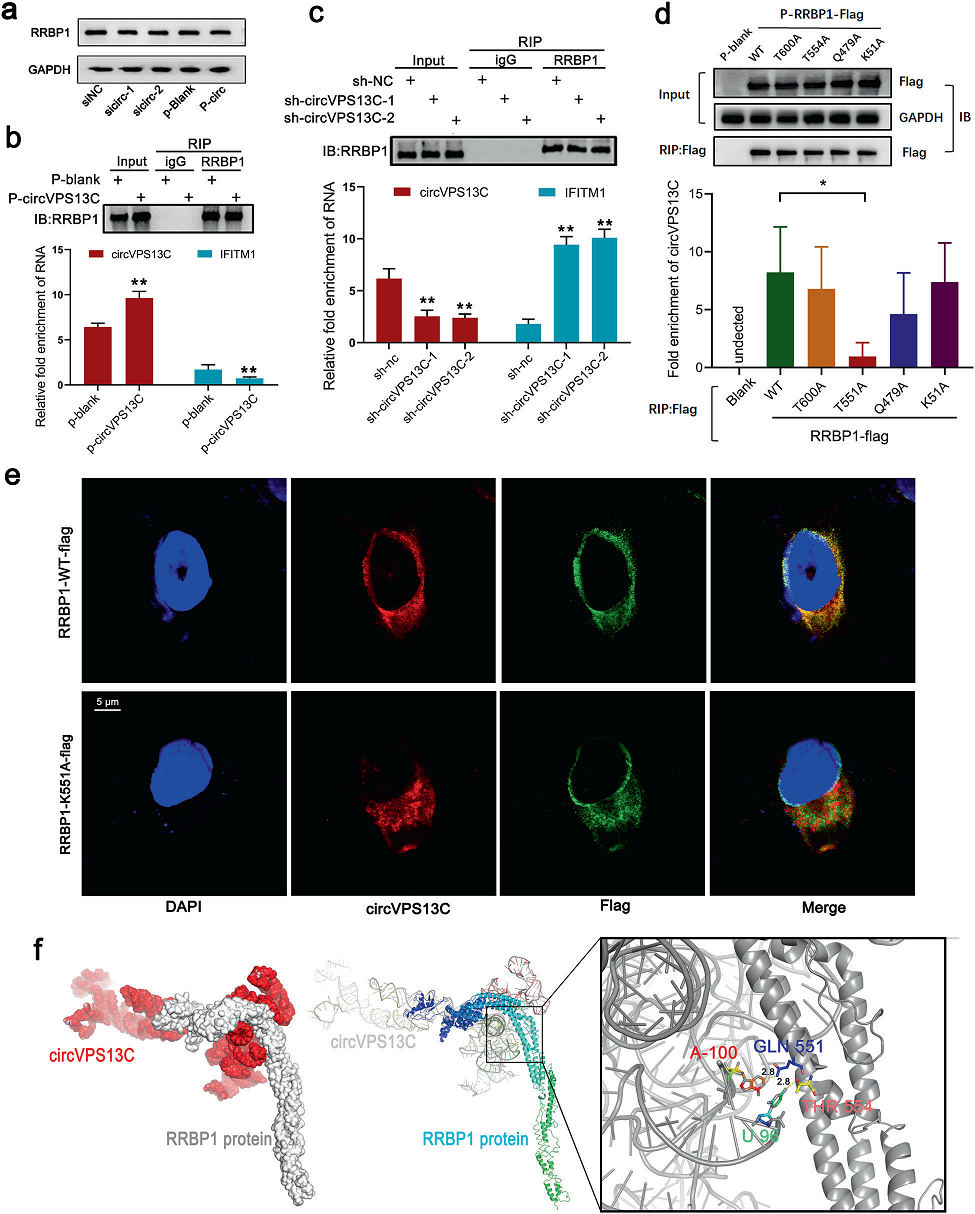
6)CircVPS13C通过与RRBP1竞争性相互作用抑制IFITM1的表达
我们探究circVPS13C如何与RRBP1相互作用抑制IFITM1的表达。circVPS13C表达的增加和减少并没有引起RRBP1蛋白水平的显著变化(图6a)。同样,RRBP1和circVPS13C mRNA表达在NFPA样本中也没有显著相关性。这些数据表明circVPS13C不太可能调控RRBP1的表达。RIP-qPCR结果显示,circVPS13C过表达增加了circVPS13C与RRBP1的相互作用水平,但降低了IFITM1与RRBP1的相互作用水平,并伴随着降低IFITM1 mRNA的表达。CircVPS13C的沉默产生了相反的效果。因此,我们推断circVPS13C通过与RRBP1竞争性相互作用抑制IFITM1的表达。RIP-qPCR结果显示,与RRBP1WT和circVPS13C的互作水平相比,RRBP1T554A + Q551A和circVPS13C的互作水平显著降低(图6d)。然后,我们用质粒RRBP1T554A + Q551A和RRBP1WT转染PDFS细胞进行共定位检测。荧光共定位结果显示,circVPS13C和RRBP1WT蛋白共定位于PDFS细胞的细胞质中,但未检测到与RRBP1T554A + Q551的共定位(图6e)。这些结果表明RRBP1通过GLN551和THR554残基与circVPS13C相互作用。RRBP1- circVPS13C复合物的模拟结构和详细的残基相互作用如图6f所示。
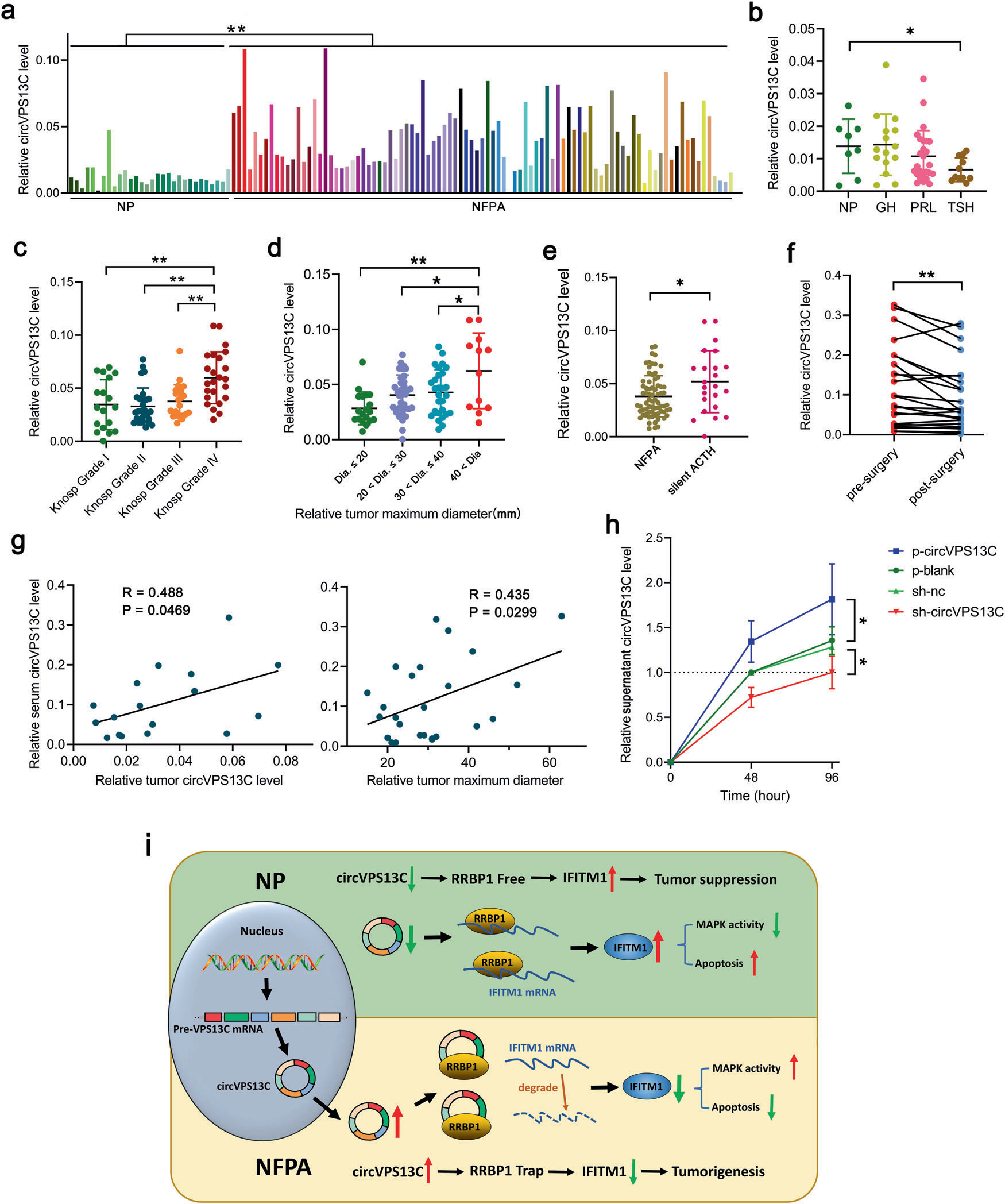
7)circVPS13C在NFPA中的临床意义
通过qRT-PCR检测93个NFPAs和23个年龄和性别配对的NP组织中circVPS13C的水平。如图7a所示,与正常组织相比,circVPS13C在NFPA组织中表达明显升高,且几乎在所有NFPA样本中circVPS13C表达均上调。然而,与正常垂体组织相比,circVPS13C在分泌GH腺瘤和催乳素瘤中表达水平没有明显改变,而在TSH腺瘤中表达下调(图7b)。接着,我们分析临床因素对circVPS13C表达的影响。circVPS13C在Knosp的IV级样本(图7c)和较大的肿瘤(图7d)中表达更高。我们发现与其他肿瘤相比,circVPS13C在沉默的皮质滋养腺瘤中的平均表达明显更高(图7e)。更有趣的是,术后7天circVPS13C在患者血清中的表达下调(图7f)。此外,血清circVPS13C水平与肿瘤样本中的circVPS13C水平相关,并与肿瘤直径显著相关(图7g)。同时,上清circVPS13C水平与PDFS细胞内表达及培养时间显著相关(图7h)。综上所述,circVPS13C特异性地结合并隔离RRBP1,通过促进IFITM1 mRNA的降解降低IFITM1的表达,从而最终促进NFPA的增殖(图7i)。
结论:
CircVPS13C在NFPA样本中显著上调,并与NFPA的侵袭性特征相关。通过与RRBP1的竞争性相互作用,circVPS13C的沉默降低了IFITM1 mRNA的稳定性,从而抑制了NFPA细胞的生长。CircVPS13C是NFPA增殖和发展的关键调控因子,提示其可能成为NFPA管理的诊断因子和治疗靶点。
参考文献:
Zhang W, Chen S, Du Q, Bian P, Chen Y, Liu Z, Zheng J, Sai K, Mou Y, Chen Z, Fan X, Jiang X. CircVPS13C promotes pituitary adenoma growth by decreasing the stability of IFITM1 mRNA via interacting with RRBP1. Oncogene. 2022 Mar;41(11):1550-1562. doi: 10.1038/s41388-022-02186-0.






