PUMILIO蛋白通过抑制p21促进结直肠癌的生长
PUMILIO (PUM)蛋白属于高度保守的PUF家族转录后调控蛋白,参与多种生物过程。然而,它们在癌变中的作用仍有待探索。在这里,作者报道了Pum1和Pum2在人类结直肠癌(CRC)中表达增加。本文于2022年3月发表于《nature communications》,IF=12.121。
本文技术路线:

本文主要内容:
1 PUM1和PUM2在人类CRC中表达增加, 肠道特异性缺失Pum1和Pum2抑制AOM/dss诱导的体内结肠癌发生
为了进一步将Pum1和Pum2与CRC的关系,作者对22名患者的CRC样本及其邻近组织的mRNA表达进行了两两比较。作者发现Pum1和Pum2在CRC临床标本中高表达(Fig 1a, c)。其中,15例患者的Pum1 mRNA水平和13例患者的Pum2 mRNA水平至少比其配对的相邻正常组织高10倍。此外,TCGA数据集显示Pum1而不是Pum2的表达与CRC分期呈正相关 (Fig. 1b, d)。
为了研究PUM蛋白在结直肠癌中的作用,作者建立了一个小鼠模型,通过条件敲除肠道上皮组织中的Pum1和Pum2基因,评价PUM蛋白在结直肠癌中的作用(Fig. 1e)。将Lgr5-cre小鼠与Pum1flox/flox::Pum2flox/flox小鼠杂交产生Lgr5cre::Pum1flox/flox::Pum2flox/flox小鼠。用他莫西芬处理Lgr5cre::Pum1flox/flox::Pum2flox/flox小鼠,获得结肠上皮细胞Pum1和Pum2双敲除小鼠(Pum1/ 2cko)。Tamoxifen处理的Pum1flox / flox:: Pum2flox/flox小鼠作为对照组。免疫组化分析显示,Pum1/2CKO老鼠结肠中无明显PUM1和PUM2蛋白存在(Fig 1j)。AOM/DSS治疗后,与对照组相比,Pum1/2CKO小鼠肠道内肿瘤数量和大小明显减少(Fig 1f)。定量分析发现,Pum1/2CKO小鼠大肿瘤(直径>4mm)数量显著减少91.5%,中型肿瘤(直径2 - 4mm)数量显著减少和小(< 2mm)肿瘤也分别减少了59.4%和25.9%(Fig. 1g)。有趣的是, 尽管Pum1/2KO小鼠比野生型对照组小,Pum1 /2CKO小鼠结肠更长,体重更重(Fig 1h, i)。这表明,对照组小鼠更容易患肿瘤,因为在没有诱导的小鼠中,结肠长度的缩短是炎症严重程度的指标,而炎症是结肠致癌的潜在原因。此外,在Pum1/2CKO小鼠中,表现为高度不典型增生的腺瘤明显减少(Fig. 1k)。提示Pum1/2CKO肠内恶性进展受到抑制。Ki-67和TUNEL染色显示,Pum1/2CKO显著降低肿瘤细胞增殖,但对细胞凋亡无显著影响(Fig. 1l, m)。综上所述,这些结果表明Pum1/2缺失显著抑制CRC的起始和发展。
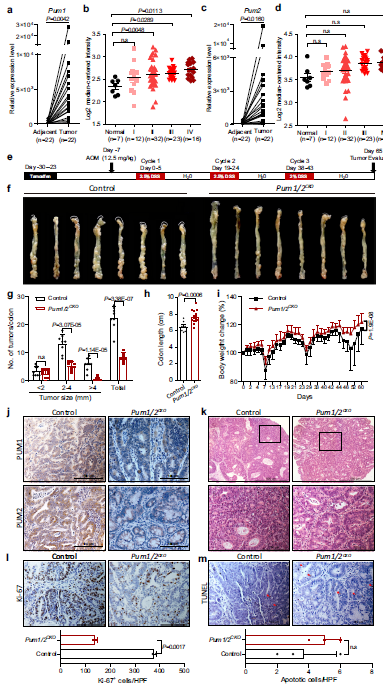
Fig1 Pum1/2CKO抑制结直肠癌的发展
2. PUM蛋白有助于CRC细胞的体外生长和体内致瘤性
进一步研究PUM1和PUM2 在CRC中的功能,首先检测了6个不同的CRC细胞株中Pum1和Pum2的表达,以正常人类结肠黏膜上皮细胞NCM460作为对照(Fig 2a, b)。结果显示,6个CRC细胞株中Pum1的表达量均显著高于正常细胞株,HCT116细胞中蛋白质的表达水平最高。Pum2在6个癌细胞株中也有5个表现出异常高的表达水平,尽管过表达程度一般没有Pum1大。WB证实了PUM1和PUM2的细胞质缺失(Fig. 2c)。此外,作者通过筛选400多个单细胞克隆,筛选Pum1/2双敲除的HCT116细胞,但未能恢复任何双敲除细胞。这一结果提示Pum1/2双敲除可能严重损害HCT116细胞的生存。
分别敲除Pum1 (Pum1−/−)和Pum2发现Pum1和Pum2的缺失显著抑制了HCT116和RKO细胞的集落形成和增殖(Fig. 2d–i)。一致地,Pum1缺乏导致HCT116和RKO细胞G1/S过渡的延迟(Fig. 2j, k)。在异种移植实验中,敲除Pum1能显著抑制小鼠HCT116和RKO细胞的致瘤性(Fig. 2l–q)。Pum2−/−克隆显示类似的表型,但在HCT116细胞中不那么严重(Fig. 2d–q)。总之,这些结果表明Pum1和Pum2在体内和体外细胞生长中都对CRC的致瘤性至关重要。
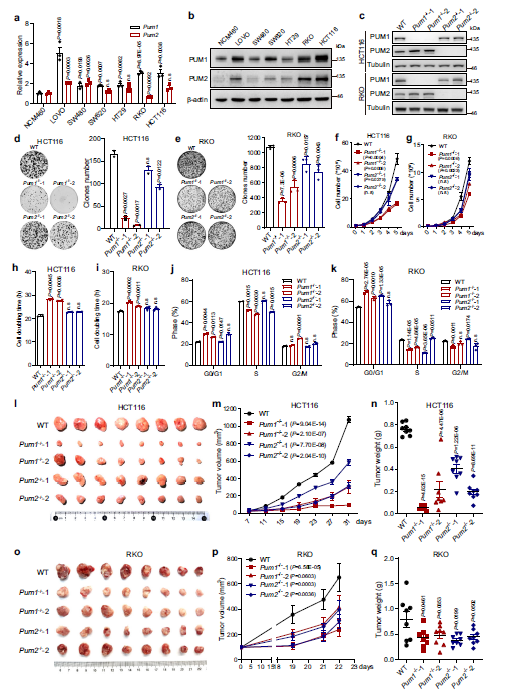
Fig2 PUM1和PUM2促进结直肠癌细胞的体外生长和体内致瘤性
3. PUM1通过直接调控癌相关基因和细胞周期相关基因
为了探索PUM在CRC中的作用的分子机制,作者通过深度测序分析了Pum1−/−和Pum2−/−HCT116细胞的转录组(Fig. 3a, b),作者在Pum1和Pum2敲除细胞中分别鉴定出1132个和1226个差异表达基因。在Pum1−/−细胞,740个基因mRNA水平升高,392个基因mRNA水平降低。其中,Cdkn1a/p21、Cdkn2d、Cdkn2c等细胞周期抑制基因表达上调(Fig. 3a)。此外,Ccnd3、Tgfb1在Pum2−/−细胞中上,调但在Pum1−/−细胞中未见明显上调(Fig. 3b)。
由于PUM蛋白主要在转录后水平调控其靶标,作者预计其靶标在蛋白质水平也会发生变化。因此,作者使用TMT标记的蛋白质组学方法来识别野生型、Pum1−/−和Pum2−/−HCT116细胞之间的蛋白质变化(Fig. 3c, d)。在Pum1−/−HCT116细胞中,细胞周期抑制基因Cdkn1a/p21的mRNA和蛋白水平上调。这表明在CRC中,PUM1可能抑制p21的翻译。在Pum2−/−HCT116细胞中,Wnt信号抑制剂Dkk1和肿瘤抑制基因Susd2和Pdlim5的蛋白水平也上调,表明Wnt通路的参与。Pum1和Pum2敲除后基因表达在mRNA和蛋白水平上的变化相关性为0.695((Fig. 3e,f)。这说明蛋白质水平的变化在很大程度上是由mRNA水平的变化引起的。此外,Pum1−/−和Pum2−/−细胞的基因表达变化相当相似,在mRNA和蛋白质水平上相关性为0.782和0.708(Fig. 3g,h)。总的来说,Pum1敲除的mRNA丰度变化略大于Pum2敲除。平均而言, Pum1−/−细胞比Pum2−/−细胞显示出更大程度的折叠变化(Fig. 3i–l),与Pum1−/−和的致瘤性缺陷一致在Pum2−/−HCT116细胞中,PUM蛋白可能通过调节肿瘤相关基因的表达来促进结直肠癌的生长。
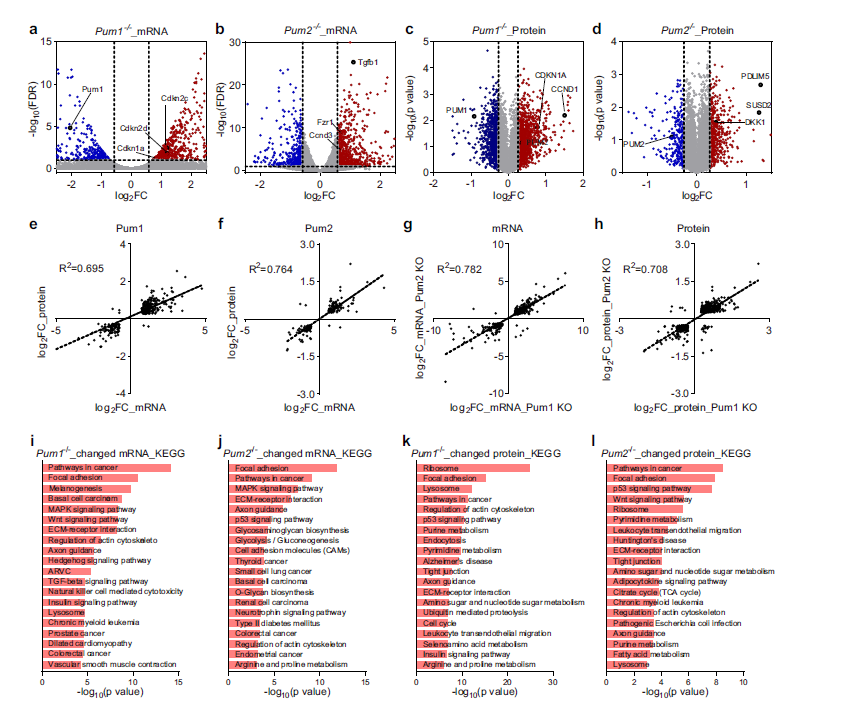
Fig3癌症相关基因在Pum1−/−HCT116细胞受影响的基因中富集
分析发现2228和1961簇是两个野生型的PUM1结合位点,这些簇显示出PUM1结合转录本有很大重叠(Fig. 4a)。而结合位点显示了保守的TGTANATA结合基序(Fig. 4b)。该motif主要存在于mRNA的3' UTR中,第二个丰富的区域是CDS (Fig. 4c)。PAR-CLIP识别的靶点用qPCR进行验证(Fig. 4d,e)。考虑到在Pum1-缺陷细胞中观察到的G1/S过渡延迟,作者主要关注与G1进程有关的基因,并发现在Pum1-/- HCT116,p21/Cdkn1a细胞中上调的基因在PUM1 PAR-CLIP中富集 (Fig. 4f)。此外,细胞周期和肿瘤通路如ErbB信号通路、p53信号通路和CRC通路也在Pum1的直接靶点中富集(Fig. 4g)。
分析了1968个在Pum1−/−HCT116细胞中表达发生变化的蛋白。其中15个mRNA和48个蛋白被鉴定为PUM1的靶点(Fig. 4h–k)。对其进行KEGG分析,结果显示它们在细胞周期和癌症通路等中富集(Fig. 4l, m)。RT-qPCR检测Pum1−/−HCT116细胞中17个mRNA的变化。这些结果表明PUM1是CRC细胞生长所必需的,主要是通过直接调控与癌症相关和细胞周期相关的基因。

Fig4 PAR-CLIP-seq鉴定PUM1的靶基因
5. PUM1直接抑制p21调节CRC的生长
RNA深度测序和蛋白质谱分析显示,p21在RNA和蛋白水平上都受到PUM1的抑制。作者通过RT-Qpcr和WB进一步证实了这一结果,在Pum1−/−细胞中,p21的RNA和蛋白水平升高(Fig. 5a, b)。然而,Pum2−/−中p21 RNA和蛋白质水平的增加,没有在Pum1−/−细胞中显著表达(在转染siPum1和/或siPum2的HCT116细胞中观察到类似的现象,数据未显示),与此一致,RIP实验表明,p21 mRNA与PUM1结合较强(富集7.4倍),而与PUM2结合较弱(富集1.9倍) (Fig 5c, d)。因此,作者专注于对p21的PUM1调控。
为了检测PUM1是否负向调控p21 mRNA的稳定性,作者用放线菌素抑制转录,然后检测HCT116细胞的mRNA水平(Fig. 5e)。发现p21 mRNA的稳定性在Pum1−/−HCT116细胞中增加,但在Pum2−/−HCT116细胞中不显著。这些结果表明,PUM1通过负向调控p21 mRNA的稳定性来抑制p21,而PUM2对p21 mRNA的稳定性影响不大。
考虑到PUM1对p21的抑制以及p21可能参与CRC,作者研究了PUM1的缺失是否会通过直接上调p21的表达来减少细胞增殖并延迟G1-S的转移。作者通过敲入HCT116细胞基因组中一个突变的PRE供体序列,使p21基因中的PRE发生突变(Fig. 5f)。DNA测序结果显示p21 PRE的生成(Fig. 5g)。如预期的那样,p21 PRE突变减少了PUM1与p21 mRNA的结合(Fig. 5h), 导致p21 mRNA和蛋白表达增加(Fig. 5i, j)。这些结果表明,p21 PREmut/mut可以抑制PUM1对p21mRNA的抑制。接下来作者分析了p21 PREmut/mut细胞的细胞生长和细胞周期。与预期一样,p21 PREmut/mut细胞的集落形成减少,细胞增殖减少(Fig. 5k–n),G0/G1期细胞比例增加(Fig. 5o)。这些结果表明,p21 mRNA是PUM1促进CRC细胞生长的直接和主要靶点。
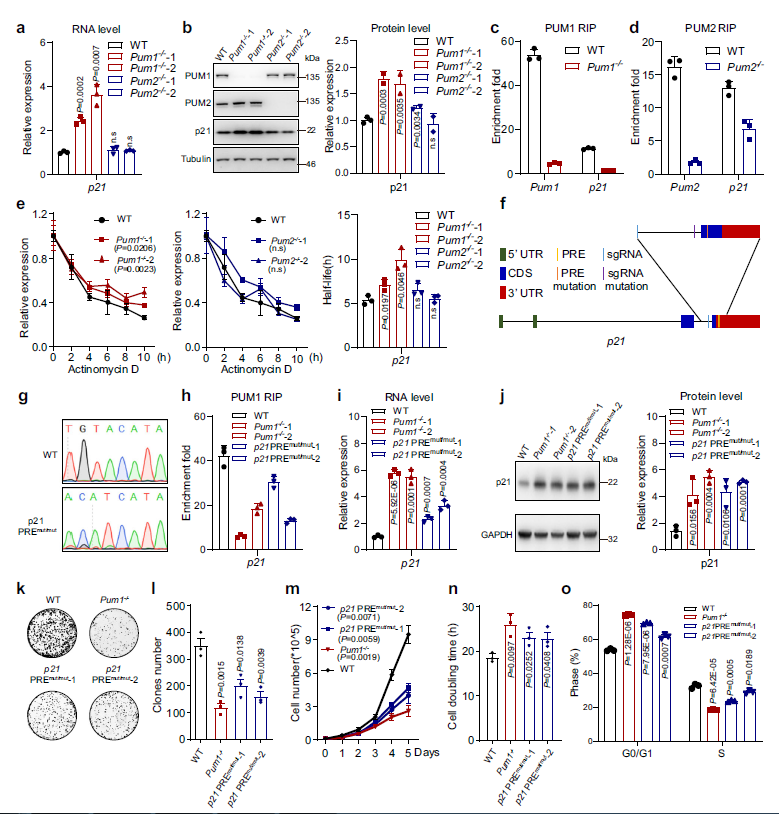
Fig5 PUM1通过直接抑制p21调控CRC的生长
6. 纳米颗粒包裹的PUM siRNA部分抑制CRC的发展
为了探索将PUM1和PUM2作为抗癌治疗靶点的可能性,作者利用原位结肠癌模型进一步研究了装载siRNA的纳米颗粒的体内抗肿瘤活性(Fig. 6a)。通过IVIS光谱观察到siRNA负载的纳米颗粒通过增强的渗透性和保留(EPR)效应,靶向肿瘤60CT多模态成像系统(Fig. 6b)。作者将HCT116和COLO205肿瘤细胞植入4周龄雄性BALB/c裸鼠皮下。植入后28天,小鼠的肿瘤生物发光强度相当。这些小鼠每三天通过静脉注射四次纳米颗粒制剂(Fig. 6c)。每周用生物发光成像监测肿瘤生长情况(Fig. 6d, h)。对于HCT116肿瘤模型,非特异性siRNA对照(siNC@MSN)不能延缓肿瘤的生长。相反,注射含有抗PUM1的siRNA (siPum1@MSN)或抗PUM2的siRNA (siPum2@MSN)的纳米颗粒则能显著抑制肿瘤的生长。尤其是同时使用抗PUM1和抗PUM2 siRNA的小鼠(siPum1/2@MSN)表现出最强的抗肿瘤作用(Fig. 6e)。实验结束时(第30天),处死小鼠,切除肿瘤并称重。使用siPum1/2@MSN的小鼠的肿瘤比对照组小3.7-4.0倍(Fig. 6f)。肿瘤重量的减少不是由于明显的毒性,因为在治疗期间,所有组的体重都有相似的增加(Fig. 6g)。此外,si PUM1,2@MSN组在所有被检查的器官中均未发现转移,表现出最佳的抗转移效果。在COLO205小鼠模型中也有类似的抗肿瘤作用(Fig. 6i–k)。综上所述,这些数据表明,PUM1/2是治疗CRC的潜在靶点,纳米颗粒递送PUM1或/和PUM2 siRNA可阻止其进一步生长。

Fig6在携带HCT116或COLO205结直肠肿瘤的小鼠中使用sirna负载的MSN进行体内治疗
总之, Pum1和Pum2在体内和体外细胞生长中都对CRC的致瘤性至关重要,PUM1和PUM2在人类CRC中表达增加, PUM蛋白可能通过调节肿瘤相关基因的表达来促进结直肠癌的生长。PUM1和PUM2可作为CRC治疗的靶点。
参考文献:
Gong, Y., et al., PUMILIO proteins promote colorectal cancer growth via suppressing p21. Nat Commun, 2022. 13(1): p. 1627.






