小鼠间充质干细胞源性外泌体miR-466f-3p参与放射性肺损伤的EMT过程
放射性肺纤维化(RILF)是胸部放疗的常见并发症。肺泡上皮细胞通过上皮-间质转化(EMT)在肺纤维化中发挥关键作用。来源于间充质干细胞的外泌体具有修复和再生受损组织的特性,但其潜在机制尚不清楚。我们的研究结果表明,来自于mMSCs的外泌体miR-466f-3p可能具有抗纤维化特性,并通过c-MET抑制AKT/GSK3β来防止放疗诱导的EMT,为放疗诱导的肺纤维化提供了一种有前途的治疗方式。本文于2022年4月发表于“Journal of Experimental & Clinical Cancer Research”(IF=11.161)上。
技术路线

结果
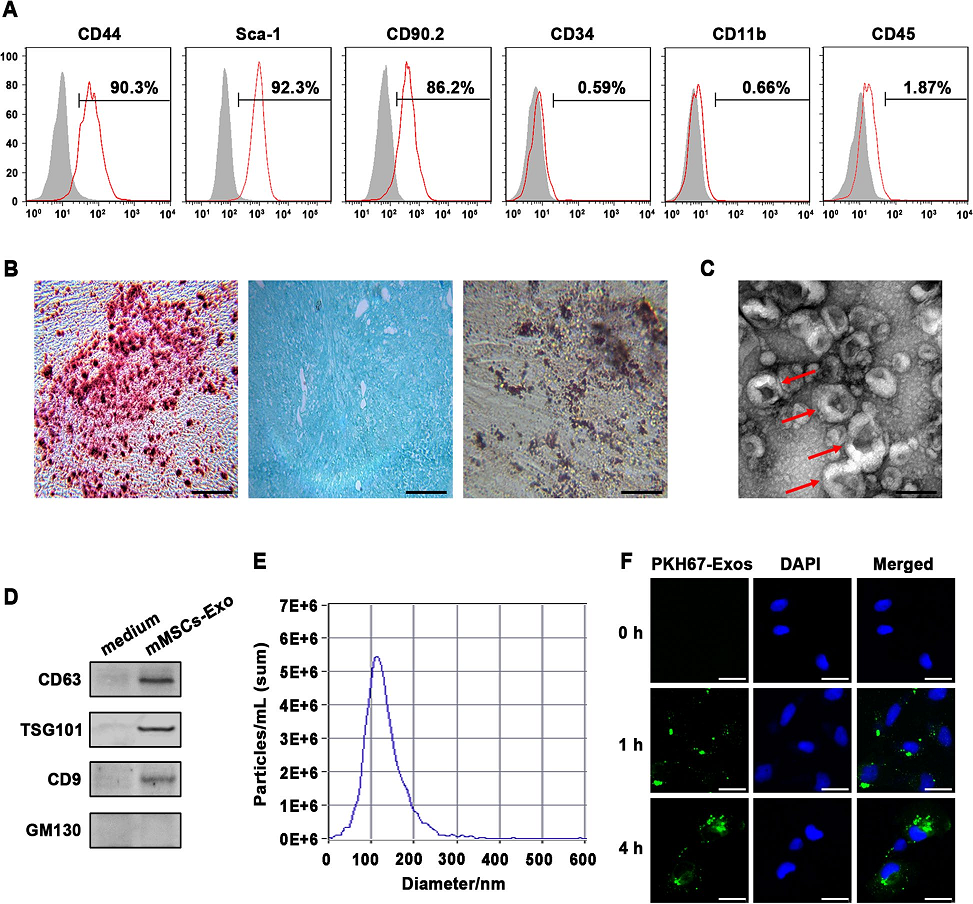
1)小鼠间充质干细胞及其外泌体的特征
培养3周后,通过流式细胞术分析从骨髓中纯化的小鼠间充质干细胞(mMSCs),其典型的MSC标志物CD44、CD90.2和Sca-1阳性表达。而造血标志物如CD34、CD11b和CD45呈阴性(图1A)。在适当的诱导培养基下,分离的mMSCs表现出向骨细胞、脂肪细胞和软骨细胞的分化能力(图1B)。然后,通过标准超离心从条件培养基中分离出外泌体,分别用TEM、纳米颗粒跟踪分析和Western blot方法进行鉴定。如图1C-E所示,典型的外泌体呈圆形形态,大小为90 ~ 150 nm,阳性表达常见的外泌体标志物CD63、TSG101和CD9。而胞内蛋白GM130在外泌体中缺失。随后,为了评估来自于mMSCs的外泌体是否被受体细胞吸收,将PKH67标记的mMSCs-exos与小鼠肺泡上皮细胞MLE-12共培养。我们通过共聚焦显微镜观察发现,PKH67信号在MLE-12细胞质中以时间依赖的方式不断积累,在孵育4小时后达到最大值(图1F)。
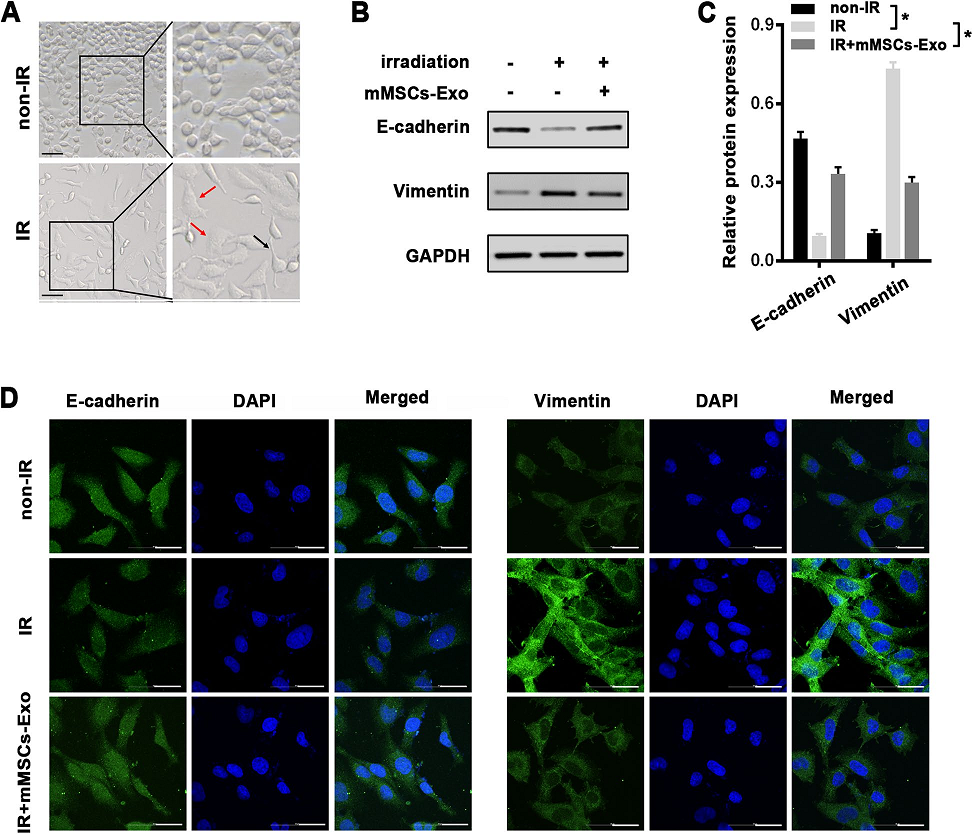
2)mMSCs-Exos可在体外防止放疗诱导的肺泡EMT
在放疗作用下,肺泡上皮细胞发生了EMT过程,这被认为是RILI发病的重要机制。如预期的那样,单剂量8 Gy照射的MLE-12细胞出现了明显的形态变化,照射48 h后,大多数细胞从典型的上皮细胞转变为具有延伸伪足的细长间充质样外观(图2A)。为了探究mMSCs-Exos在放疗诱导的EMT中的作用,我们在MLE-12细胞在放疗前用mMSCs-Exos预处理4 h,48 h后用western blot方法分析EMT相关标记物。与放疗诱导的形态学变化相一致的是,与对照组细胞相比,放疗后的MLE-12细胞上皮标记物(E-cadherin)明显减少,间充质标记物(Vimentin)表达增强,证实了EMT形态的变化(图2B, C)。预处理后的mMSCs-Exos明显逆转了放疗诱导的EMT(图2B, C)。此外,上述EMT相关蛋白的变化通过免疫荧光进一步鉴定(图2D)。
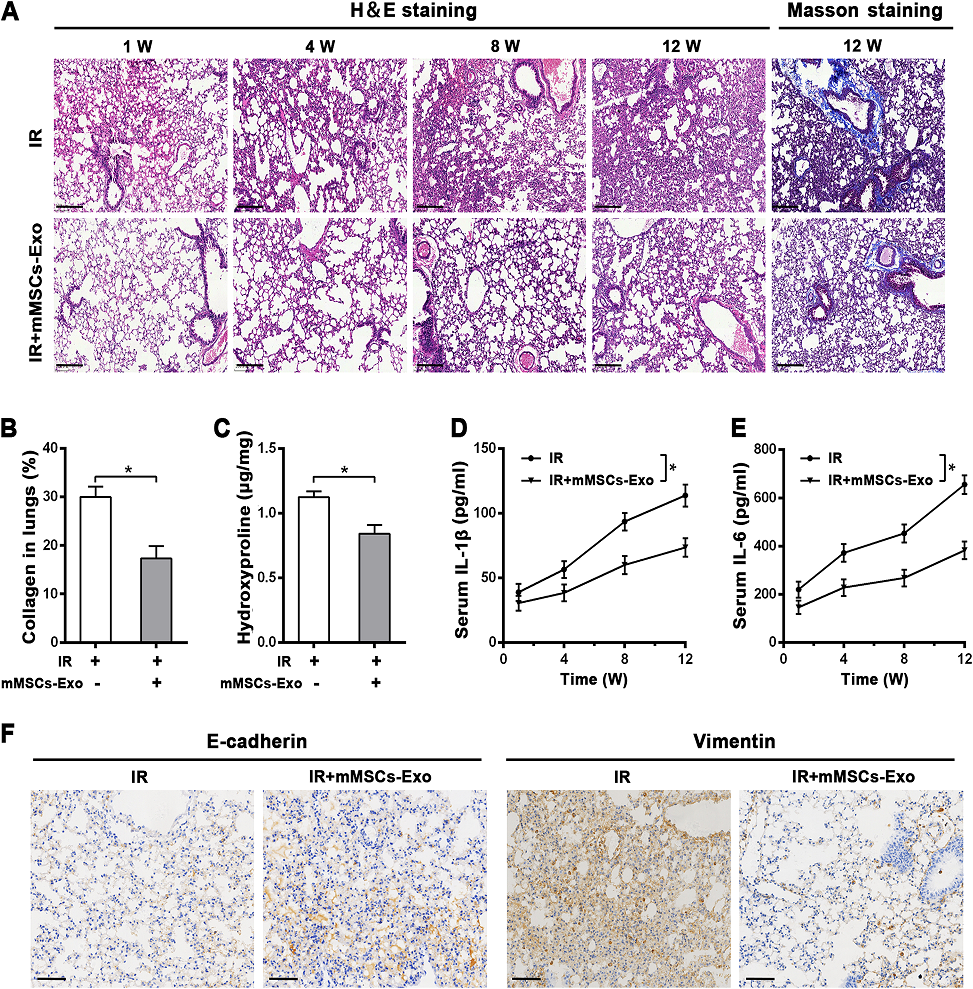
3)mMSCs-exos可在体内防止放疗诱导的肺损伤
为了研究其体内细胞保护作用,我们建立了单剂量14 Gy全胸注射的小鼠RILI模型。治疗组小鼠在放疗前2 h静脉注射mMSCs-Exos。有趣的是,H&E染色显示,在1周、4周、8周和12周时,给予mMSCs-Exos明显减轻了放疗所致的肺损伤,其中肺泡间隔增厚、间质水肿、炎症细胞浸润等病理损伤明显减轻。肺泡完整性优于单纯放疗组(图3A)。值得注意的是,Masson染色进一步显示,在放疗12周后,胶原蛋白广泛沉积,尤其是在血管周围,而mMSCs-Exos降低了沉积(图3A, B)。与Masson染色一致,在12周时,mMSCs-Exos也减弱了放疗诱导的肺组织中羟脯氨酸含量的增加(图3C)。此外,我们通过ELISA检测炎症细胞因子。数据显示,虽然IL-1β和IL-6的分泌和释放在放疗12周后显著增加,但与单纯放疗组相比,使用mMSCs-Exos显著抑制了它们的水平(图3D, E)。此外,免疫组化数据显示,在放疗12周后,mMSCs-Exos导致EMT相关蛋白明显变化,与单纯放疗组相比,E-cadherin表达增加,Vimentin表达减少(图3F)。
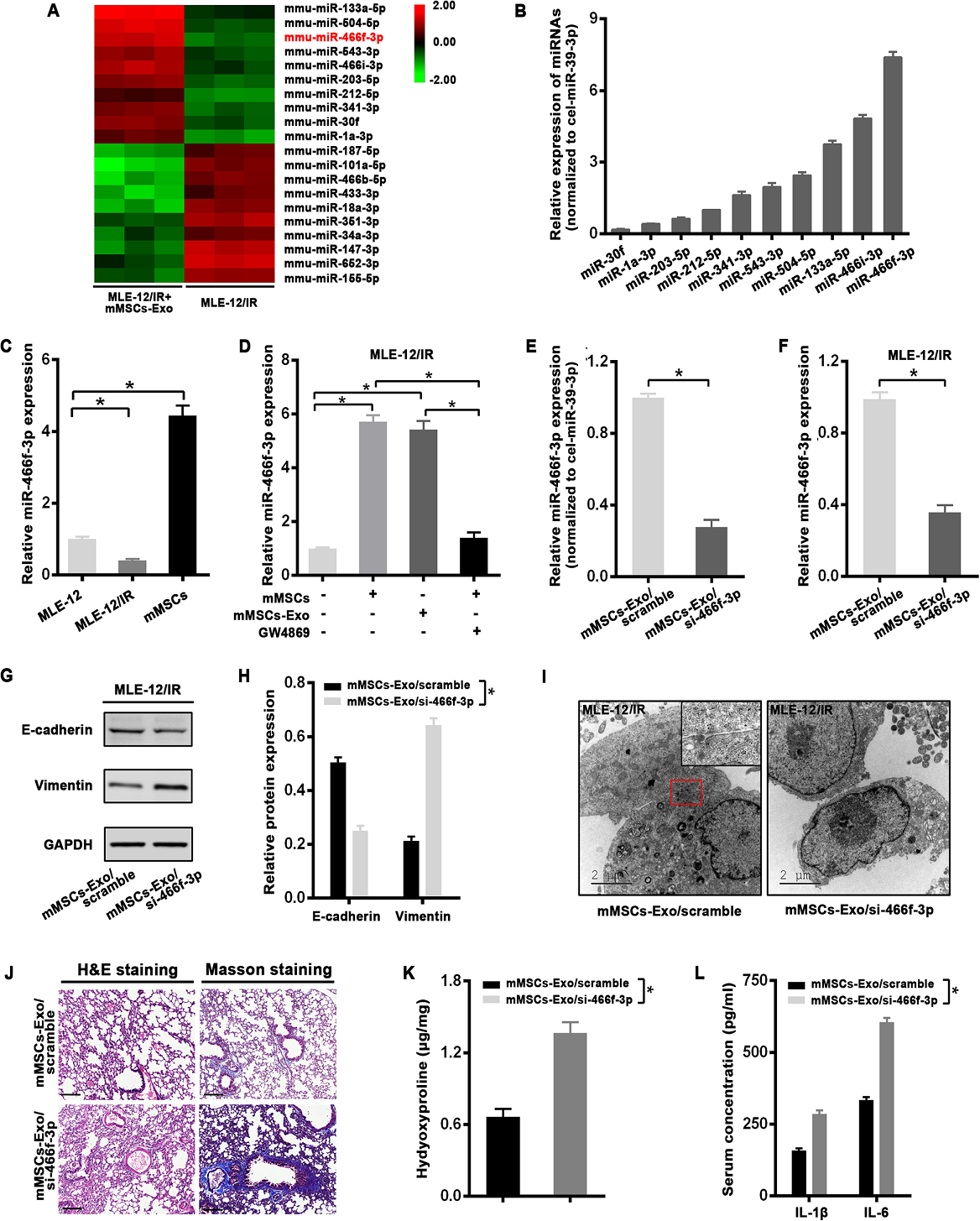
4)来自mMSCs的外泌体mmu-miR-466f-3p可逆转放疗诱导的EMT和肺损伤
鉴于miRNAs的穿梭被认为是外泌体的重要功能,我们进行了miRNA微阵列来筛选对IR的保护作用所需的miRNA。与只接受放疗的细胞相比,在与mMSC-Exos共培养的MLE-12细胞中观察到miRNA显著增加(图4A)。在前10个上调的miRNAs中,mmu-miR-466f-3p (miR-466f-3p)在mMSCs-Exos中表达最丰富(图4B)。mMSCs中miR-466f-3p的水平高于MLE-12细胞,在放疗后的MLE-12细胞中miR-466f-3p的水平显著下调(图4C)。特别地,用mMSCs或mMSCs- exos处理后,miR-466f-3p在放疗的MLE12细胞中的表达显著增加。然而,这种趋势被外泌体抑制剂GW4869所削弱(图4D)。此外,为了阐明外泌体miR-466f-3p在放疗诱导的EMT中的作用,将miR-466f-3p抑制剂引入到mMSCs中,与scramble转染的mMSCs外泌体(mMSCs-exo/scramble)相比,在mMSCs来源的外泌体(mMSCs-exo/ si-466f-3p)中miR-466f-3p的表达下降(图4E)。正如预期的那样,miR-466f-3p在scrambled外泌体处理的放疗的MLE-12细胞中的水平高于mMSCs-exo/si-466f-3p处理的细胞(图4F)。有趣的是,与scrambled外泌体处理的放疗的MLE-12细胞相比,使用抑制miR-466f-3p的外泌体(mMSCs-exo/si-466f-3p)显著降低了E-cadherin的表达,并提高了波形蛋白(图4G, H)。此外,通过透射电镜(TEM)显示,与scrambled外泌体共孵育的放疗细胞仍保持了一些上皮特性,如黏附连接,而miR-466f-3p抑制外泌体处理使细胞保持分散模式,没有功能连接(图4I)。随后,我们检测了外泌体miR-466f-3p在RILI小鼠模型中的预防作用。放疗8周后,H&E和Masson染色显示,miR-466f-3p抑制外泌体小鼠的病理性肺损伤更为严重,胶原沉积更多(图4J)。羟脯氨酸评估显示,在放疗8周后,scrambled外泌体诱导肺组织中含量明显减少,而miR-466f-3p抑制外泌体处理小鼠的肺中含量显著增加(图4K)。此外,miR-466f-3p抑制也导致IL-1β和IL-6水平升高(图4L)。
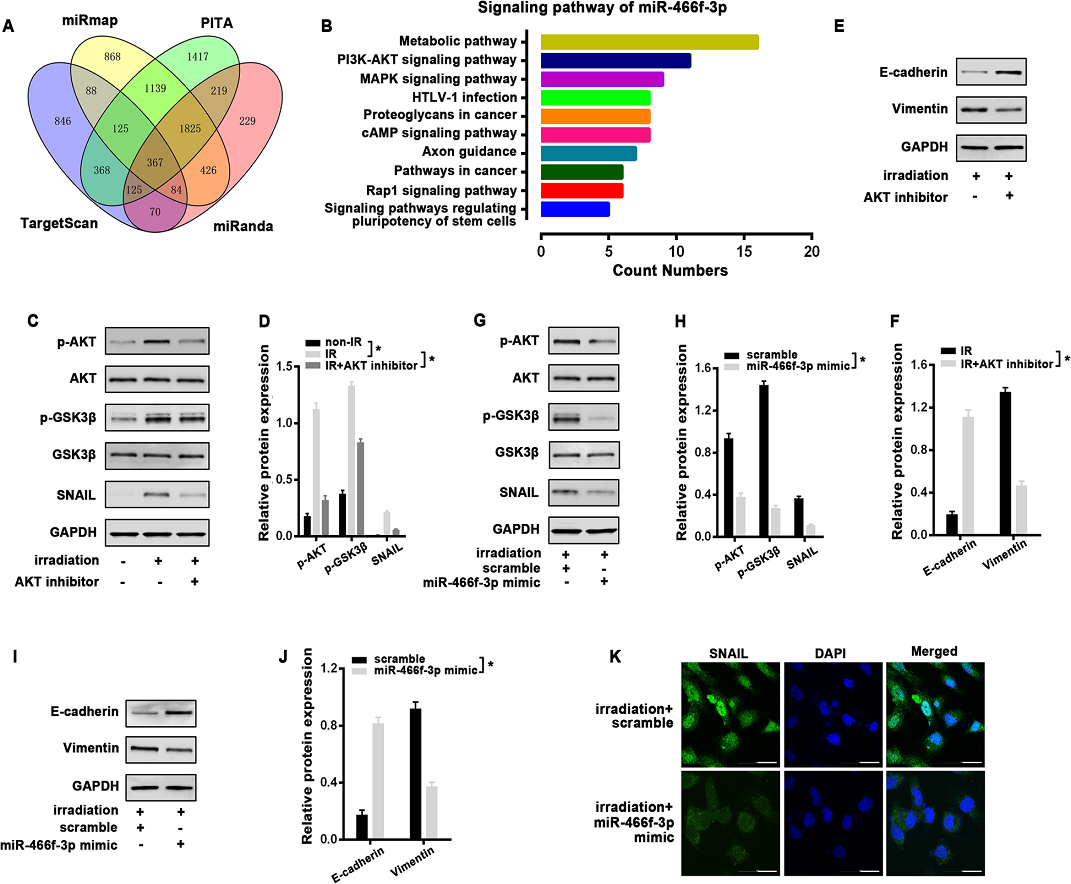
5)miR-466f-3p依赖的AKT/GSK3β通路对放疗诱导的EMT至关重要
为了更好地阐明miR-466f-3p调控的EMT的分子机制,我们在Targetscan、miRmap、PITA和miRanda等公开数据库中预测了miR466f-3p可能的靶点。367个重叠基因随后被KEGG分析注释(图5A)。有趣的是,PI3K/AKT通路(KEGG mmu04151)是前10个富集之一,与EMT的诱导有关(图5B)。根据之前的文献,我们首先研究了MLE-12细胞中AKT和GSK3β对放疗的响应。Western blot分析显示,单剂量8 Gy照射1小时后,AKT在丝氨酸473位点明显磷酸化(p-AKT),同时丝氨酸9位点磷酸化GSK3β (p-GSK3β)增加,SNAIL相应增加(图5C, D)。我们在放疗前用AKT抑制剂LY294002预处理MLE-12细胞2小时。当AKT信号被阻断时,放疗诱导的GSK-3β的抑制被释放,这与SNAIL的下调有关(图5 C,D)。AKT抑制剂也可以通过调节放疗48 h 后E-cadherin和Vimentin的蛋白水平有效逆转放疗诱导的EMT(图5 E,F)。根据上述结果,我们检测了miR-466f-3p和AKT/GSK3β通路之间的潜在关系。与对照组相比,在MLE-12细胞中过表达miR466f-3p显著降低了放疗后p-AKT和p-GSK3β的强信号,同时Snail蛋白减少。而总AKT和GSK3β水平不受影响(图5G,H)。此外,miR-466f-3p mimic通过恢复E-cadherin的表达明显减弱放疗诱导的MLE-12细胞EMT,而明显抑制Vimentin的蛋白水平(图5I,J)。免疫荧光也显示,与对照相比,miR-466f-3p mimic同时逆转了放疗诱导的Snail核积累(图5K)。
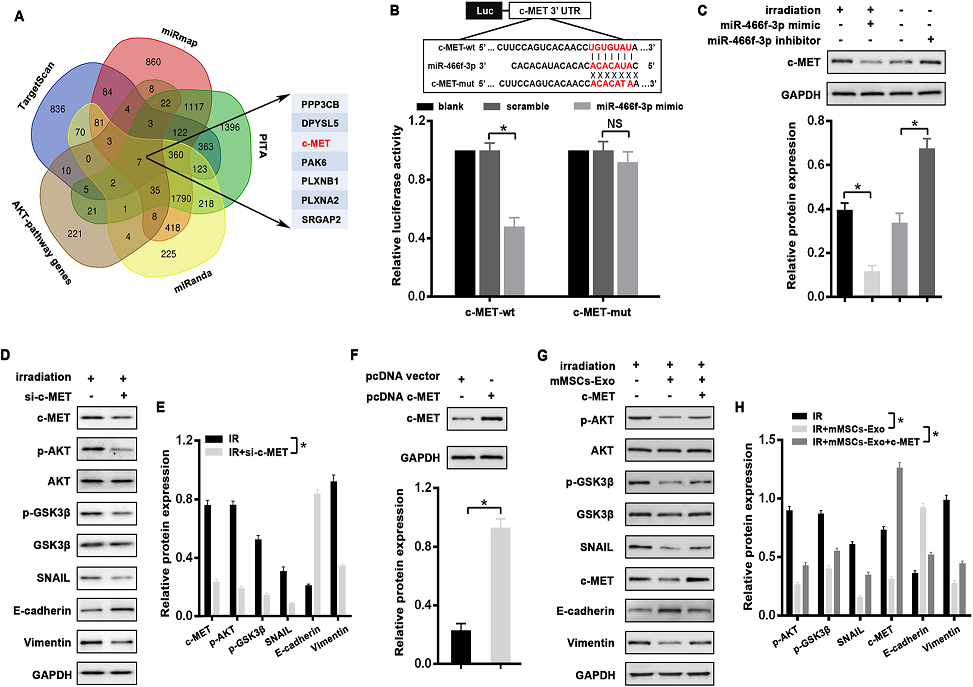
6)C-MET是miR-466f-3p的直接靶点,通过AKT/GSK3β通路消除放疗诱导的EMT
为了确定miR-466f-3p的关键靶点,上述预测基因与PI3K-AKT通路存在重叠。在候选基因中,我们关注的是c-MET(图6A),其在肺纤维化中的作用已被证实。首先,通过荧光素酶实验验证miR-466f-3p与c-MET之间的直接相互作用。我们发现miR466f-3p模拟物显著抑制了c-MET野生型3'UTR报告基因的荧光素酶活性,而当载体含有c-MET突变型3'UTR时,这种抑制作用显著消失(图6B)。此外,与NC对照相比,转染miR-466f-3p mimic显著降低了放疗的MLE-12细胞中c-MET蛋白的表达,而抑制miR-466f-3p的MLE-12细胞中c-MET的表达增加(图6C)。此外,通过siRNA敲除c-MET可以显著抑制放疗诱导的AKT和GSK3β的磷酸化,从而逆转放疗的MLE-12细胞的EMT表型(图6D,E)。为了进一步支持c-MET在mMSCs-exoos介导的EMT过程中的作用,我们将一个缺乏3’UTR的c-MET表达载体(pcDNA c-MET)转染到MLE-12细胞中,与对照组相比,鉴定了其异位表达(图6F)。如预期的那样,过表达c-MET可减弱mMSCs-Exos处理的MLE-12细胞中放疗诱导的变化,包括p-AKT、p-GSK3β、SNAIL和EMT标记物E-cadherin和Vimentin (图6G,H)。
结论:我们证明了mMSCs-Exos在体内和体外均能减轻放疗诱导的肺损伤。特别是,外泌体miR-466f-3p从mMSCs转移到放疗损伤的MLE-12细胞靶向c-MET,从而下调AKT/GSK3β信号通路,从而抑制放疗诱导的EMT。对mMSCs-Exos在放疗诱导的肺损伤中的作用的了解可能会改善我们开发预防方法的前景。
参考文献:
Li Y, Shen Z, Jiang X, Wang Y, Yang Z, Mao Y, Wu Z, Li G, Chen H. Mouse mesenchymal stem cell-derived exosomal miR-466f-3p reverses EMT process through inhibiting AKT/GSK3β pathway via c-MET in radiation-induced lung injury. J Exp Clin Cancer Res. 2022 Apr 7;41(1):128. doi: 10.1186/s13046-022-02351-z.






