DNMT1-PAS1-PH20轴驱动乳腺癌生长和转移
PH20是人类透明质酸酶家族的成员,可降解细胞外基质中的透明质酸并控制肿瘤进展。抑制DNA甲基转移酶(DNMTs)导致透明质酸水平升高。然而,DNMT抑制剂是否能控制PH20仍不清楚。在这里,我们报道DNMT1抑制剂地西他滨通过激活lncRNA PHACTR2-AS1 (PAS1)来抑制PH20的表达。PAS1与RNA结合蛋白vigilin和组蛋白甲基转移酶SUV39H1形成一个三部复合体。PAS1与vigilin的相互作用维持了PAS1的稳定性。同时,PAS1招募SUV39H1触发PH20的H3K9甲基化,导致其沉默。在功能上,PAS1通过抑制PH20,至少部分抑制乳腺癌的生长和转移。地西他滨与直接结合SUV39H1的PAS1-30nt-RNA联合治疗可有效阻断小鼠乳腺癌生长和转移。总之,DNMT1、PAS1和PH20组成了一个控制乳腺癌生长和转移的调控轴。这些发现表明DNMT1-PAS1-PH20轴是乳腺癌潜在的治疗靶点。本文于2022年3月发表于Signal Transduction and Targeted Therapy(IF= 18.187)上。
技术路线

结果
1)DNMT1是调控PAS1的关键基因
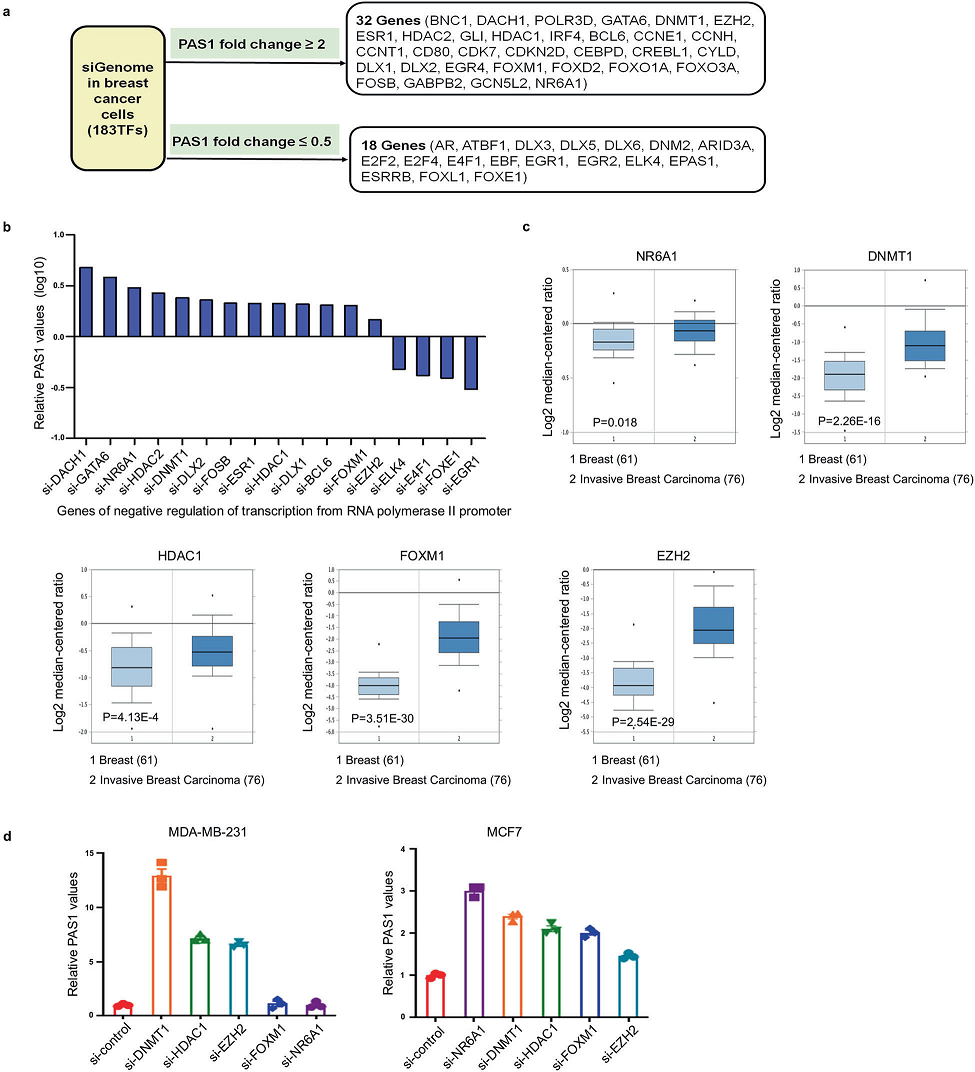
为了了解PAS1的转录调控,将靶向183个转录因子的siRNAs转染到MCF7细胞中,通过RT-PCR检测PAS1的倍数变化。我们发现,32个TF siRNA导致PAS1的激活,而18个TF siRNA导致PAS1的抑制(图1a)。鉴于PAS1在乳腺癌中的抑制作用,我们重点研究了17个参与RNA聚合酶II启动子转录负调控的基因。在这些基因中,发现13个siRNA上调PAS1,这13个基因可以抑制PAS1的转录(图1b)。此外,oncomine数据集分析显示,乳腺癌组织中13个基因中有5个基因的mRNA表达高于正常乳腺组织,包括NR6A1、DNMT1、HDAC1、FOXM1和EZH2(图1c)。我们通过RT-qPCR验证了它们在乳腺癌细胞株中的mRNA水平,发现DNMT1基因下调后PAS1明显上调(图1d)。因此,我们认为DNMT1是调控PAS1的关键基因。
2)DNMT1抑制PAS1的表达
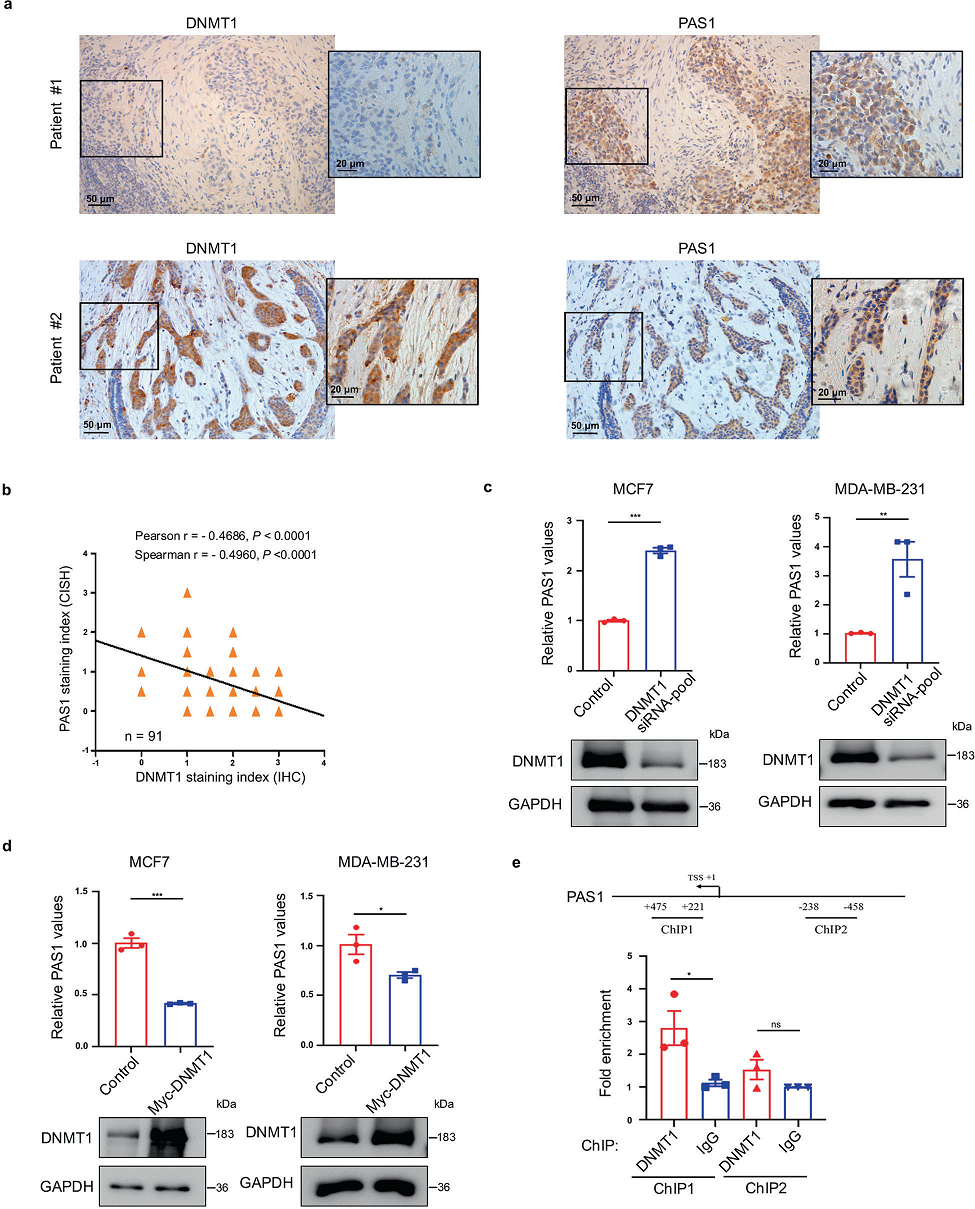
为了探讨DNMT1与PAS1表达的关系,我们首先通过RNA原位杂交检测PAS1 RNA水平,并通过免疫组化染色检测人乳腺癌组织阵列DNMT1蛋白水平。DNMT1的表达与PAS1的表达呈负相关(图2a, b)。为了验证DNMT1对PAS1的调控作用,我们检测了DNMT1敲低或过表达时PAS1的水平。DNMT1敲低导致PAS1表达上调(图2c),而DNMT1过表达导致PAS1 RNA水平降低(图2d)。为了进一步了解DNMT1对PAS1的调控作用,我们观察了DNMT1在PAS1启动子上的占据情况,发现DNMT1可以与PAS1启动子结合(图2e)。综上所述, PAS1的转录受到DNMT1的负调控。
3)Vigilin通过与PAS1相互作用增强PAS1的稳定性
为了确定PAS1的相互作用体,我们采用RNA拉下结合质谱的方法。发现了四种候选蛋白,包括vigilin,matrin-3,SFPQ和hnRPQ(图3a)。为了验证这些候选蛋白,我们进行了RNA pull-down结合western blot分析。结果显示,最明显和特异性的PAS1互作蛋白是vigilin (图3b)。然后,我们构建了三个PAS1截断突变体,发现从1301到2134的核苷酸C末端足以与vigilin结合(图3c)。然后使用RIP在体内检测PAS1和vigilin之间的相互作用。如预期的那样,抗vigilin抗体在MCF7细胞中沉淀内源性PAS1(图3d)。此外,我们通过RNA FISH和免疫荧光染色观察到PAS1和vigilin在Hs578T细胞的细胞核和细胞质中共定位(图3e)。鉴于vigilin在维持mRNA稳定性方面的作用,我们推测vigilin影响PAS1的稳定性。为了证实这一点,我们首先检测了vigilin对PAS1水平的影响,发现vigilin的过表达导致了细胞核和细胞质中PAS1的增加(图3f)。然后用转录抑制剂ActD处理Hs578T细胞,检测PAS1的半衰期。结果表明,PAS1在对照细胞中的半衰期约为4 h。vigilin过表达后,PAS1的半衰期延长至8 h(图3g)。这些数据表明,PAS1与vigilin相互作用,维持其稳定性。

4)PAS1下调PH20的表达
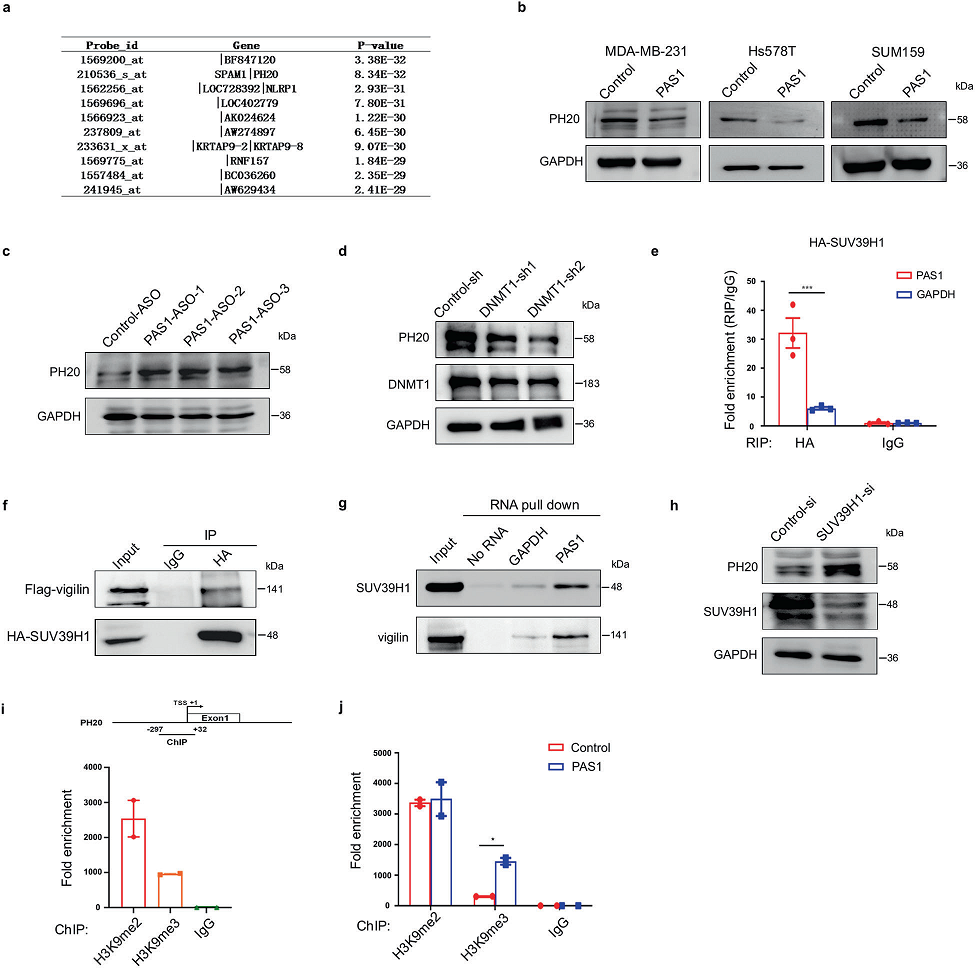
为了探索PAS1的靶基因,我们对PAS1进行了共表达分析。我们从GEO数据集中下载了100个包含PAS1 Affy-probe的基因表达谱。P值最小的前10个基因如图4a所示。在这10个基因中,SPAM1(又称PH-20)具有水解酶活性。PH20的异常表达已在多种癌症中被发现,并与癌症转移有关。因此,我们选择PH20作为PAS1的候选靶点。我们首先估计了有或没有PAS1过表达的PH20水平。结果表明,过表达PAS1抑制了PH20的表达(图4b)。而PAS1敲除恢复了PH20的表达,表明PAS1对PH20的负调控(图4c)。考虑到DNMT1对PAS1的抑制作用,我们进一步估计DNMT1对PH20水平的影响。DNMT1敲低导致PH20表达下降(图4d)。
由于PAS1直接与组蛋白甲基转移酶SUV39H1结合,而组蛋白甲基转移酶SUV39H1也与vigilin相互作用,这三个分子可能形成复合物。为了测试这个想法,我们进行了RIP和Co-IP检测,发现SUV39H1可以免疫沉淀PAS1和vigilin (图4 e, f)。接下来,RNA下拉显示生物素标记的PAS1 RNA可以同时与SUV39H1和vigilin结合(图4 g)。由于SUV39H1催化的H3K9二甲基化和三甲基化(H3K9me2和H3K9me3)介导基因沉默,SUV39H1可能参与抑制PAS1对PH20的作用。事实上,SUV39H1基因敲除增强了PH20的表达(图4h)。H3K9me2和H3K9me3都富集在PH20启动子中(图4i)。PAS1的过表达显著促进了H3K9me3的占据(图4j),提示H3K9me3参与了PAS1对PH20的抑制。这些数据表明,PAS1通过与SUV39H1相互作用,促进了H3K9me3在PH20启动子上的占据,导致了PH20的抑制。
5)PAS1通过PH20部分抑制乳腺癌细胞生长和转移
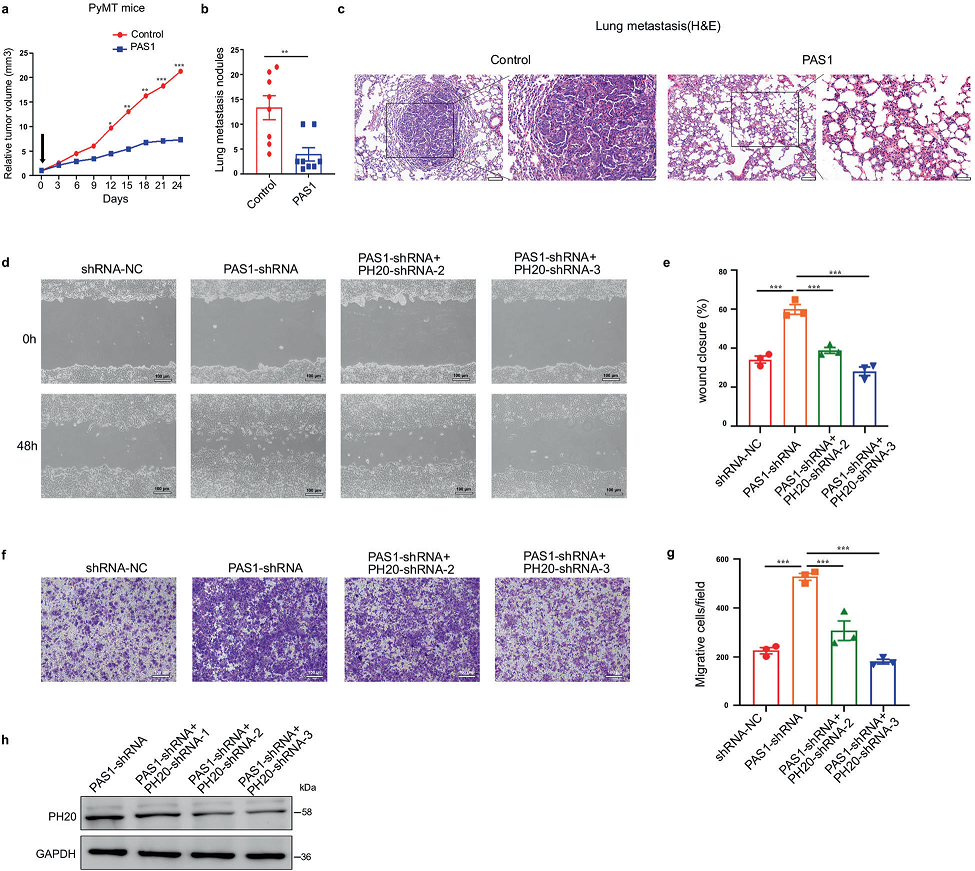
携带PAS1的慢病毒降低了患有多发性肿瘤的PyMT小鼠的肿瘤体积,并减少了肺转移结节的数量(图5a, b)。通过组织学染色证实了肺转移(图5c)。接下来,通过伤口愈合和细胞迁移实验证实了PAS1抑制癌细胞迁移的作用。抑制PAS1可促进乳腺癌细胞迁移。但同时敲除PH20后,创面愈合速度和细胞迁移速度恢复到对照组细胞的水平(图5d-h),说明PH20参与了PAS1对癌细胞迁移的抑制。
6)PAS1-30nt-RNA和DNMT抑制剂的联合抑制乳腺癌生长和转移
DNMT是很有前途的治疗靶点,一些DNMT抑制剂,如地西他滨,已被用于治疗癌症。基于上述DNMT1敲除对PAS1和PH20的影响,我们评估了地西他滨在乳腺癌细胞中的作用。一致地,地西他滨可导致PAS1水平升高,PH20水平降低(图6a, b)。一些研究已经证实,DNMT抑制剂与其他药物联合使用似乎比单一药物更有效。PAS1-30nt-RNA是一个合成的PAS1片段,用于体内RNA传递。因此,我们用异种移植小鼠观察单独地西他滨、单独PAS1-30nt-RNA或联合PAS1-30nt-RNA在体内是否可以抑制肿瘤生长。PAS1-30nt-RNA与地西他滨联合抑制肿瘤生长的效果优于单独地西他滨或单独使用PAS1-30nt-RNA(图6c, d)。接下来,我们观察地西他滨和PAS1-30nt-RNA对转移性小鼠模型的治疗效果。正如预期的那样,联合组的转移信号比单独地西他滨或单独PAS1-30nt-RNA组的转移信号要少(图6e, f)。这些结果提示地西他滨联合PAS1-30ntRNA对抑制乳腺癌生长和转移有一定的治疗价值。
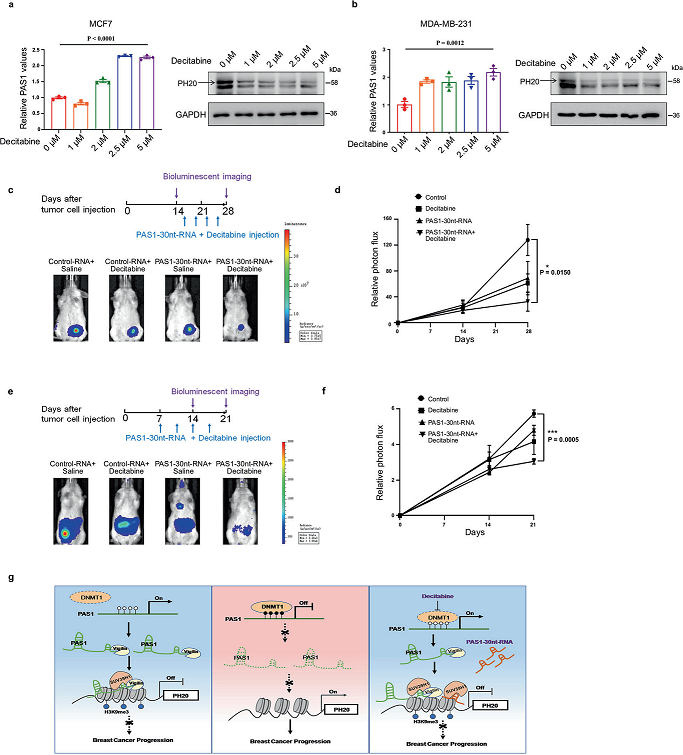
结论:我们报道DNMT1抑制剂通过激活PAS1来控制PH20的表达。DNMT抑制剂地西他滨与PAS1-30nt-RNA联合治疗可有效阻断乳腺肿瘤生长和转移。
参考文献:
Fu Y, Zhang X, Liu X, Wang P, Chu W, Zhao W, Wang Y, Zhou G, Yu Y, Zhang H. The DNMT1-PAS1-PH20 axis drives breast cancer growth and metastasis. Signal Transduct Target Ther. 2022 Mar 21;7(1):81. doi: 10.1038/s41392-022-00896-1. PMID: 35307730; PMCID: PMC8934873.






