激活的SUMOylation限制MHC I类抗原呈递,从而在癌症中实现免疫逃避
SUMOylation激活是癌症的标志。近日,有研究发现活化的SUMOylation (SUMOi)使肿瘤细胞能够逃避抗肿瘤免疫监视:激活的SUMOi通过抑制MHC I类(MHC-I)抗原处理和呈递机制(APM),使癌细胞能够逃避CD8+T细胞介导的免疫监视。该研究扩大了对SUMOi作为一种提高肿瘤免疫治疗疗效的合理治疗策略的认识。研究发表在《Journal of Clinical Investigation》,IF:14.808。
技术路线:

主要研究结果:
1. SUMOi恢复MHC-I抗原加工和传递途径
首先通过流式细胞术筛选了细胞系OCI-Ly1(图1A)。SUMOi处理的细胞显示出显著的MHC-I表达的诱导 (图1,B和C)。基于B2M是MHC-I APM的核心角色,研究发现在OCI-Ly1细胞中敲除B2M导致MHC-I表达显著降低(图1 D和E)。SUMOi处理增加了OCI-Ly1对照细胞的MHC-I表达,但SUMOi处理并不影响OCI-Ly1 B2MKO细胞的MHC-I表达(图1E)。此外,SUMOi处理以剂量依赖性的方式诱导OCI-Ly1、SU-DHL-4和SU-DHL-5细胞的MHC-I表达(图1F),但不影响SU-DHL-6和Toledo细胞的MHC-I表达(图1F)。SUMOi还恢复了被激活的B细胞亚型DLBCL细胞系HBL-1、RIVA和TMD8的MHC-I表达(图1G),显示了SUMOylation抑制MHC-I表达的高度保守功能。与对照细胞相比,抑制SUMOylation可诱导多种APM基因的表达,包括编码免疫蛋白酶体成分(LMP2、LMP7)、与抗原加工相关的肽转运体(TAP1)和MHC-I类分子成分(HLA-A、HLA-B、HLA-C和B2M)(图1H)。
对SUMOi处理的OCI-Ly1和SU-DHL-4 DLBCL细胞系进行了蛋白质组学分析。结果显示,SUMOi对MHC-I/APM通路成员HLA-A、HLA-B、B2M、TAP1、TAP1和TABP的诱导(图2A),且pathway分析进一步证实了这一点(图2B)。
综上所述,确定了激活的SUMOylation在限制MHC-I/APM通路中的保守作用,并表明抑制SUMOylation恢复了B细胞淋巴瘤(BCL)细胞中的MHC-I/APM通路。
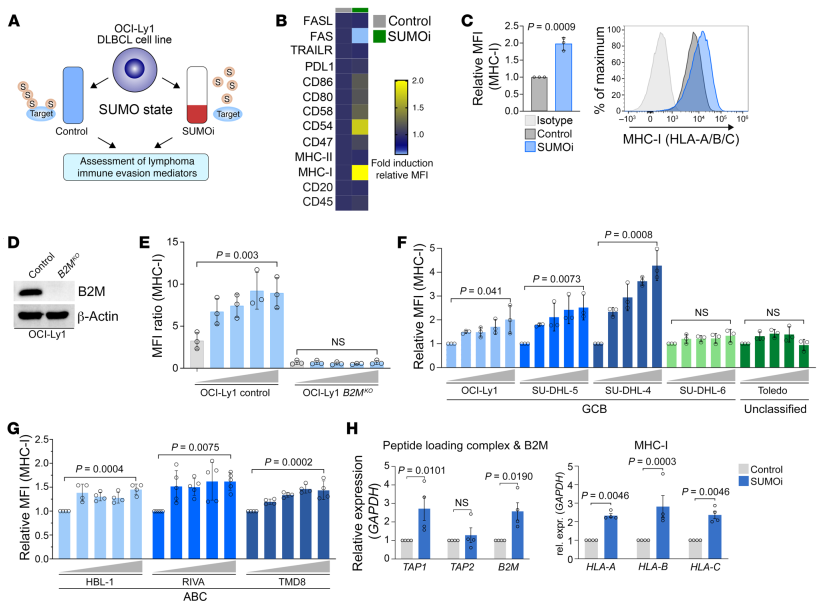
图1 SUMOi诱导MHC-I抗原加工呈递途径
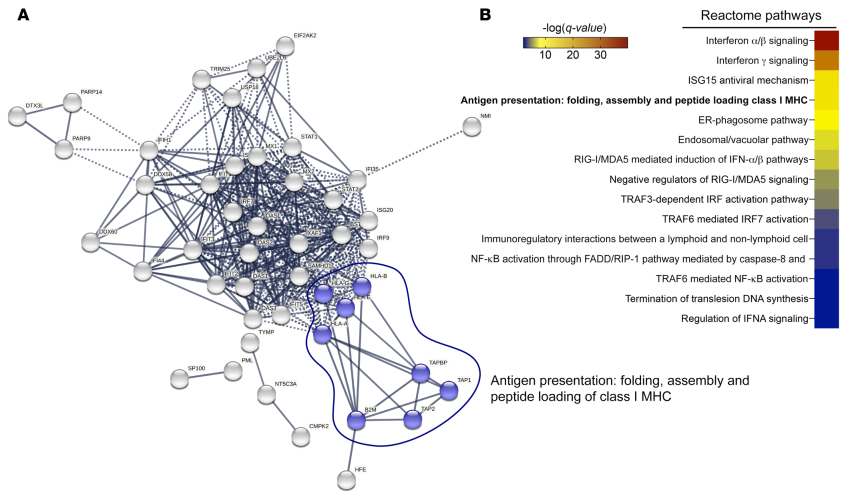
图2 SUMOi处理的DLBCL细胞系的MS蛋白组分析
2. MYC诱导的MHC-I/APM通路的抑制依赖于SUMOylation和提供免疫逃避
为了研究由MYC激活触发的活化SUMOylation与B细胞淋巴损伤中抗原呈递的抑制之间的关联,分析了NCBI 基因表达综合数据库(GEO GSE7897)中的一组mRNA表达数据,将WT B细胞与来自Eμ-MYC小鼠的MYC驱动的BCL进行比较。激活MYC信号与SUMO通路表达增加相关,同时与APM通路抑制相关(图3A)。此外,GSEA分析显示,在小鼠MYC驱动的BCLs中,抗原加工和呈递通路缺失(图3、B和C)。MYC的抑制导致了SUMO途径的抑制和相反的抗原呈递途径的诱导(图3D)。在体内淋巴瘤模型中:MHC-I表面表达在淋巴瘤发生过程中逐渐被抑制(图3E),其特征是MYC水平逐渐升高。此外,MYC在OCI-Ly1 DLBCL细胞系中的异位表达降低了MHC-I的表面表达(图3,F和G)。MYC的诱导直接降低了MHC-I的表面表达(图3H),揭示了一种保守的机制。
探讨MYC诱导的抑制MHC-I在肿瘤细胞中的功能影响,建立了共培养模型系统:携带条件MYC基因的U-2-OS细胞在与特异性识别MHC-I结合流感肽的CTL共培养之前装载流感肽(图3I)。由于MYC的激活,U-2-OS细胞的MHC-I较低,对抗原特异性T细胞杀伤的敏感性较低,这表明细胞的存活率较高,凋亡率较低(图3J)。在U-2-OS、P493-6和OCI-Ly1细胞系中,通过SUMOi处理,MYC诱导的MHC-I抑制完全恢复(图3,K M)。综上所述,这些数据表明,MYC诱导的MHC-I抑制逃避了CD8+ T细胞的免疫监视,确定了MHC-I丰度和功能的调节机制,SUMOi可以恢复这一机制。
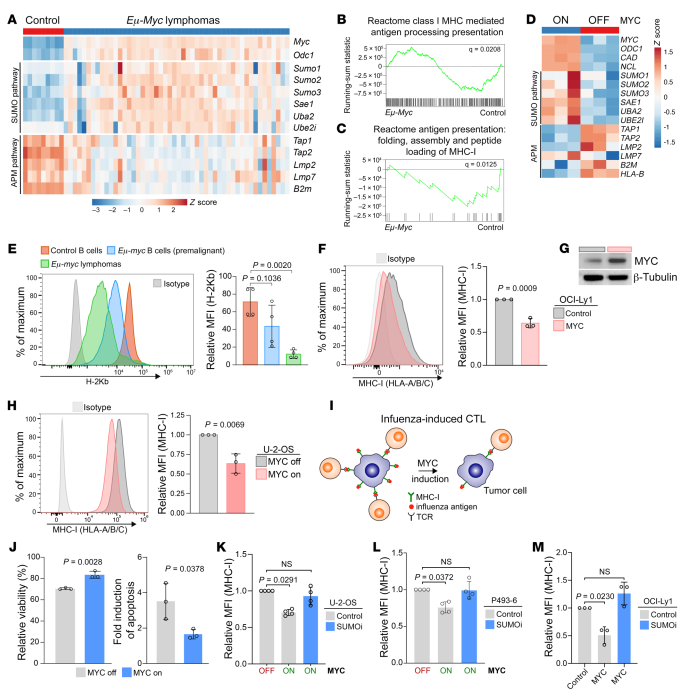
图3 MYC驱动的MHC-I/APM通路抑制可导致免疫逃避,并可被SUMOi恢复
3. 活化的SUMOylation与肿瘤浸润T细胞相关
MYC和UBA2表达与黑色素瘤患者中CD8+ T细胞的存在呈负相关,为了检验DLBCL患者的这种相关性,作者分析了原发性DLBCL患者样本中SUMO核心机制的表达,并确定了一个SUMOhi和一个SUMOlo人群(图4A)。SUMOhi亚组中浸润肿瘤的CD8+ T细胞的比例显著降低(图4B)。作者进一步用SUMOi或载体对照治疗携带同基因CT-26肿瘤细胞的小鼠,以产生SUMOi对T细胞浸润作用的直接实验证据(图4C)。SUMOi治疗导致了CT-26肿瘤细胞MHC-I (H-2kd)表达的显著诱导(图4,D和E),这与肿瘤浸润T细胞的激活有关(图4,F和G)。
综上所述,这些数据揭示了肿瘤细胞中激活的SUMOylation与肿瘤浸润T细胞的丰富和低活性相关,SUMOi可以增强这些细胞的活性。
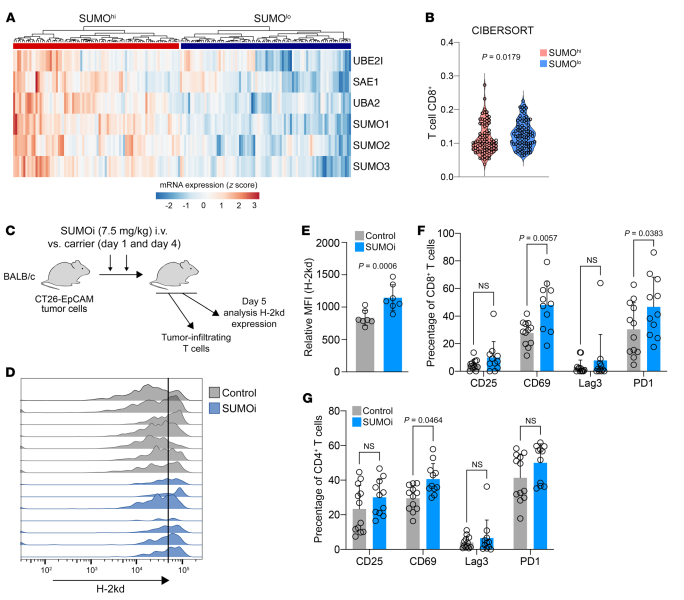
图4活化的SUMOylation与肿瘤浸润T细胞相关
4. 激活的SUMOylation限制细胞因子依赖的MHC-I的诱导
基于SUMOi抑制STAT1的磷酸化和细胞对IFN-γ的反应性,但在DLBCL细胞系中,SUMOi大幅扩增IFN-γ诱导MHC-I的诱导(图5,A和B)。抑制SUMOylation会放大IFN-γ诱导STAT1磷酸化(图5C),并直接增加STAT1蛋白和转录本丰度(图2A,图5C, E),从而启动IFN-γ信号的STAT1通路。
接下来,为了基于SUMOylation的限制IFN-γ诱导的MHC-I表达是否是癌症的一般机制。应用单样本基因集富集分析(ssGSEA),并根据抗原处理和呈递核心机制的活性对癌症细胞系百科全书(CCLE)中代表的所有肿瘤类型进行分类(图5F)。研究发现SUMOylation在沉默MHC-I/APM通路的保守作用,且药理抑制SUMOylation显著放大IFN-γ依赖性的MHC-I在骨肉瘤,神经母细胞瘤,乳腺癌和肺癌细胞中的水平(图5G)。当SUMO1和SUMO2/3耗尽时,STAT1水平升高(图5H),但只有SUMO2/3耗尽的细胞诱导了MHC-I的表达(图6A)。总之,激活的SUMOylation抑制了细胞因子依赖的MHC-I的诱导,并确定了一种附加的SUMO介导的机制,在癌症中调节MHC-I/APM通路的基础抑制。
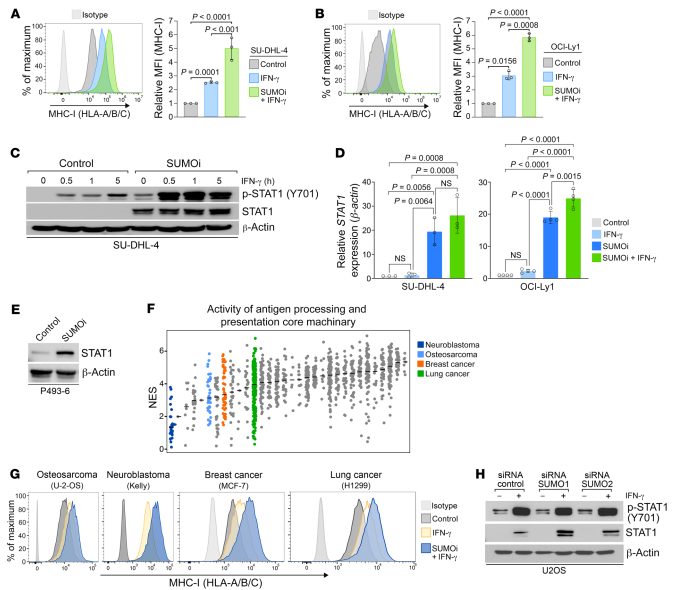
图5激活的SUMOylation限制细胞因子依赖MHC-I的诱导
5. MYC诱导的SUMO2/3修饰SAFB与MHC-I抑制有关
为了进一步探索MYC诱导的SUMO2/3介导的MHC-I抑制机制(图6A),旨在确定MYC诱导的SUMOylation的细胞靶点。使用anti-SUMO2 IP从Lys-c消化的细胞裂解液中富集了SUMO2/3修饰的多肽,并使用无标记的MS方法进一步分析AspN消化的多肽,确定了SUMO2/3位点(图6B)。通过一种互补的多肽串联质量标记方法,在29个蛋白质中发现了31个位点,显示出至少2倍的诱导(图6C)。两组数据中都有14个蛋白,包括转录共抑制因子SAFB和SAFB2(图6C),它们作为包括MHC-I基因在内的免疫调节因子的抑制因子。
另外,在对照细胞而非SUMOi处理细胞的全细胞裂解液中,检测到一个更高分子的抗SAFB反应条带(图6D)。SAFB偶联物在SUMO2/3 IPs中高度富集,但在经过SUMOi处理的样品中完全缺失,这表明它与SUMOylation SAFB相对应(图6D)。为了进一步验证MYC可以诱导SAFB的SUMOylation,SUMOi也可以阻止这种诱导,在对照组细胞和表达MYC的细胞中进行了抗SUMO2 /3 IP实验。与MS数据一致的是,在MYC诱导时,SAFB-SUMO2/3偶联物水平显著升高,而SUMOi完全削弱了这一效应(图6E)。SAFB赖氨酸294位点的SUMOylation,鉴定为一个MYC诱导的MS位点 (图6E)。此外,抑制SUMOylation也影响SAFB蛋白水平,而SAFB2蛋白水平不受影响(图6,F H)。另外,减少SAFB可显著增加MHC-I的表达(图6I)。总之,该研究发现了新的SUMO介导的MHC-I/APM通路基础抑制机制,SAFB作为其SUMO调控的转录抑制因子。
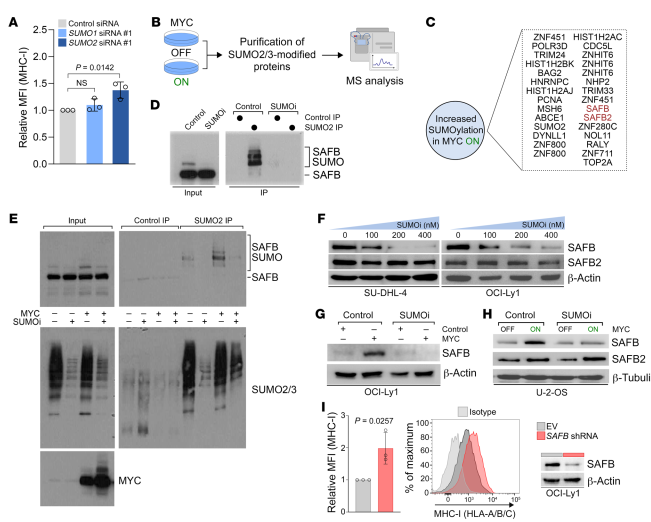
图6 MYC诱导的SAFB的SUMOylation抑制MHC-I/APM通路
6. SUMOi驱动前馈回路,放大抗肿瘤免疫反应
具有SUMOi恢复的MHC-I表面水平的DLBCL细胞比对照细胞对T细胞杀伤更敏感,这表明SUMOi恢复的MHC-I表达对抗肿瘤免疫反应具有功能性影响(图7A)。SUMOi处理的CD8+ CTLs产生显著更高水平的IFN-γ,表明T细胞活化增加(图7B)。此外,活化的T细胞产生的细胞因子进一步增强了癌细胞上MHC-I的表达(图7C),这通常会促进CD8+ T细胞的活化和细胞因子的产生。因此,与对照肿瘤细胞共培养相比,SUMOi预处理的肿瘤细胞与CD8+ T细胞共培养可以增强T细胞的活化,IFN-γ的产生增加(图7D)。SUMOi介导的MHC-I的诱导和SUMOi诱导的CD8+ T细胞的激活驱动一个前馈回路,这放大了在单独系统中观察到的SUMOi的作用(图7E)。用SUMOi和IFN-γ预处理DLBCL细胞,以最大限度地诱导MHC-I/APM通路,发现SUMOi和IFN-γ联合使用对CTL诱导的细胞溶解的敏感性最高(图7F)。最后,为了测试SUMOi作为MHC-I表达诱导剂的体内潜力,用SUMOi处理WT小鼠,分析MHC-I的表达(图7G)。尽管小鼠WT B细胞的MHC-I高表达,但SUMOi又显著增强了MHC-I的表达(图7G),并且在SUMOi处理的小鼠中未观察到任何毒性迹象(图7H)。总之,这些数据确定了一个SUMOi驱动的前馈回路,可以放大抗肿瘤免疫反应。
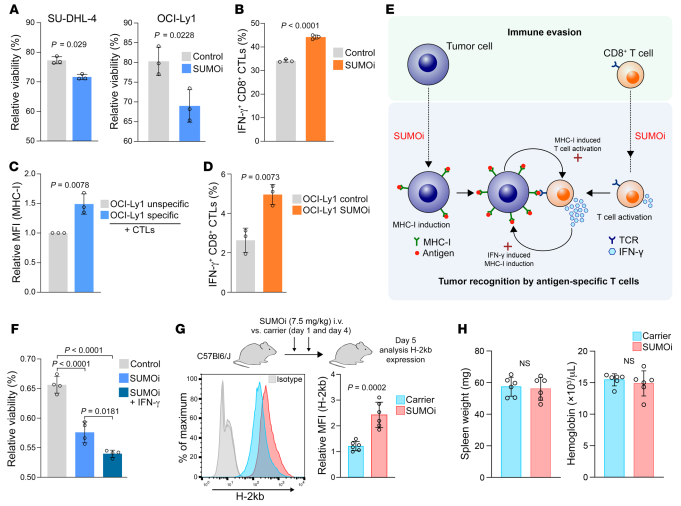
图7 SUMOi驱动前馈回路,放大抗肿瘤免疫反应
7. SUMOi改变了全球免疫系统的格局
为了系统地评估SUMOi在造血细胞中的作用,通过测序(CITE-Seq)对转录组和表位进行了细胞索引。对照组和SUMOi处理小鼠的脾脏细胞(图7G)用寡偶联抗体进行标记,以区分不同的B细胞和T细胞亚群,然后在10x Genomics平台上进行转录组学和表面蛋白质组学分析。作者确定了脾脏中普遍存在的所有主要细胞群或分化阶段(图8A)。揭示了体内SUMOi治疗后免疫系统的重大重构,从而强调了SUMOi靶向干预的广泛影响和复杂性(图8A-D)。具体来说,CD4+和CD8+ T细胞以及B细胞的丰度较低(图8D-G),而在SUMOi处理的小鼠中,NK细胞以及早期和晚期中性粒细胞的丰度显著较高(图8D-H)。在CD4+和CD8+ T细胞中,I型和II型IFN信号通路被激活,激活的T细胞亚群数量增加 (图8E-G, J和K)。抑制SUMO在转录上诱导了非恶性脾B细胞的APM,并导致了I型和II型IFN信号的全面诱导 (图8I)。除此之外,这些数据揭示了SUMOi治疗在免疫领域的惊人复杂性,并表明SUMOi通过多种机制影响免疫反应。
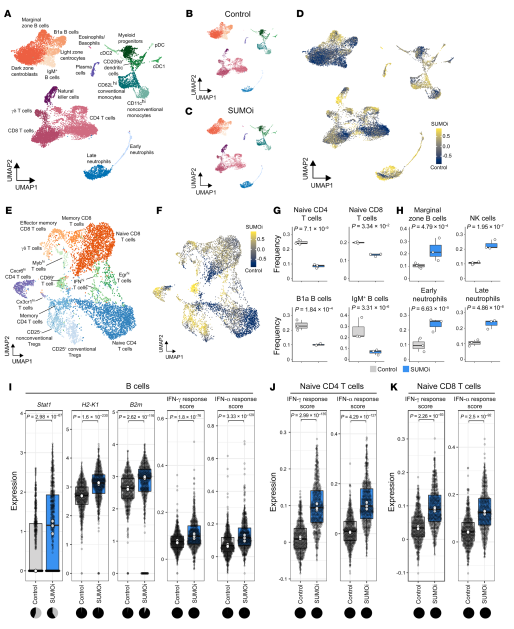
图8 SUMOi改变了全球免疫系统的格局
结论:
在本研究中,SUMOi通过转录诱导MHC-I APM来增强肿瘤细胞的免疫原性。结合SUMOi驱动的CD8+ T细胞的激活,提出了一种SUMOi依赖的前馈机制,以增强抗肿瘤免疫。确立了SUMOi在癌症领域的双靶向策略的概念。从临床角度来看,高免疫原性肿瘤细胞经常被免疫系统消灭。这个过程被称为免疫编辑,有利于免疫原性较低的癌细胞的生长,是癌症免疫治疗耐药性的一个既定原因。因此,增强肿瘤细胞的免疫原性具有特殊的治疗意义,以抑制SUMOylation反应作为一种治疗策略,以增强免疫治疗在癌症中的疗效。






