SRSF3介导的N6-甲基腺苷修饰相关lncRNA ANRIL剪接调控促进了胰腺癌对吉西他滨的耐药
富含丝氨酸/精氨酸的剪接因子3 (SRSF3)调控超过90%的蛋白质编码基因的mRNA选择性剪接,为生物多样性提供了必要的来源。目前,有研究建立了SRSF3、m6A修饰、lncRNA剪接与胰腺癌DNA 同源重组修复(HR)之间的联系,表明异常的选择性剪接和m6A修饰与胰腺癌化疗耐药密切相关。
技术路线:

主要研究结果
1. 胰腺癌组织中SRSF3表达上调与耐药有关
首先培养胰腺癌Pan1和BXPC3细胞系,通过重复吉西他滨诱导产生耐药亚群。与相应的亲本系相比,吉西他滨在耐药亚群中的半最大抑制浓度(IC50)值显著更高(图1A和图1B)。在相同吉西他滨浓度下,这些耐药细胞的增殖速度明显快于亲本细胞,表明成功构建了Panc1-GR-和BXPC3-GR-耐药菌株(图1C和1D)。然后,使用RNA测序(RNA-seq)分析对耐药和敏感细胞株之间的基因表达谱,以及26名预后较好或较差的晚期胰腺癌患者之间的基因表达谱(图1E)。SRSF3被鉴定为唯一过表达的剪接基因(图1F-1H)。
免疫组化数据显示,SRSF3表达在癌组织中显著上调(图1I和1J),这与肿瘤分级的增加相关(图1K)。在相同的化疗条件下,SRSF3高表达肿瘤患者的总生存期和无进展生存期明显短于srsf3低表达肿瘤患者(图1L)。qPCR和western blot数据进一步证实了SRSF3在胰腺癌及相应正常组织中的表达数据(图1M-1O)。因此,SRSF3高表达肿瘤患者接受化疗后预后较差,SRSF3的表达与胰腺癌的化疗耐药密切相关。
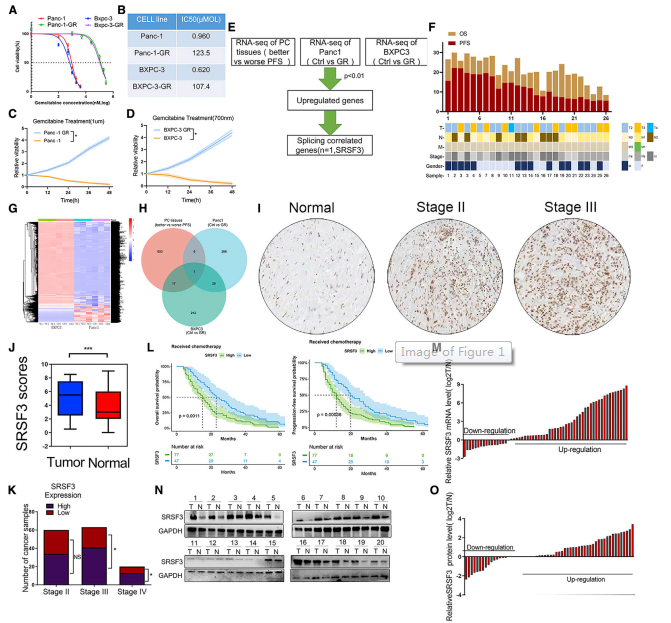
图1 SRSF3在人胰腺癌中的表达及预后价值
2. SRSF3与胰腺癌细胞吉西他滨耐药相关
接下来评估SRSF3在吉西他滨耐药和敏感胰腺癌细胞系中的表达,发现SRSF3蛋白在耐药胰腺癌细胞中的表达更高(图2A)。构建四组稳定的细胞系Panc1-Ctrl与Panc1-SRSF3、Panc1-GR-sh载体与Panc1-GRshSRSF3、BXPC3-Ctrl与BXPC3-SRSF3、BXPC3-GRsh载体与BXPC3-GR-shSRSF3,以评估SRSF3在介导耐药性中的作用。western blot数据证实成功产生了不同的表达SRSF3的胰腺癌细胞稳定亚系(图2B和2C)。随后,平板克隆形成和细胞活力测定数据发现在这些胰腺癌细胞稳定系中,SRSF3的表达确实与吉西他滨耐药相关(图2D-2F)。SRSF3的表达被证实可以提高胰腺癌细胞株对吉西他滨的IC50值(图2E)。
构建SRSF3高低表达的PDX模型,用western blot分析筛选SRSF3高、低表达的组织进行后续移植。裸鼠PDX模型和腹腔肿瘤细胞注射模型数据显示,SRSF3高表达增强了肿瘤细胞对吉西他滨的耐药性,而SRSF3低表达则有相反的效果(图2G-2N)。总之,SRSF3在胰腺癌细胞对吉西他滨的耐药性中起着重要作用。
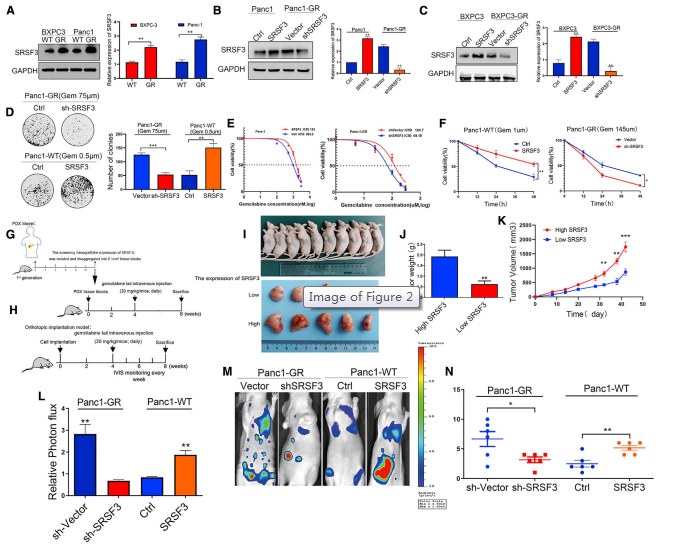
图2 SRSF3增强人胰腺癌细胞体内外吉西他滨耐药
3. SRSF3对lncRNA ANRIL剪接和外显子包含的调控
为了探究SRSF3的下游分子事件,不同水平的SRSF3表达的胰腺癌细胞进行吉西他滨干预,以确定相关蛋白的表达变化。在吉西他滨处理的细胞中,SRSF3降低了γH2AX、p53、caspase-3和bcl-2的表达,而SRSF3过表达降低了吉西他滨引起的细胞损伤(图3A)。另外,SRSF3的功能在DNA修复调控中富集(图3B)。结合图1G的结果来识别SRSF3的共同差异表达基因以及下游因子:ANRIL是该交叉点唯一与DNA修复相关的基因(图3C)。利用Ensembl数据库,根据ANRIL的不同转录本设计了引物(图3D显示了一些转录本图),并评估了ANRIL在Panc1、Panc1-GR、BXPC3和BXPC3-GR中的表达。发现吉西他滨耐药肿瘤细胞主要表达两种转录本:ANRIL 208(简称ANRIL- l)和ANRIL 223(简称ANRIL- s)(图3E)。根据ENCORI和RNAct数据库预测,SR家族蛋白SRSF1、3、7和10具有ANRIL的结合位点(图3F)。因此,进一步检测了它们在抗性细胞(GR)和亲本细胞(野生型[WT])中的表达。结果显示,GR细胞中SRSF3表达较高,SRSF10表达较低(图3G)。RNA免疫沉淀试验确认了SRSF3和SRSF10对ANRIL的结合能力(图3H、3I)。RNA下拉试验发现SRSF3和SRSF10能够与ANRIL结合(图3J-3L)。通过构建内生ANRIL pre-mRNA与潜在SRSF3-binding站点,执行一个CLIP-qPCR试验使用Panc-1-GR细胞(图3M),发现构建携带外显子1和2的碎片ANRIL能够绑定到SRSF3蛋白质,而片段包含外显子2和6绑定到SRSF10(图3N)。的RNA免疫沉淀实验数据显示,敲低SRSF10,SRSF3和ANRIL的结合增加(图3O),而在敲低SRSF3后,SRSF10和ANRIL的结合也增加(图3P和S3K)。这表明SRSF3和SRSF10竞争性结合ANRIL可调控ANRIL的剪接。SRSF3 和SRSF10 或在稳定的肿瘤细胞亚系中显示 SRSF3能够上调 ANRIL-L 表达但下调ANRIL-S 表达,而 SRSF10 具有相反的效果(图 3Q 和 3R)。这些数据表明 SRSF3 和SRSF10 与 ANRIL 竞争性结合以调节 ANRIL 剪接(图 3S)。

图3 SRSF3诱导ANRIL剪接
4. ANRIL剪接分子的m6A修饰
通过对Panc1-WT与Panc1- GR以及Bxpc3-WT与BXPC3-GR的RNA-seq结果进行GO分析,发现这些基因有m6A修饰(图4A)。与亲本株相比,Panc1-GR和BXPC3-GR中m6A的总体水平升高(图4B),这表明修改后的m6A水平可能与吉西他滨耐药有关。利用m6Avar和SRAMP数据库预测了ANRIL中m6A的修饰位点(图4C),并针对ANRIL外显子1上的m6A位点设计了一套序列特异性的morpholino反义寡核苷酸(MAOS)(图4D)。使用m6A特异性免疫沉淀试验评估了Panc1-GR/BXPC3-GR与其亲本系之间ANRIL m6A水平的差异(图4E)。此外,还发现SRSF3表达与ANRIL中的m6A修饰相关(图4F、4G),而METTL3和MAOS-ANRIL的过度表达也显示了ANRIL中m6A修饰的调控(图4H、4I)。将MAOS-ANRIL转移到具有稳定敲除SRSF3的Panc1-GR细胞系中,发现ANRIL中的m6A修饰水平降低,而在SRSF3敲除后过度表达MAOS-ANRIL的Panc1-GR细胞中的m6A修饰水平低于对照细胞(图4J、4K)。这些结果表明,SRSF3和METTL3是ANRIL中m6A修饰的重要调节因子,这在Panc1-WT细胞中得到了进一步证实(图4L、4M)。这些结果支持了在ANRIL中SRSF3和m6A修饰之间外显子1上m6A位点的重要性。ANRIL中m6A修饰的水平对于SRSF3与ANRIL-L结合至关重要(图4N、4O),并且与ANRIL剪接事件的发生密切相关(图4P-4S)。总之, ANRIL和SRSF3表达中m6A修饰水平在ANRIL- l亚型的产生中同样重要。
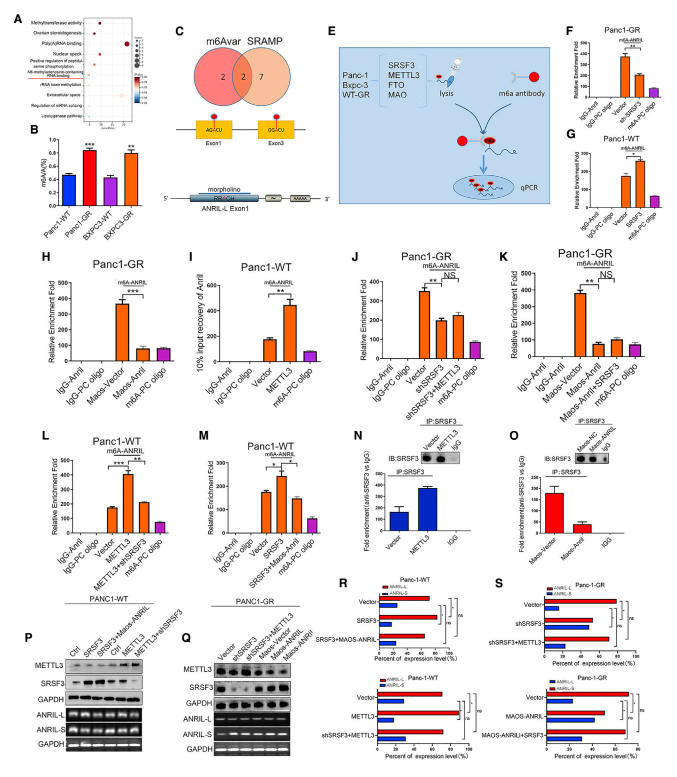
图4 ANRIL的剪接受m6A RNA甲基化的调控
5. lncRNA ANRIL亚型对吉西他滨耐药的不同影响
与亲本细胞相比,Panc1-GR和BXPC3-GR细胞中ANRIL-L表达更高,ANRIL-S表达更低(图5A)。荧光原位杂交(FISH)实验显示,ANRIL-L在Panc1-GR和BXPC3-GR细胞核中的表达高于Panc1-WT和BXPC3-WT(图5B),而ANRIL-S在细胞核中的表达高于Panc1-WT和BXPC3-WT。使用Panc1-WT和Panc1-GR生成了稳定的ANRIL-L过表达和ANRIL-S敲除细胞系,并使用qPCR验证有效转染(图5C)。ANRIL-L诱导胰腺癌细胞对吉西他滨耐药,而ANRIL-S对耐药无显著影响(图5D-5I)。ANRIL-L也影响肿瘤细胞的DNA损伤修复。结果表明,ANRIL-L能够下调DNA损伤因子gH2AX的表达,而彗星实验证实ANRIL-L与DNA修复能力密切相关(图5J、5K)。体内裸鼠实验进一步确认了该体外数据(图5L-5O)。这些结果总体上证实了ANRIL-l,而不是ANRIL-S,具有调节胰腺癌细胞对吉西他滨耐药和增强DNA修复能力的能力,表明不同的ANRIL亚型在胰腺癌细胞中具有不同的功能。
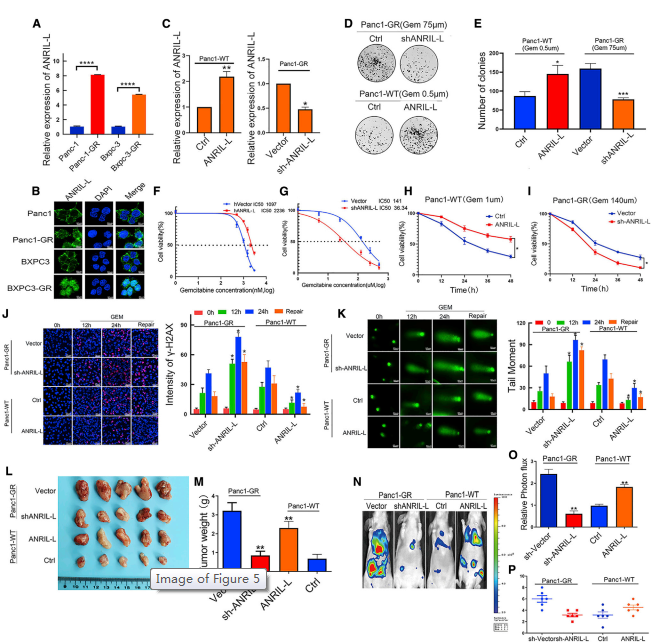
图5 lncRNA ANRIL-L亚型对吉西他滨耐药的影响
6. SRSF3通过调节ANRIL-L的表达促进吉西他滨耐药
作者通过过表达、敲除等实验证明了ANRIL-L挽救了SRSF3表达改变的肿瘤细胞对吉西他滨的耐药性,而ANRIL-S没有这种作用。western blot和高含量及彗星实验证实ANRIL-L是影响SRSF3相关DNA修复过程和耐药性变化的主要因素(图6O-6R)。综上所述,SRSF3的表达似乎通过ANRIL选择性剪接和ANRIL- l的表达增强了胰腺癌细胞对吉西他滨的耐药性。
7. ANRIL-L通过增强DNA HR修复介导吉西他滨耐药
作者证明了ANRIL-L介导的化疗耐药机制:ANRIL-L通过与RING1b和EZH2形成复合体调控胰腺癌细胞的化疗耐药(附图7A-P)。接下来分析ANRIL-L敲除耐药细胞中的HR和NHEJ,发现这些细胞中的HR活性显著降低(图6A、6B),并且qPCR数据显示所选DNA修复RAD50、BRCA1、BRCA2和RAD51 mRNA的水平显著改变(图6C)。敲除ANRIL-L表达和吉西他滨治疗改变了HR修复相关分子的表达,同时降低了RAD50、BRCA1、BRCA2和RAD51的水平(图6D)。此外,随着吉西他滨浓度和耐药胰腺癌细胞持续时间的逐渐增加,HR分子BRCA1、BRCA2、RAD50和RAD51与ANRIL-L的结合增加(图6E 6H)。然而,在EZH2或Ring1B表达被敲除后,与ANRIL-L的结合减弱(图6I-6L)。在耐药细胞中敲除ANRIL-L表达后,GH2AX与BRCA2和BRCA1的结合减少(图6M-6P)。基于这些结果,ANRIL-L能够与DNA损伤位点结合,与EZH2和Ring1B形成复合物,进而招募RAD50、BRCA1、BRCA2和RAD51蛋白,在细胞经历DNA损伤修复时促进DNA HR修复过程。
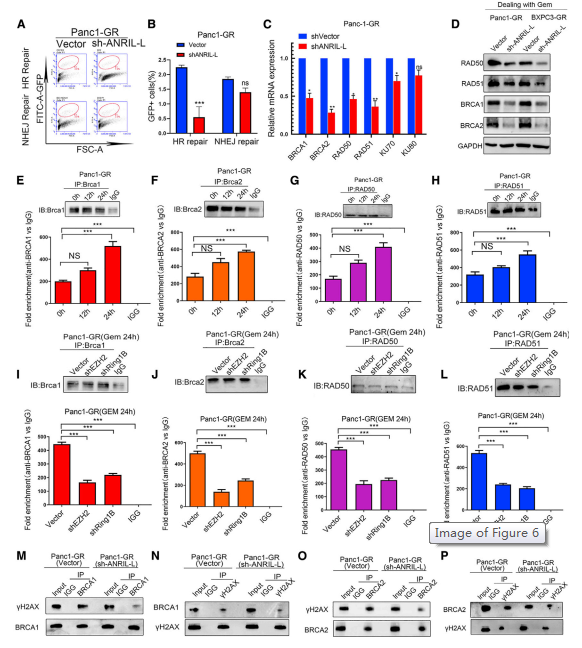
图6 ANRIL-L复合物通过增强DNA HR修复介导吉西他滨耐药
8. 胰腺癌组织中SRSF3的表达与ANRIL剪接、Ring1B和EZH2的表达相关
与正常组织相比,胰腺癌组织中ANRIL- l表达水平较高,ANRIL- s表达水平较低(图7A和7B),胰腺癌组织中ANRIL外显子1包涵水平显著高于非癌胰腺组织(图7C)。结合临床预后分析,Kaplan-Meier分析显示高PSI-ANRIL-exon 1肿瘤预后较差(图7D、7E)。相比之下,高PSI-ANRIL -1外显子的患者比低PSI ANRIL-L的患者有更多的淋巴结转移和更大的肿瘤(图7F和7G)。此外,SRSF3的表达与METTL3存在相关性,证实了SRSF3与m6A修饰之间的相关性(图7H)。ANRIL外显子1内含物PSI与肿瘤组织中SRSF3、EZH2和Ring1B的表达相关,进一步支持了这些因子形成复合物调控DNA修复的可能性(图7I-7K)。这些数据表明胰腺癌组织中SRSF3表达、ANRIL剪接以及Ring1B和EZH2表达之间存在相关性。
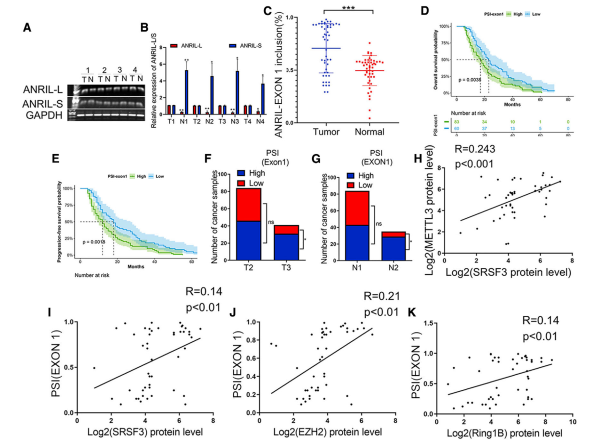
图7胰腺癌组织中SRSF3表达与ANRIL剪接、Ring1B、EZH2表达的相关性
结论:
综上所述,本研究揭示了SRSF3在胰腺癌化疗耐药调控中的作用及其与胰腺癌预后的关系。SRSF3表达通过ANRIL剪接使胰腺癌细胞对化疗药物脱敏,ANRIL中的m6A甲基化对剪接过程至关重要。证明了SRSF3和SRSF10在调节lncRNA ANRIL可变剪接模式中的作用。此外,m6A甲基化对于lncRNA的剪接过程至关重要。该研究不仅提供了SRSF3诱导ANRIL-L剪接的分子机制,进而在胰腺癌化疗耐药性中形成DNA HR修复复合体,而且还为未来胰腺癌治疗的发展提供了一种策略。






