在肺腺癌和鳞状细胞癌中, CircHMGB2通过miR-181a-5p/CARM1轴驱动免疫抑制和抗PD-1耐药性
肺癌是最常见的恶性肿瘤之一,也是世界上癌症相关死亡的主要原。非小细胞肺癌(NSCLC)主要包括肺腺癌(LUAD)和鳞状细胞癌(LUSC),约占所有肺癌病例的85%。已有研究证实了HMGB2在各种癌症中的致癌作用,但HMGB2衍生的环状RNA的生物学功能尚不清楚。本文中,作者研究HMGB2来源的环状RNA在肺腺癌(LUAD)和鳞状细胞癌(LUSC)中的应用。本文于2022年5月发表于《Molecular Cancer》,IF= 10.679。
本文技术路线:

本文主要内容:
1、CircHMGB2在NSCLC患者中的临床意义
qPCR结果显示CircHMGB2是NSCLC组织中表达最显著的CircRNA (Fig. 1A)。不同引物进行Sanger测序均鉴定出了CircHMGB2的环状结构(Fig. 1B)。此外,PCR结果显示CircHMGB2可以通过不同的引物从cDNA中而不是从gDNA中转录 (Fig. 1C)。与RNase R共孵育30分钟后, CircHMGB2对RNase R耐药,然而HMGB2 mRNA明显降解(Fig. 1D)。
CircHMGB2在大部分肿瘤组织中高表达,在NSCLC组织中,CircHMGB2表达高于正常组织2倍以上 (Fig. 1E,F)。此外,CircHMGB2的高表达与肿瘤的大尺寸和淋巴结转移有关 (Fig. 1G,H)。作者还观察到CircHMGB2的表达随着临床分期的增加而增加(Fig. 1I)。Kaplan-Meier分析显示,CircHMGB2高表达的患者总生存期(OS)较低,术后复发率较高(Fig. 1J)
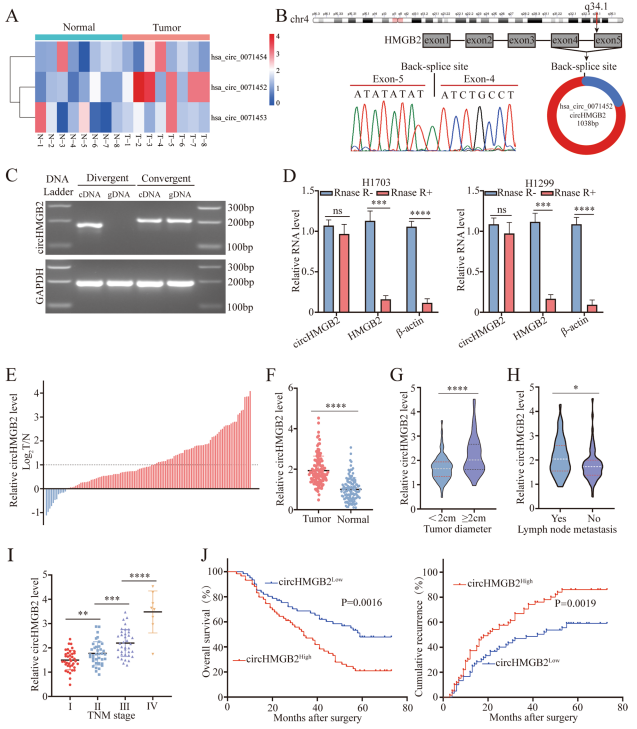
Fig1 CircHMGB2在NSCLC患者中的临床意义
2、CircHMGB2促进NSCLC增殖,重塑肿瘤微环境(TME)
CCK-8和集落形成实验显示,在NSCLC细胞中,下调CircHMGB2后细胞增殖下降,CircHMGB2表达升高后细胞增殖增加 (Fig. 2A,B)。此外,对裸鼠皮下植入A549-CircHMGB2和对照细胞进行体外分析发现过表达CircHMGB2可促进NSCLC的生长 (Fig. 2C, D)。
CCK-8和集落形成实验显示,CircHMGB2在LLC细胞中表达上调后,细胞增殖增加(Fig. 2E,F)。通过皮下注射LLC-CircHMGB2和LLC对照细胞在C57BL/6小鼠体内进行了体内实验,发现CircHMGB2可以显著增强免疫活性小鼠皮下肿瘤的生长(Fig. 2G,H)。此外,用流式细胞术检测肿瘤的免疫原性。Te结果显示在肿瘤来源的LLC CircHMGB2细胞中CD8+ T细胞、NK细胞和NK细胞均存在耗竭(Fig. 2I)。免疫组化染色的CD8+T细胞,CD4+T细胞,NK1.1+ NK细胞,CD68+TAM肿瘤组织中FOXP3+Treg细胞和CD11C+ DCs也有类似趋势(Fig. 2J)。为了进一步验证体内结果,在120个NSCLC 组织中进行免疫组化染色也得到相同的结果。CD8+ T细胞,CD56+ NK细胞和CD11C+ DCs浸润在CircHMGB2高表达的NSCLC中显著降低(Fig. 2K)。考虑到CircHMGB2对NSCLC TME的明显影响,作者推测CircHMGB2主要通过限制TME的抗肿瘤免疫来诱导NSCLC的进展。
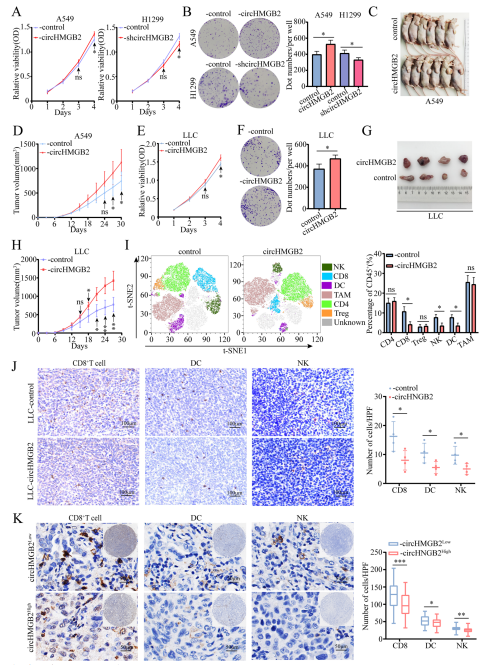
Fig2 CircHMGB2促进NSCLC增殖,重塑肿瘤TME
3. CircHMGB2吸附miR‑181a‑5p上调CARM1的表达
在H1299细胞中使用CircHMGB2探针进行CircRIP,通过qRT-PCR观察miR-181a-5p的显著富集(Fig. 3a)。通过RIP进一步验证CircHMGB2和miR-181a-5p之间的相互作用,发现抗AGO2抗体显著富集了CircHMGB2和miR-181a-5p (Fig. 3b)。 miR-181a-5p模拟物明显削弱了野生型CircHMGB2的荧光素酶活性,但没有削弱突变型CircHMGB2序列的荧光素酶活性(Fig. 3C,D)。miR-181a-5p下拉实验也显示CircHMGB2显著富集(Fig. 3E)。此外,qRT-PCR结果显示,在H1299细胞中,敲除CircHMGB2表达后,miR-181a-5p水平升高(Fig. 3F)。在H1299细胞中,FISH染色显示CircHMGB2和miR-181a-5p在细胞质中共定位(Fig. 3G)。预测CircHMGB2可能通过海绵吸附miR-181a-5p来发挥其生物学功能,CARM1为CircHMGB2的下游mRNA,荧光素酶报告实验表明,与突变体CARM1序列相比,CARM1野生型荧光素酶活性减少 (Fig. 3H,I)。qRT-PCR也显示在H1299-shCircHMGB2细胞中,CARM1的表达降低(Fig. 3J), 而在H1299-shCircHMGB2细胞中,敲除miR-181a-5p的表达可显著恢复CARM1的表达(Fig. 3K, L)。此外,检测了120个NSCLC患者中CircHMGB2、miR-181a-5p和CARM1的表达量, miR-181a-5p的表达与CircHMGB2和CARM1水平呈负相关,而CircHMGB2的表达与CARM1水平呈正相关(Fig. 3M-O)。在非小细胞肺癌中,CircHMGB2可通过作为miR-181a-5p的海绵, 解除对下游分子CARM1的抑制作用。

Fig3 CircHMGB2通过海绵吸收miR-181a-5p上调下游分子CARM1的表达
4. 在NSCLC治疗中, CircHMGB2限制了PD - 1阻断
接下来,在CircHMGB2过表达和对照C57BL/6肿瘤小鼠中评估CircHMGB2对抗PD-1治疗的潜在影响。当肿瘤大小达到100mm3时,腹腔注射Te PD-1阻断剂或IgG,剂量为100μg/次,每3 d注射一次 (Fig. 4A)。体内实验结果显示,过表达CircHMGB2可显著降低抗PD-1治疗2周后的疗效(Fig. 4B, C)。此外,上调CircHMGB2表达会降低免疫活性小鼠的存活率(Fig. 4D)。作者建立了huHSC-NOGEXL小鼠(Fig.4E)。这些小鼠皮下接种A549-CircHMGB2和A549对照细胞,作者发现CircHMGB2可以显著增强人免疫系统小鼠皮下肿瘤的生长(Fig 4F,G)。用流式细胞术检测肿瘤的免疫球蛋白,发现在A549-CircHMGB2细胞来源的皮下肿瘤中存在CD8+ T细胞、NK细胞和DCs耗尽(Fig. 4H)。肿瘤组织中CD8+ T细胞、CD56+ NK细胞和CD11C+ DCs的IHC染色也有类似趋势(Fig. 4I)。作者在接种A549-CircHMGB2或A549对照细胞的人源小鼠模型上验证了抗PD -1治疗的有效性,并制定了免疫治疗的给药方案(Fig. 4J)。结果证实CircHMGB2过表达明显限制了抗PD -1的治疗效果(Fig. 4K,L).
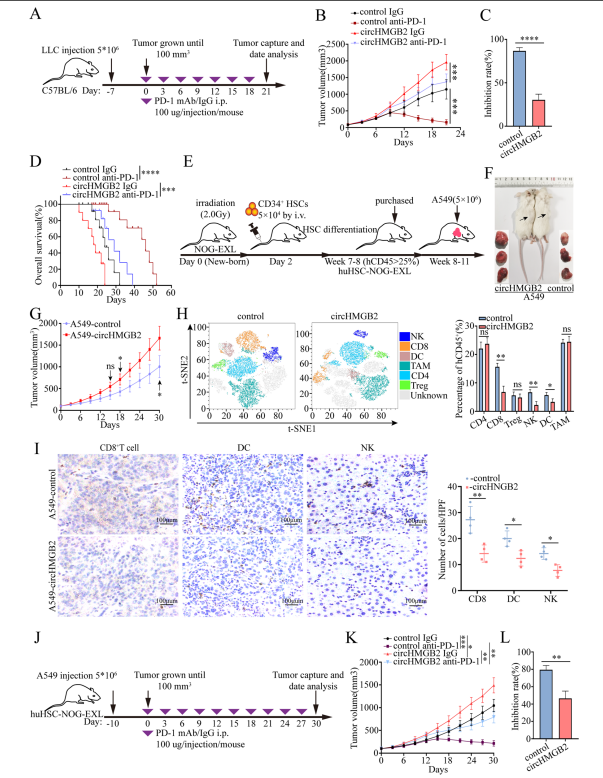
Fig 4 CircHMGB2降低PD-1阻断治疗NSCLC的疗效
5. 敲除CARM1基因可使CircHMGB2高表达的NSCLC细胞对抗PD - 1抗体治疗敏感
鉴于以上结果显示CircHMGB2高表达抑制抗PD -1治疗NSCLC的疗效,作者假设CircHMGB2失活,CARM1可能增加抗PD-1治疗的敏感性。因此,在LLC-CircHMGB2细胞中,用CRISPR-Cas9系统完全敲除CARM1基因(Fig. 5A)。
为了验证敲除CARM1和PD-1免疫治疗的协同作用,作者通过皮下移植小鼠建立异种移植模型,LLC-CARM1-KO-CircHMGB2和LLC-CARM1-control- CircHMGB2细胞系。结果显示,敲除CARM1显著延缓了抗PD-1后CircHMGB2过表达肿瘤的生长,大大提高了该组小鼠的生存率(Fig. 5B,C)。流式细胞仪分析显示敲除CARM1后,C57BL/6小鼠皮下CircHMGB2过表达肿瘤,抗PD-1治疗可增加CD8+T细胞、NK细胞和DCs的浸润进入皮下过表达(Fig. 5D)。重要的是,EZM2302 (CARM1的小分子抑制剂)和抗PD-1抗体的应用取得了类似的结果(Fig. 5E-G)。作者在A549细胞中敲除CARM1基因(Fig. 5H),并建立了A549-CARM1- control-CircHMGB2和A549-CARM1- ko - Circ HMGB2稳定转染细胞系。然后用A549-CARM1-control-CircHMGB2和A549-CARM1-ko-CircHMGB2细胞建立人源化小鼠皮下肿瘤模型,并给予抗PD-1单抗。体内实验证实,在皮下肿瘤组织中,敲除CARM1显著延缓了抗PD-1后过表达CircHMGB2引起的肿瘤的生长,促进了CD8+T细胞,T细胞,NK细胞和树突状细胞的浸润。此外,使用EZM2302和anti-PD-1 mAb也取得了相似的效果(Fig. 5K-M)。
体内实验表明,EZM2302处理可增加CD8 +T细胞、NK细胞和DCs细胞的浸润(Fig.5K-M),推测EZM2302可能具有协同抗PD-1的作用改善小鼠肿瘤模型的抗肿瘤反应。qRT-PCR检测病情进展中(PD),病情稳定(SD),和部分缓解患者(PR)中CircHMGB2的表达,结果发现,PD组CircHMGB2的表达明显高于PR组和SD组(Fig. 5N)。Spearman分析结果显示,CircHMGB2的表达与PD、PR、SD组CARM1阳性表达呈正相关(Fig. 5O)。此外,免疫组化染色显示PR和SD组CD8+、T细胞、NK细胞和DCs浸润明显高于PD组(Fig. 5P)。24例接受抗PD -1治疗的NSCLC患者中,CircHMGB2表达与CARM1表达呈正相关,与CD8+T细胞、DCs、NK细胞浸润呈负相关(Fig. 5Q-S)。因此,这些数据表明,抑制CARM1可以提高CircHMGB2高表达NSCLC患者抗pd -1治疗的疗效。
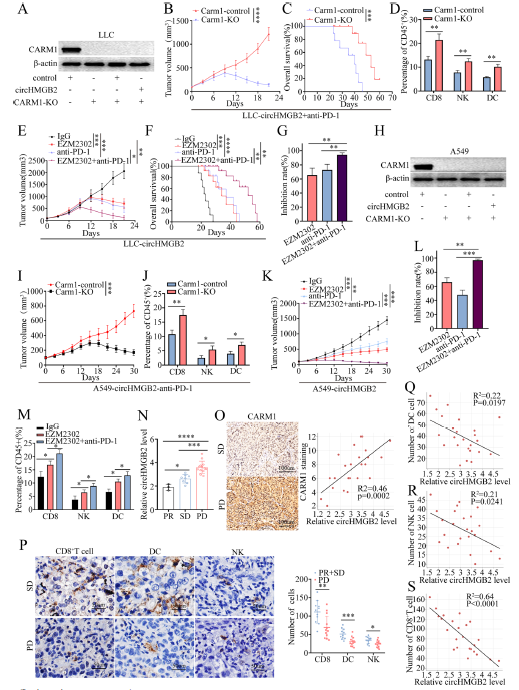
Fig5敲除CARM1使CircHMGB2高表达的NSCLC细胞敏感
6、 CircHMGB2通过CARM1抑制1型IFN对NSCLC的响应
IFN-γ刺激(5 ng/ml)可上调IFN激活基因的表达并激活JAK 和STAT1,JAK 和STAT1是参与了1型干扰素反应的重要途径(Fig. 6A)。在Co-IP实验中,CircHMGB2过表达抑制STAT1去乙酰化,CARM1敲除扭转了这一现象(Fig. 6B)。与A549- CircHMGB2或对照细胞相比,CARM1基因敲除的A549细胞,增殖大大受损,而CARM1-KO A549细胞在IFN-γ刺激下凋亡明显增强 (Fig. 6C, D)。IFN激活 CXCL10、ISG15、IL18、IFIT1、CCL5和IFR7的表达,敲除CARM1后,这些基因的表达显著增加,过表达CircHMGB2后,这些基因的表达受到抑制(Fig. 6E)。为了进一步验证CircHMGB2对1型IFN应答的调控作用,作者应用IHC技术检测了120例NSCLC患者肿瘤组织中STAT1的磷酸化、CARM1的表达以及IFN应答基因ISG15和IFIT的表达。结果表明,CircHMGB2的表达与CARM1的染色呈正相关,而与STAT1的磷酸化及ISG15、IFIT的表达呈负相关(Fig. 6F,G)。总之,CircHMGB2通过CARM1抑制1型IFN反应,诱导了NSCLC对细胞毒性免疫反应的抵抗。
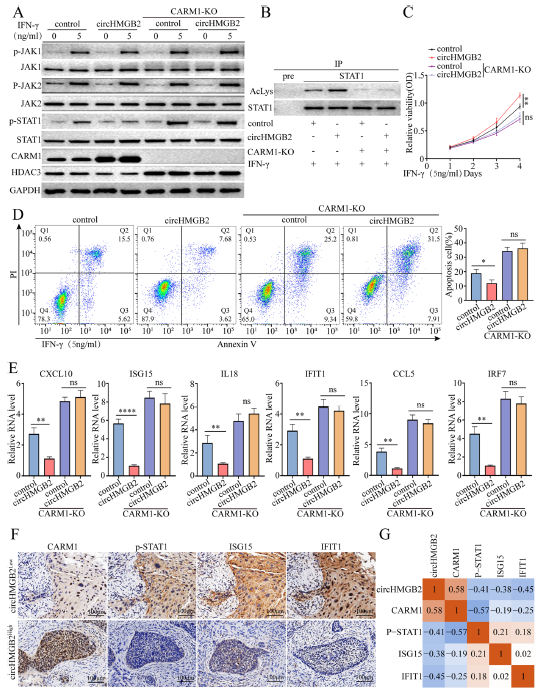
Fig 6 CircHMGB2通过CARM1抑制NSCLC中的1型IFN反应
综上所述,作者发现在LUAD和LUSC的肿瘤微环境中,circHMGB2通过miR - 181a - 5p/CARM1轴驱动肺腺癌和鳞状细胞癌中的免疫抑制和抗PD - 1耐药性,为提高PD-1免疫治疗的疗效提供了一种新的策略。
参考文献:
Zhang, L.X., et al., The circular RNA circHMGB2 drives immunosuppression and anti-PD-1 resistance in lung adenocarcinomas and squamous cell carcinomas via the miR-181a-5p/CARM1 axis. Mol Cancer, 2022. 21(1): p. 110.






