lncRNA DDX11-AS1通过与HNRNPC结合促进胶质瘤细胞的增殖和迁移
胶质瘤是中枢神经系统恶性肿瘤,发病机制复杂,手术难度大,术后复发率高。目前,仍然缺乏有效的治疗。lncRNA DDX11-AS1已被证明可促进肿瘤的发展,如肝细胞癌、食管癌等。然而,其在胶质瘤中的分子机制尚不清楚。在本研究中,我们发现胶质瘤组织中DDX11-AS1的表达升高,DDX11-AS1高表达的患者预后不良。DDX11-AS1是一个潜在的预后标志物。在功能上,DDX11-AS1促进胶质瘤细胞增殖和迁移。在机制上,DDX11-AS1与HNRNPC相互作用,促进Wnt /b-catenin和AKT途径以及上皮间质转化过程。综上所述, DDX11-AS1/HNRNPC轴可能在胶质瘤的发生和发展中起着至关重要的作用,这为胶质瘤的诊断、治疗和预后提供了新的思路和治疗靶点。本文于2022年4月发表于“Molecular Therapy Nucleic Acids”(IF=8.886)上。
技术路线

结果
1)DDX11-AS1在胶质瘤组织中上调,高表达的DDX11-AS1与胶质瘤患者预后不良相关
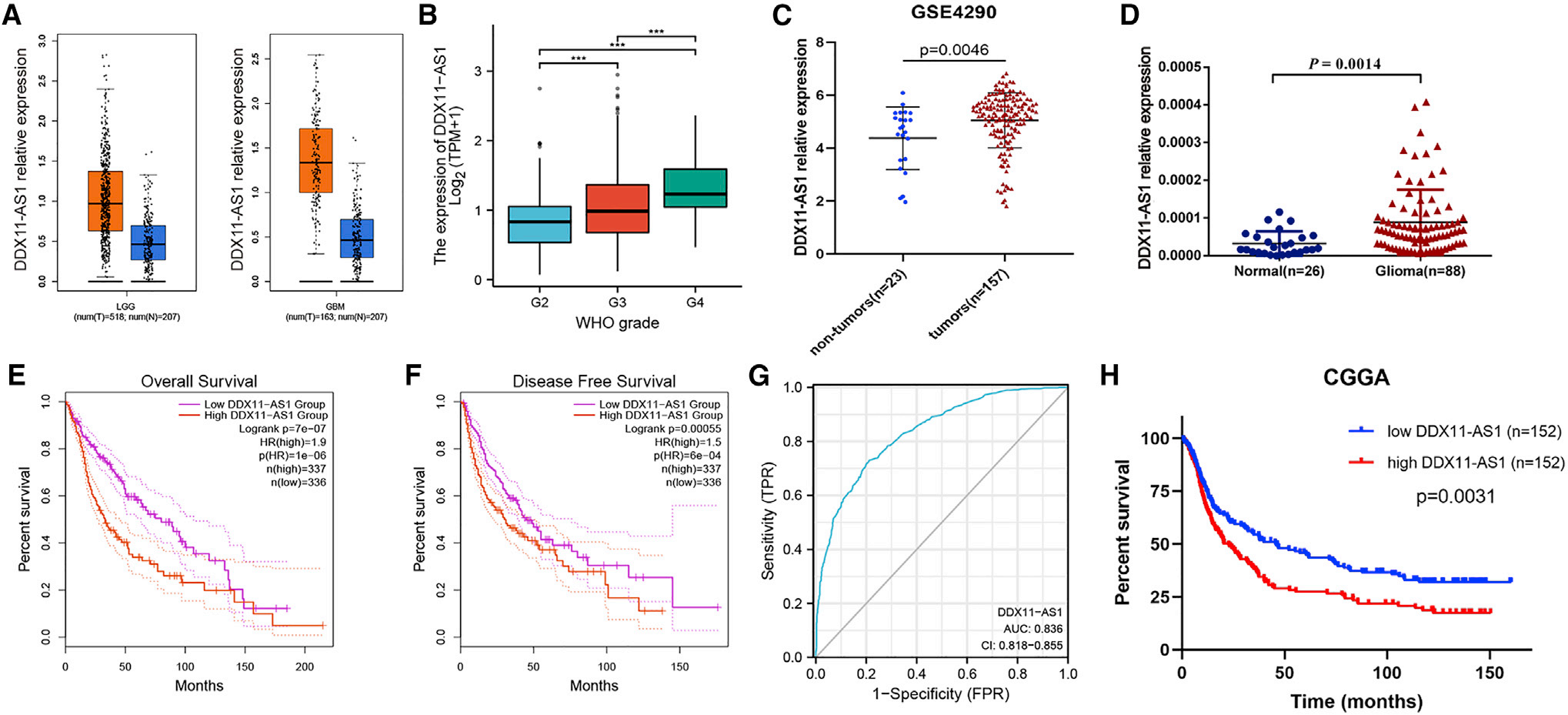
为了探索DDX11-AS1在胶质瘤组织中的表达模式,我们在GEPIA网站上对TCGA数据进行了深入分析。由于TCGA数据中没有胶质瘤对照组织样本,通过匹配GTEx数据,518例低级别胶质瘤(LGG)和163例胶质母细胞瘤(GBM)中DDX11-AS1的表达与207例正常样本相比显著增加(图1A)。随着级别的增加,表达水平也逐渐增加(图1B)。通过对GSE4290数据集的数据分析,我们发现DDX11-AS1在胶质瘤组织中也高表达(图1C)。此外,我们收集了26个正常样本和88个胶质瘤,通过实时定量PCR进行DDX11-AS1定量分析,结果与数据库分析一致(图1D)。根据DDX11-AS1表达水平均匀分布所有胶质瘤样本后,我们发现DDX11-AS1低表达组的总体生存率和无病生存率较高,尤其是在5年内(图1E和1F)。基于TCGA和GTEx胶质瘤数据的ROC曲线显示,DDX11-AS1在预测胶质瘤患者预后方面具有较高的准确性(图1G)。通过分析CGGA数据库,我们还发现DDX11-AS1低表达的患者预后更好(图1H)。这些结果表明,DDX11-AS1与胶质瘤的进展有关。
2)DDX11-AS1促进胶质瘤细胞迁移和EMT过程
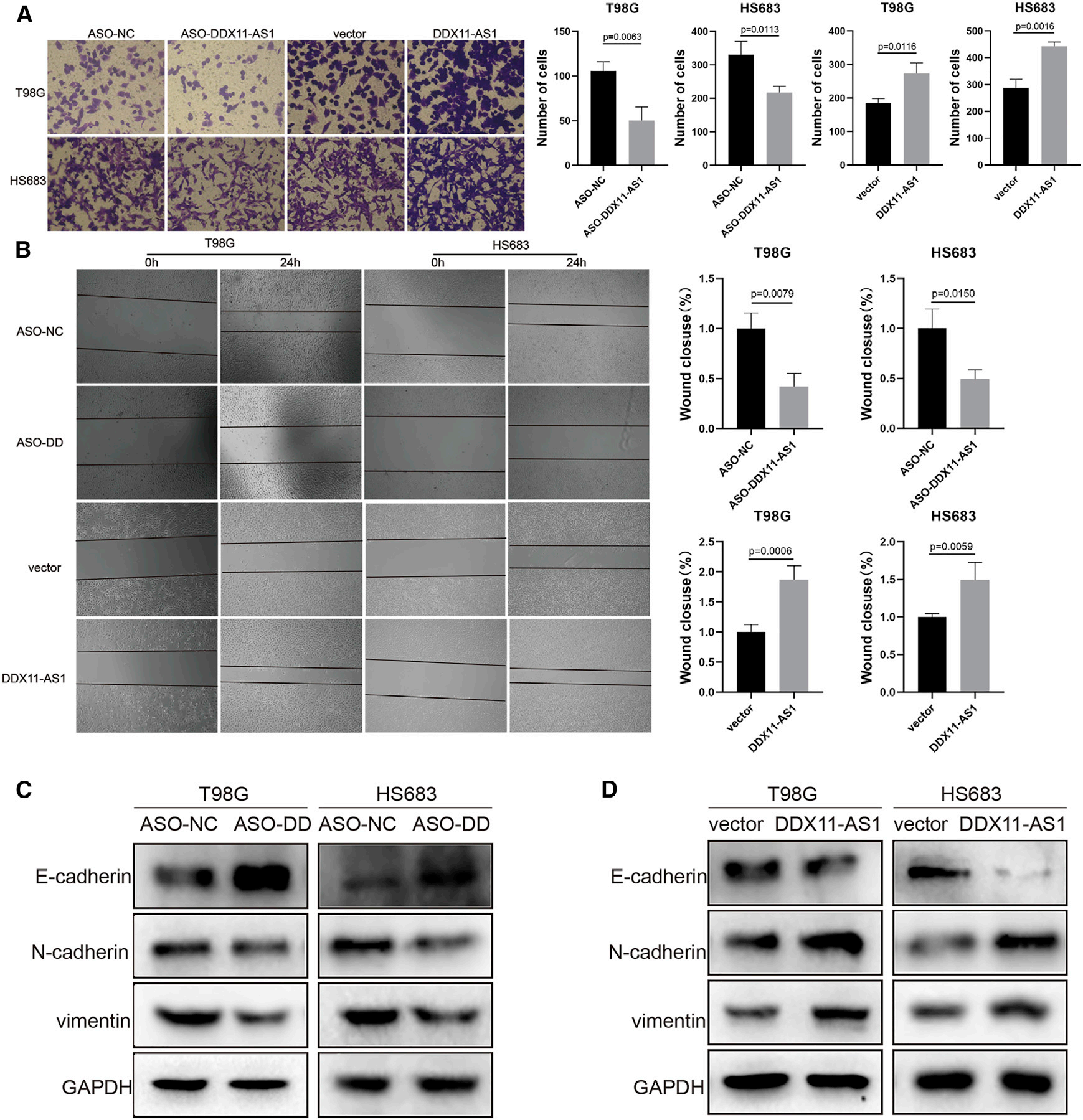
接下来,我们构建了敲低和过表达的DDX11-AS1细胞模型,用于细胞功能实验。通过transwell和伤口愈合实验,我们观察到低表达DDX11-AS1的胶质瘤细胞的迁移能力减弱,而高表达胶质瘤细胞的迁移能力增强(图2A和2B)。此外,DDX11-AS1敲除细胞中E-钙粘蛋白的表达增加,N-钙粘蛋白和波形蛋白的表达减少(图2C)。这意味着DDX11-AS1基因敲除抑制了EMT过程;相反,DDX11-AS1过表达激活了EMT过程(图2D)。
3)DDX11-AS1增强胶质瘤细胞在体内外的增殖能力
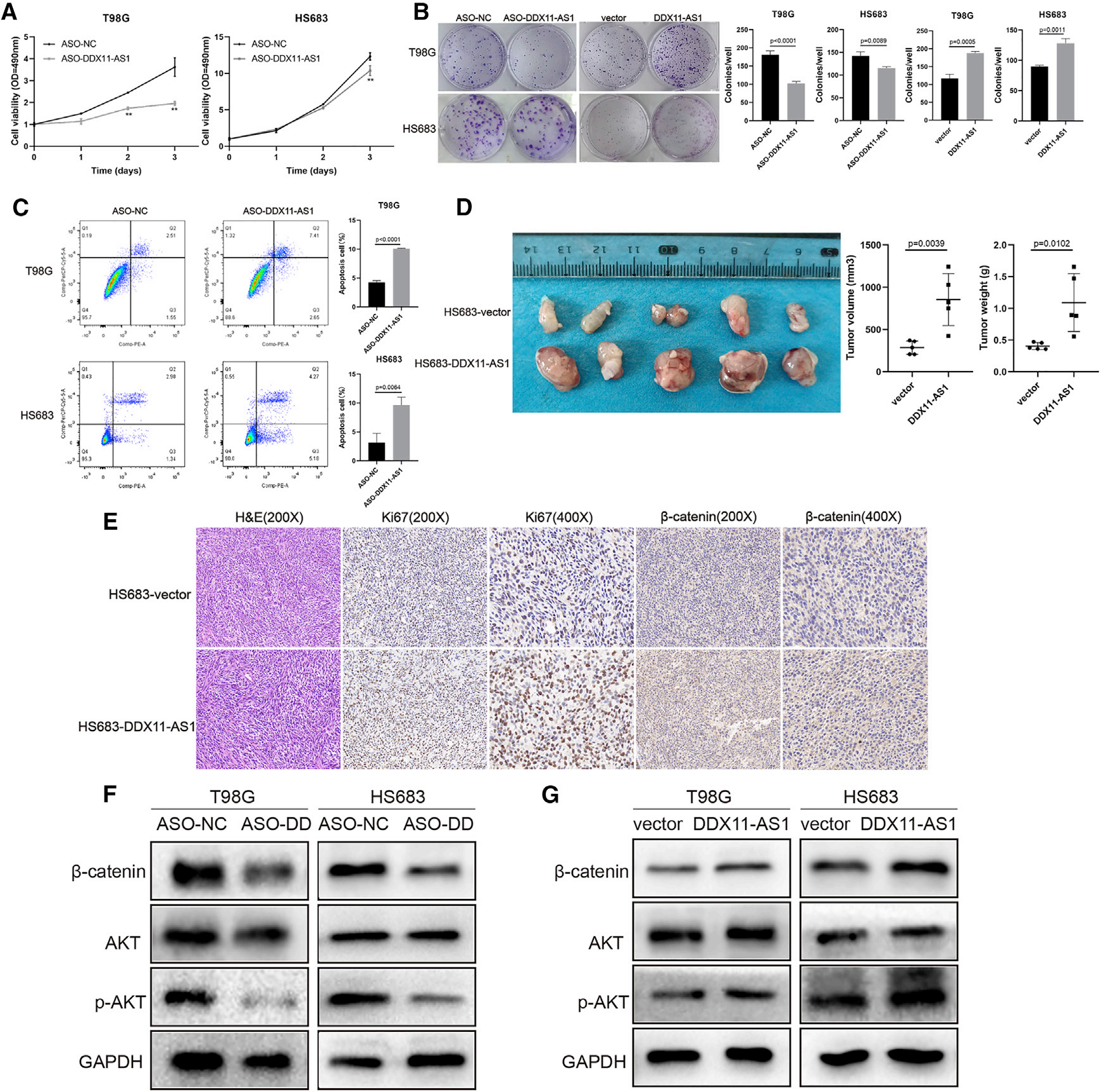
为了研究DDX11-AS1对细胞增殖的影响,我们进行了体内和体外实验。MTT试验结果表明,敲除DDX11-AS1后,T98G和HS683细胞的增殖能力下降(图3A)。DDX11-AS1敲除细胞的集落形成显著减少,DDX11-AS1高表达细胞的集落形成增加(图3B)。此外,流式细胞术分析显示,低表达DDX11-AS1的胶质瘤细胞数量增加(图3C)。此外,我们还进行了体内肿瘤形成实验。我们将DDX11-AS1过表达的HS683细胞皮下接种于裸鼠腋窝。肿瘤生长如图3D所示。DDX11-AS1过表达细胞的生长速度更快。IHC结果显示,Ki67在过表达组的表达水平增加(图3E)。由于Wnt/b-catenin和AKT途径与胶质瘤的发生和发展密切相关。我们通过western blot观察到DDX11-AS1敲除抑制了这两条途径,而过表达激活了这两条途径(图3F和3G)。IHC分析还显示,DDX11-AS1组的b-连环蛋白表达增加(图3E)。因此,DDX11-AS1促进了胶质瘤的发生和发展。
4)DDX11-AS1与HNRNPC相互作用
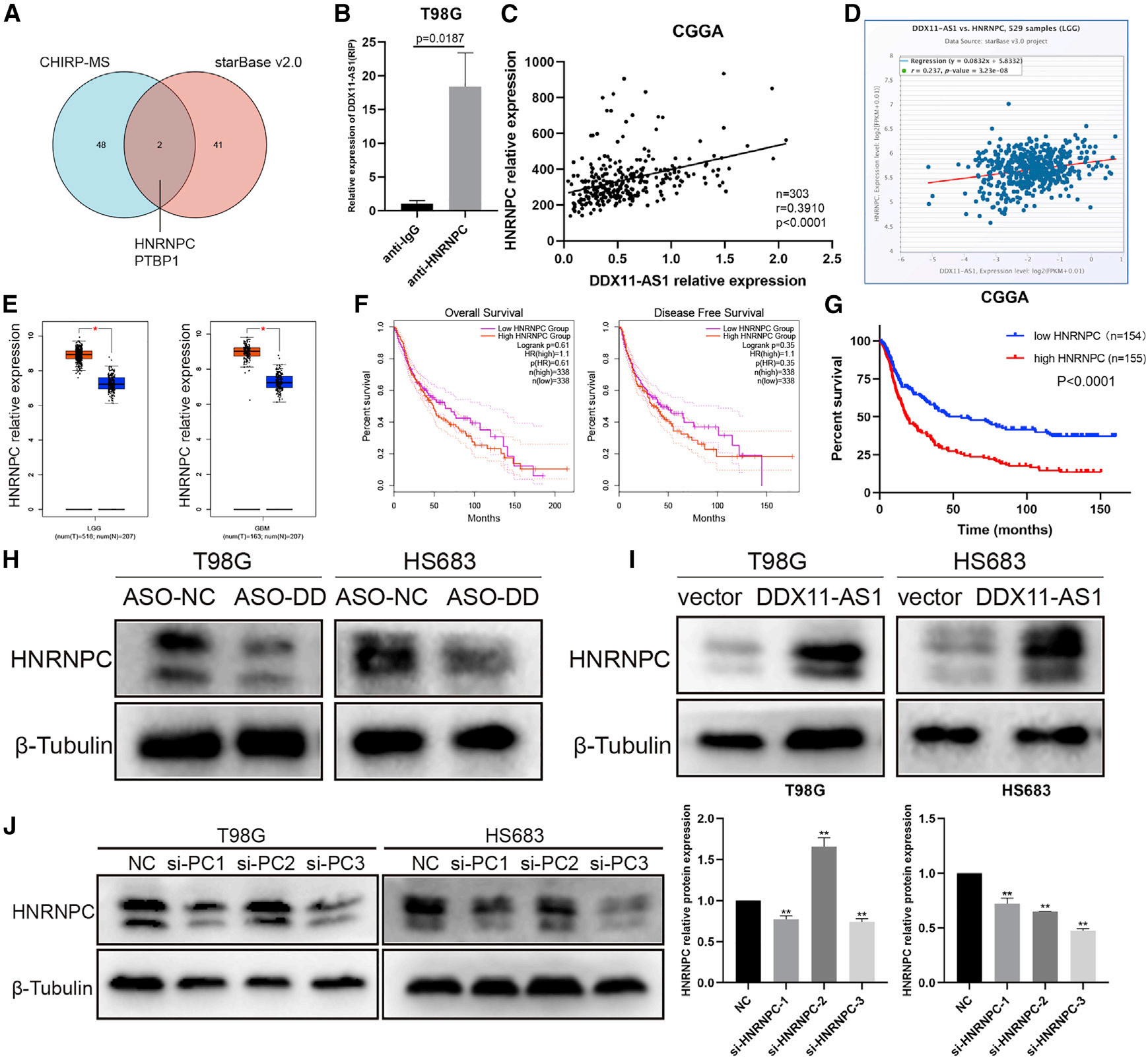
越来越多的研究表明,细胞质中lncRNA对细胞功能的调节依赖于蛋白质。因此,为了探索DDX11-AS1的潜在结合蛋白,我们预测了DDX11-AS1在starBase v.2.0上的结合RBP,结果表明DDX11-AS1可以结合43个RBP。此外,收集T98G细胞,通过RNA纯化和质谱分析分离染色质,鉴定DDX11-AS1结合的蛋白质。与对照组相比,DDX11-AS1特异性结合208种蛋白质。我们主要关注iBAQ得分前50名的蛋白质。在两组蛋白质相交后,只有HNRNPC和PTBP1(图4A)。由于HNRNPC与DDX11AS1的相互作用更为丰富,HNRNPC被列为后续机制研究的候选分子。为了验证DDX11-AS1与HNRNPC的直接结合,我们使用HNRNPC抗体进行了RIP实验,以拉下与HNRNPC结合的RNA分子。通过定量实时PCR检测和分析,与IgG Ctrl组相比,HNRNPC抗体显著富集DDX11-AS1(图4B)。此外,我们还分析了TCGA和CGGA数据库中DDX11-AS1和HNRNPC表达之间的相关性。DDX11-AS1与HNRNPC呈正相关(图4C和4D)。我们还发现,HNRNPC在胶质瘤组织中高表达,HNRNPC低表达的患者预后更好(图4E–4G)。通过western blot分析,HNRNPC的表达随着DDX11-AS1的敲除而降低,HNRNPC的表达随着DDX11-AS1的过表达而增加(图4H,4I)。此外,我们构建了三个用于HNRNPC敲除的siRNA,第三个序列是最好的敲除序列,然后用于后续实验(图4J)。总之,这些数据表明DDX11-AS1可以特异性结合HNRNPC。
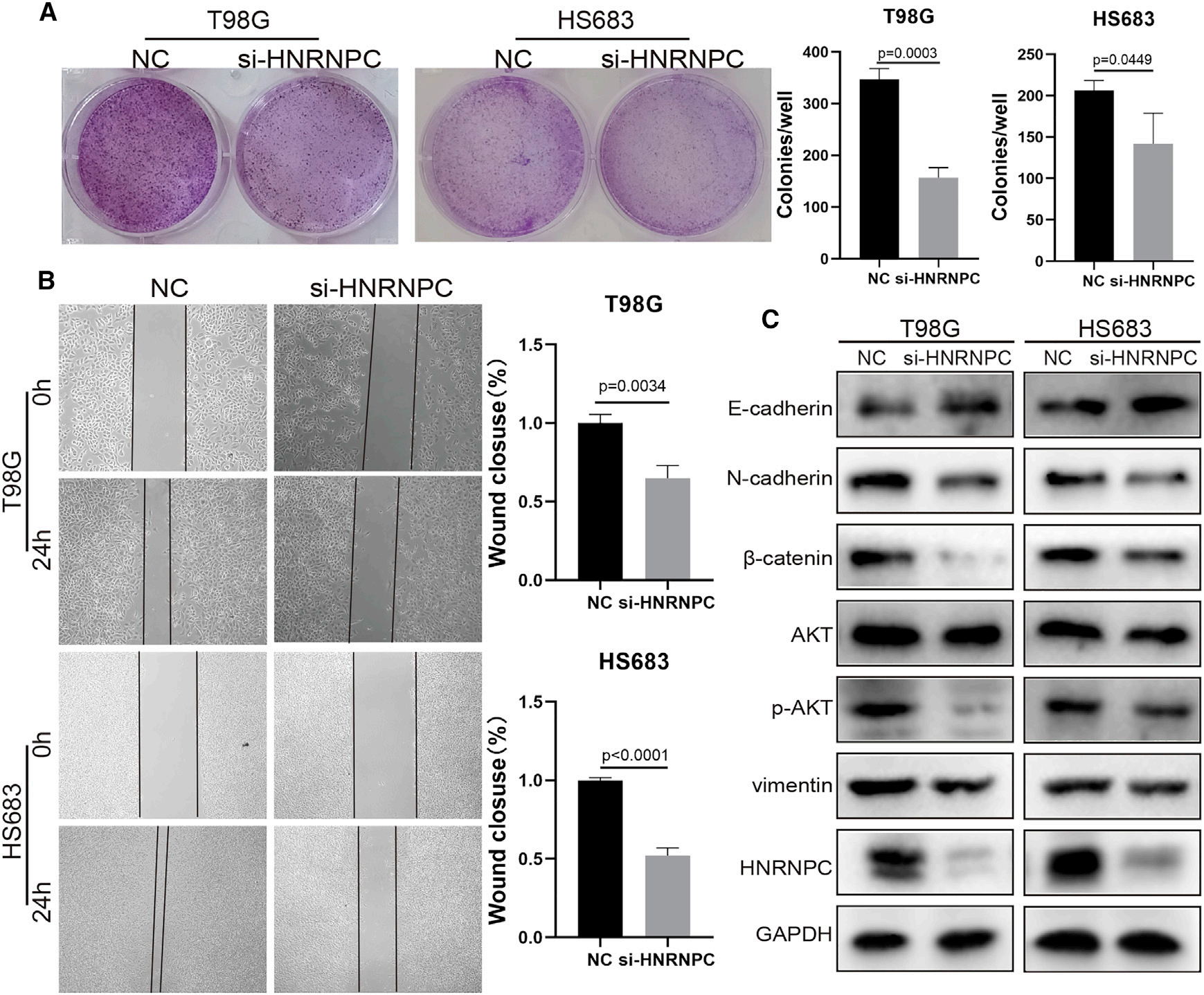
5)HNRNPC敲除抑制胶质瘤细胞增殖、迁移和EMT
我们探讨了HNRNPC在胶质瘤中的功能作用。敲除HNRNPC后,克隆形成实验表明胶质瘤细胞的增殖能力下降(图5A),伤口愈合实验表明胶质瘤细胞迁移减少(图5B)。这些结果表明,HNRNPC敲除抑制了胶质瘤细胞的增殖和迁移。此外,我们还发现HNRNPC影响Wnt/b-catenin和AKT途径以及EMT过程(图5C)。
我们试图探讨DDX11-AS1对胶质瘤进展的影响是否依赖于HNRNPC。在过表达DDX11-AS1的基础上,我们进一步敲除HNRNPC进行细胞增殖和迁移实验。我们观察到,通过敲除HNRNPC,DDX11-AS1促进胶质瘤细胞增殖和迁移的能力减弱(图6A和6B)。此外,我们还分析了DDX11-AS1/HNRNPC轴在体内的作用。结果表明,HNRNPC敲除减弱了DDX11-AS1对胶质瘤生长的促进作用(图6C)。western blot分析表明,HNRNPC敲除降低了DDX11-AS1介导的Wnt/b-catenin和AKT途径的激活,以及EMT过程(图6D)。此外,根据DDX11-AS1和HNRNPC在CGGA胶质瘤患者中的表达情况,将患者分为四组进行总体生存分析。如图6E所示,DDX11-AS1和HNRNPC低表达的患者生存率最高。
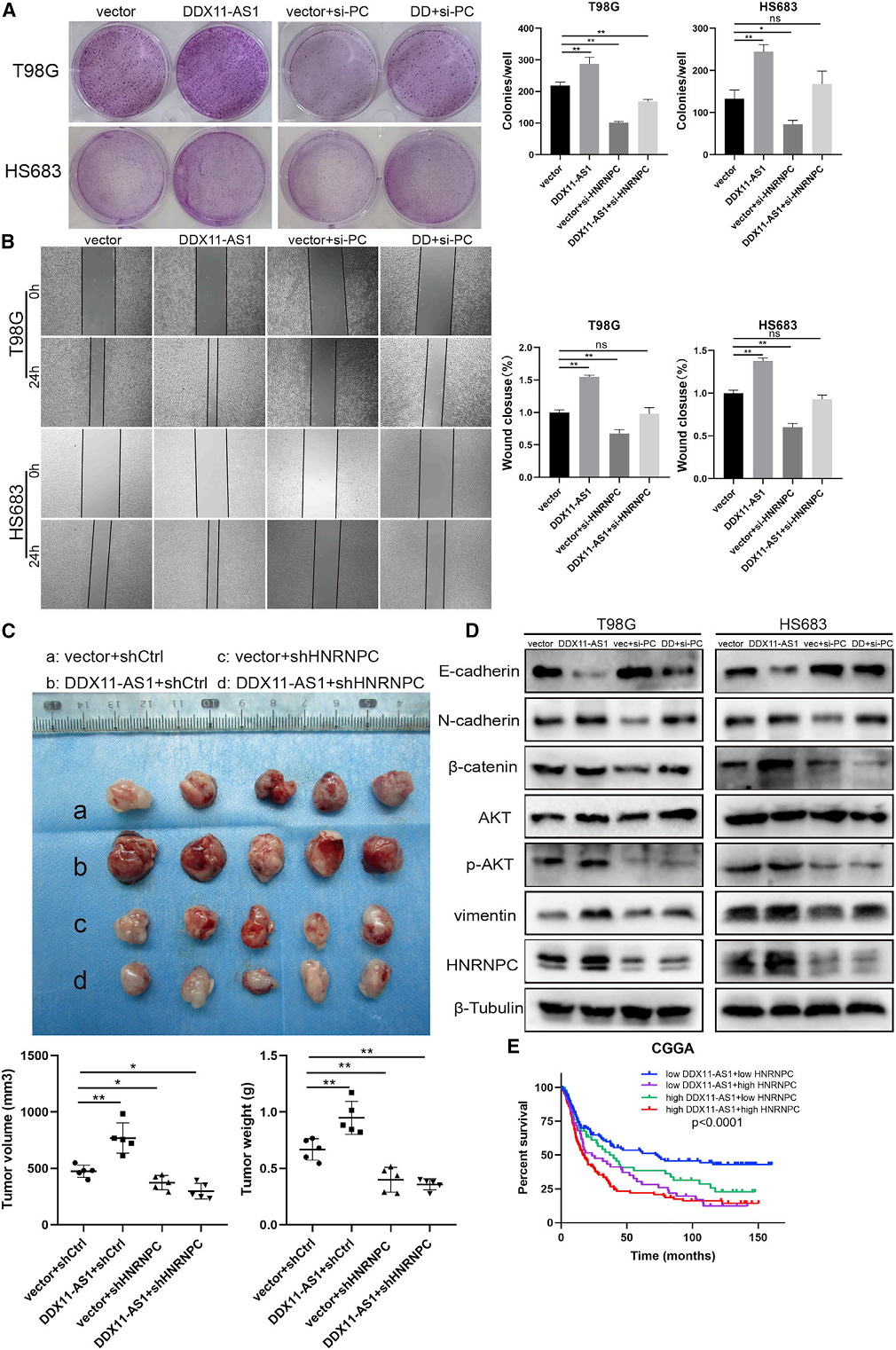
结论:DDX11-AS1在胶质瘤组织中上调,并与胶质瘤患者的预后不良相关。在机制上,DDX11-AS1和HNRNPC的结合增强了Wnt/b-catenin和AKT途径以及EMT,从而促进胶质瘤细胞的增殖和迁移。DDX11-AS1/HNRNPC轴的发现有望为胶质瘤的诊断和预后提供新的思路。
参考文献:Xiang Z, Lv Q, Zhang Y, Chen X, Guo R, Liu S, Peng X. Long non-coding RNA DDX11-AS1 promotes the proliferation and migration of glioma cells by combining with HNRNPC. Mol Ther Nucleic Acids. 2022, 28:601-612. doi: 10.1016/j.omtn.2022.04.016.






