心脏成纤维细胞通过Htra3-TGF-β-IGFBP7轴调控心力衰竭的发生发展
组织纤维化和器官功能障碍是包括心力衰竭在内的与年龄相关的疾病的特征,但是否有一个共同的途径来诱发这两种事件仍不清楚。假设心脏成纤维细胞和心肌细胞之间可能存在通信,作者利用单细胞RNA-seq绘制的心脏细胞-细胞通讯图。本文于2022年3月发表于《Nature communications》,IF= 12.121。
本文技术路线:

本文主要内容:
1、 单细胞网络分析确定Htra3是心脏成纤维细胞的中心分子
为了研究导致衰竭心肌细胞诱导的分子相互作用,在进行主动脉横向收缩术(TAC)或假手术的小鼠中,于2周后分离了心肌细胞和非心肌细胞(Fig. 1A)。利用所有数据集中的1019个配体和受体(LR)表达谱,作者生成了一个共表达网络图,并揭示了心脏中LR的细胞类型特异性转录特性 (Fig. 1B)。接下来,使用LR相互作用数据库重新构建心脏LR相互作用网络图,并显示相同或不同细胞类型之间潜在的综合相互作用(Fig.1C)。通路分析显示,PI3K-Akt、Rap1和TGF-β信号通路等特异性信号通路在心脏中被强烈激活(Fig.1d)。在各种细胞类型中,在包括心脏成纤维细胞与包括心肌细胞在内的多种细胞类型的相互作用最强(Fig.1e)。TAC引起的超负荷的压力增加心脏成纤维细胞数量,其中细胞外基质相关基因如Ctgf、Tgfb1和Fbn1被激活(Fig.1f)。
通过生成心脏成纤维细胞网络,作者确定Htra3是位于网络中心的分子(Fig.1g)。Htra3的表达与心脏成纤维细胞模块的表达有很强的相关性(Fig.1h),提示Htra3心脏成纤维细胞的身份。但其在心脏中的作用尚不清楚。心脏成纤维细胞特异性Htra3表达经scRNA-seq证实(Fig. 1j)。另外,作者也确认了HTRA3在人心脏间质中的表达(Fig. 1k)。

Fig1 单细胞网络分析鉴定心脏成纤维细胞Htra3
2、心脏成纤维细胞Htra3支配心脏稳态,并因压力过载而下调
与野生型相比,对照组小鼠,Htra3 KO小鼠即使在没有压力过载的情况下也表现出心肌肥厚,心肌细胞体积增大,而血压没有变化(Fig 2a-c)。TAC引起的轻微压力过载可迅速诱导Htra3 KO小鼠严重心力衰竭,但在WT小鼠中不明显(Fig 2b)。TAC对Htra3 KO小鼠的引起的心肌纤维化比WT小鼠严重(Fig 2d)。压力过载降低了WT小鼠心肌成纤维细胞中的Htra3(Fig 2e)。人类心脏的scRNA-seq证实HTRA3在心脏成纤维细胞中特异表达,在衰竭心脏中表达减少(Fig 2f)。机械拉伸对分离的原代心脏成纤维细胞中抑制tra3和Tgfb1表达增加(Fig 2g)。这些结果表明,Htra3特异表达于心脏成纤维细胞,对于维持心脏基本大小和抵抗血流动力学过载至关重要,而心脏成纤维细胞的机械应激会降低Htra3的表达。
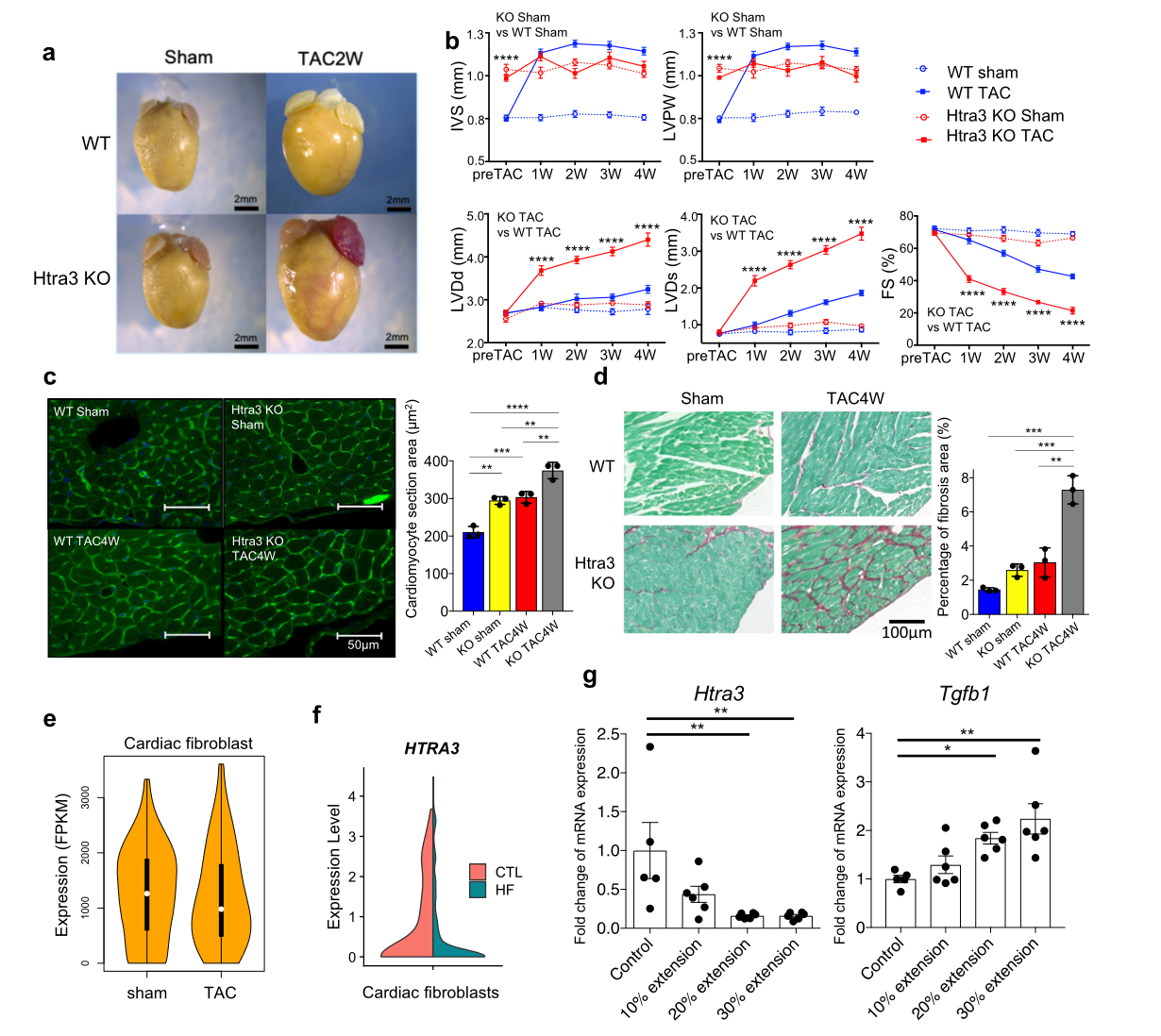
Fig2 Htra3 KO小鼠心肌及心肌细胞肥大,易受机械应激影响
3. htra3诱导TGF-β降解对预防心力衰竭和纤维化至关重要
在TAC引起的轻微压力过载小鼠或假手术的WT和Htra3 KO小鼠中,于2周后对使用Pdgfr-α抗体分离的心脏成纤维细胞进行全长scRNA-seq(Fig 1a)。UMAP绘图和基于图形的聚类将心肌成纤维细胞分成三个聚类(C1-3),假时间分析显示两条轨迹(Fig 3a,b)。成纤维细胞轨迹1(来自C1 - C2)主要是由Htra3缺失引起,而成纤维细胞轨迹2 (C1 - C3)是由压力过载引起的,Htra3缺失或不缺失均可 (Fig. 3a-c)。共表达网络分析和随机分析明确了M1和M17模块显著参与细胞分类(它们的模块活性相互排斥(Fig. 3d)。M1模块在心脏成纤维细胞中表达,包含先天免疫和toll样受体信号通路相关基因(包括Tlr2和Tlr4)(Fig 3e, f)。轨迹1和轨迹2中M1模块的活性被强烈抑制(Fig 3e-g)。
M17模块富含参与细胞外基质形成和TGF-β信号通路的基因,它们的活性在两个轨迹1和2中都有不同程度的上调 (Fig. 3h-j)。无论是压力过载,还是Htra3缺失激活M17,它们一起协同增强其活性(Fig. 3j)。胶原原纤维组织基因Col1a1和Col3a1的表达在两种轨迹中都被激活,而TGF-β信号分子的表达,如Tgfb3和Tgfbr2,以及活化心脏成纤维细胞6的标志物Postn,仅在轨迹2中被激活(Fig. 3i)。这些结果表明Htra3基本抑制TGF-β信号,压力过载和Htra3缺失协同激活TGF-β信号,导致成纤维细胞活化。
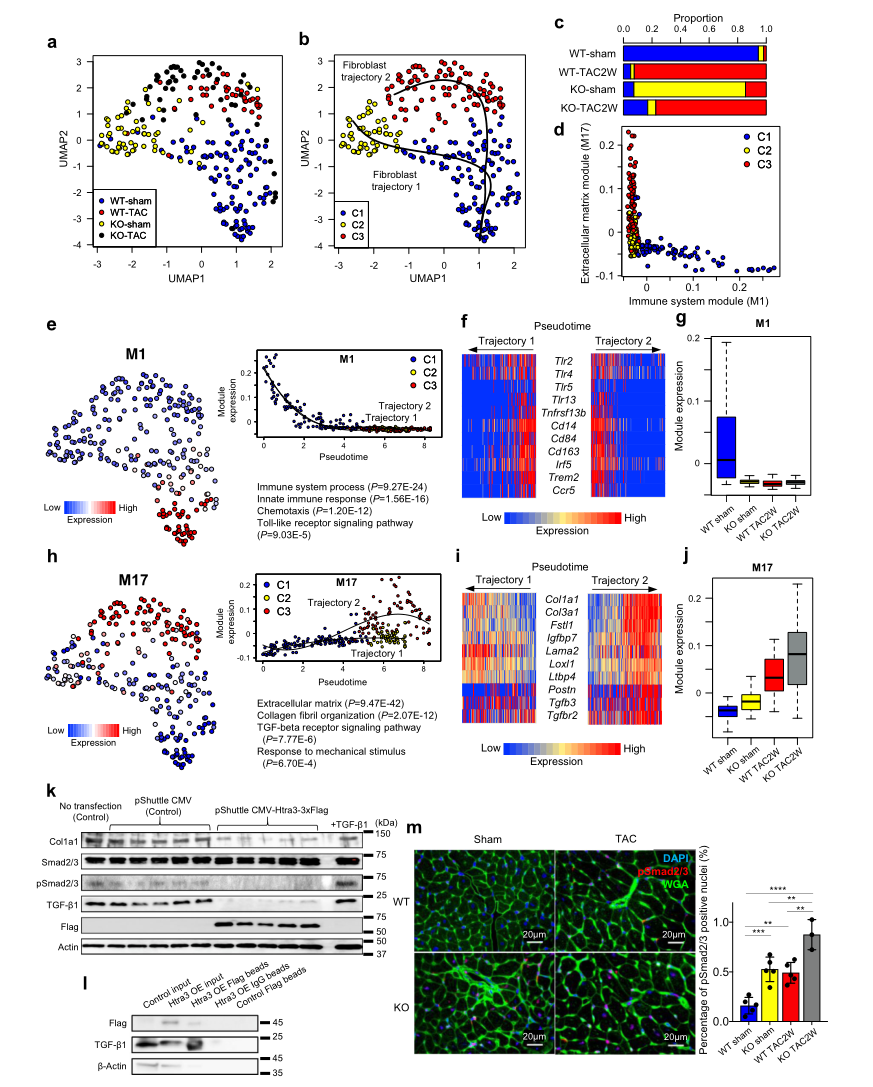
Fig3心脏成纤维细胞的单细胞rna序列显示Htra3通过TGF-β抑制维持其静止状态
4. Htra3抑制诱导的TGF-β信号激活促进衰老衰竭心肌细胞的诱导
为了了解TGF-β信号的激活如何影响心肌细胞并导致心力衰竭,作者在TAC轻微压力过载小鼠或假手术小鼠后在2周后对WT和Htra3 KO小鼠心肌细胞进行了scRNA-seq检测。UMAP将心肌细胞划分为4个簇,假时间分析显示2条轨迹(Fig 4a, b)。共表达网络分析和随机森林分析识别模块M1和M2在细胞分类中起重要作用。Htra3缺失,TAC轻微压力过载,以及它们的联合诱导了C1心肌细胞分别转向C2, C3和C4(Fig. 4b)。富含线粒体氧化磷酸化和DNA修复相关基因(如Atm、Parp1/2和Rpa2)的M1模块在轨迹1和轨迹2中均被显著抑制(Fig 4d - f),这表明激活TGF-β信号可以抑制线粒体和DNA修复相关基因的表达(Fig 4d, e)。在Htra3 KO小鼠心肌细胞中,参与氧化还原过程的基因被下调,在无压力过载的情况下,蛋白质合成相关基因表达上调, 可能导致htra3ko小鼠心肌细胞肥大 (Fig. 2c)。
模块M2,包含与GTPase小信号(如Rhob和Rac1)、TGF-β受体信号(如Ltbp4和Tgfbr2)和p53信号(如Trp53和Cdkn1a),在C4中通过轨迹2特异激活 (Fig. 4g–i)。Htra3缺失和压力过载的联合作用显著促进了用抗γH2A抗体染色的衰竭心肌细胞的诱导(Fig. 4j)。作者还证实了TAC手术后,Htra3 KO小鼠心肌细胞DNA损伤相关基因表达增加(Fig.4k)。M2还含有多种分泌因子,包括Bmp1、Cxcl12、Igfbp7,提示表达M2的心肌细胞表现出DNA损伤诱导的分泌表型,类似于衰老相关的分泌表型(SASP)(Fig 4l)。聚类分析发现,模块M9富含编码胶原纤维组织相关蛋白的基因(如Col1a1, Col3a1和Fbn1)和TGF-β信号传导(如Tgfb3, Nox4, 和Postn),也像M2一样在C4中被特异性激活 (Fig. 4m-o)。
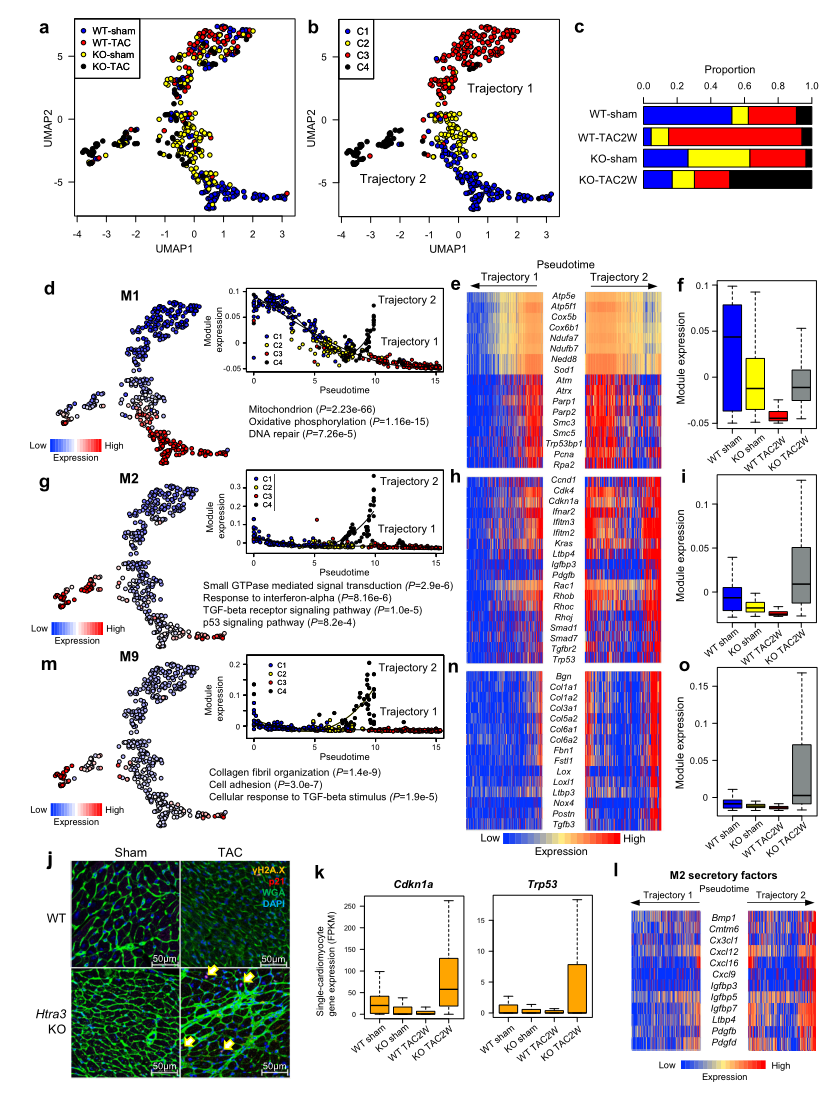
Fig4 心肌细胞的单细胞RNA-seq表明,Htra3可以防止心肌细胞衰老衰竭的诱导
5. TGF-β诱导的Nox4表达及随后的p53激活对诱导具有分泌表型的衰竭心肌细胞至关重要
作者注射了Nox4- shRNA腺相关病毒9 (AAV9)载体来抑制Nox4的表达(Fig 5a)。超声心动图显示,在TAC手术后htra3ko小鼠中,敲除Nox4可挽救其心功能障碍(Fig 5b)。免疫染色和western blot分析显示,Nox4抑制可显著降低DNA损伤(Fig 5c, d)和TGF-β信号蛋白相关分子的表达(Fig 5e)。作者在TAC手术后1周将AAV9-Htra3载体注入WT小鼠体内。发现心脏Htra3过表达抑制TGF-β信号传导,改善心功能障碍和纤维化。
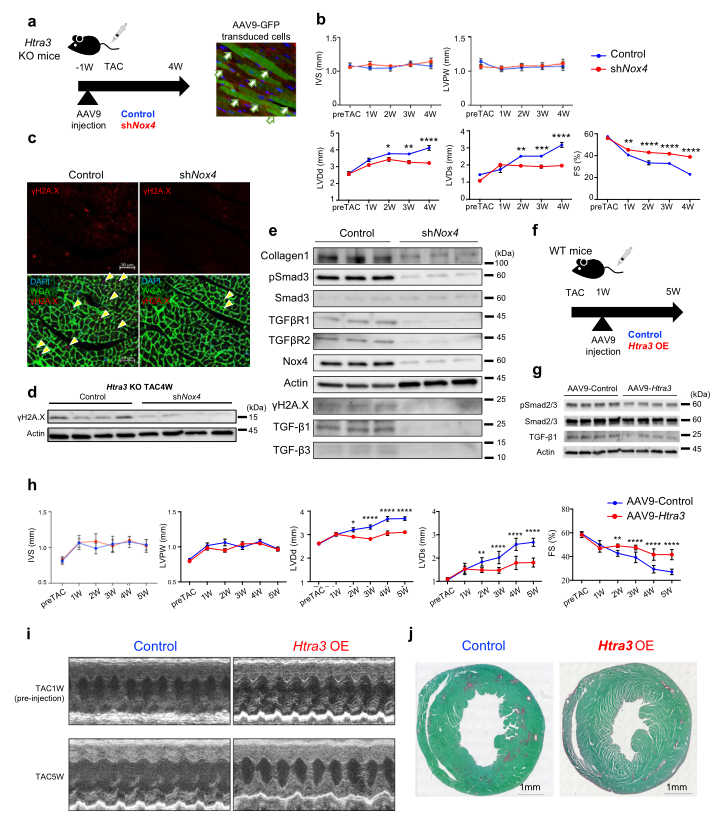
Fig5 TGF-β诱导的Nox4激活可诱导衰老衰竭心肌细胞和心力衰竭
6、空间转录组显示Htra3-TGF-β轴在心肌梗死后心肌纤维化和心肌细胞分泌表型诱导中起重要作用
为了阐明Htra3如何在空间上调控心脏重构,作者研究了Htra3在心肌梗死(MI)模型中的作用。Visium (10X Genomics)的空间转录组分析显示心肌梗死后梗死区Htra3高表达,提示心肌重构可能存在空间调控(Fig 6a)。与WT小鼠相比,Htra3 KO小鼠心肌梗死后出现严重的心脏重构(Fig 6b)。超声心动图分析显示Htra3KO小鼠表现出明显的心脏扩张和收缩功能障碍 (Fig 6c)。通过对野生型和Htra3 KO小鼠假手术或MI手术后心脏组织的空间转录组分析,发现了具有空间定位特征的特定基因集群(Fig.6d)和特异性表达谱Htra3(Fig. 6e)。MI诱导了线粒体中簇1基因的表达 (Fig. 6d, e)。Htra3 KO小鼠心肌梗死后,与梗死区对应的簇2区域扩大(Fig. 6d)。利用scRNA-seq图谱对空间定位点进行反螺旋分析,表明成纤维细胞在聚类2的区域高度富集(Fig. 6f)。作者还利用scRNA-seq谱对MI后心肌细胞进行了轨迹分析,发现MI诱导的心肌细胞以TGF-β信号相关分子和分泌因子的表达为特征 (Fig. 6g, h)。空间转录组分析显示,这些基因与细胞外基质基因在心肌梗死后Htra3 KO小鼠的梗死区特异激活 (Fig. 6i)。提示Htra3下调可促进心肌纤维化,诱导梗死区心肌细胞分泌表型。
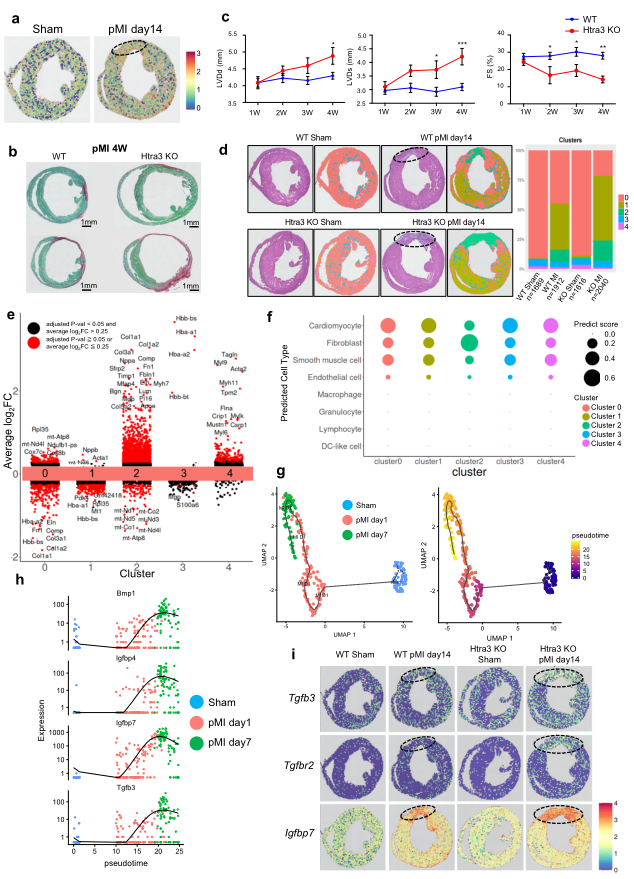
Fig6 空间转录组分析揭示Htra3抑制介导的衰老衰竭心肌细胞空间诱导
7、 沉默外泌体来源的circTRPS1通过GLS1调控抑制了BCa在体内的生长和转移
UMAP绘图和基于图形的聚类将心肌细胞分为3个聚类,假时间分析显示2条轨迹(Fig 7a, b)。轨迹1和轨迹2分别对应C1到C2和C1到C3的过渡(Fig7b)。对照组心肌细胞主要属于C1,心衰患者心肌细胞主要属于C2或C3(Fig 7c)。M2富含与线粒体电子传输和ATP生物合成有关的基因(Fig 7d),在两种轨迹中都受到抑制 (Fig. 7d–f)。DNA损伤反应(CDKN1A、MDM4和RBX1)在轨迹中特异激活M2(Fig7g-i),其中M1和M2在模块活动中表现出互斥关系 (Fig. 7j)。M1还含有特异性表达于小鼠衰老心肌细胞的分泌因子(Fig.7h)。此外,M44与细胞外基质组织相关的基因富集,并在轨迹2中特异激活 (Fig. 7k-m)。衰老衰竭心肌细胞表达的细胞因子TGF-β3、LTBP4和IGFBP7的水平在心力衰竭患者中较高(取决于严重程度),移植后较低,类似于NT-proBNP(一种成熟的心力衰竭生物标志物)(Fig. 7n)。随机森林分析表明,IGFBP7蛋白在非晚期心力衰竭和晚期心力衰竭的分类中起着最重要的作用(Fig.7o)。受体工作特征分析显示NT-proBNP有更好的诊断心力衰竭的能力,而IGFBP7有更高的能力来判断心力衰竭的严重程度(Fig.7p, q)。这些结果表明,从衰竭的心肌细胞分泌的IGFBP7是一种有用的人类晚期心力衰竭的生物标志物。
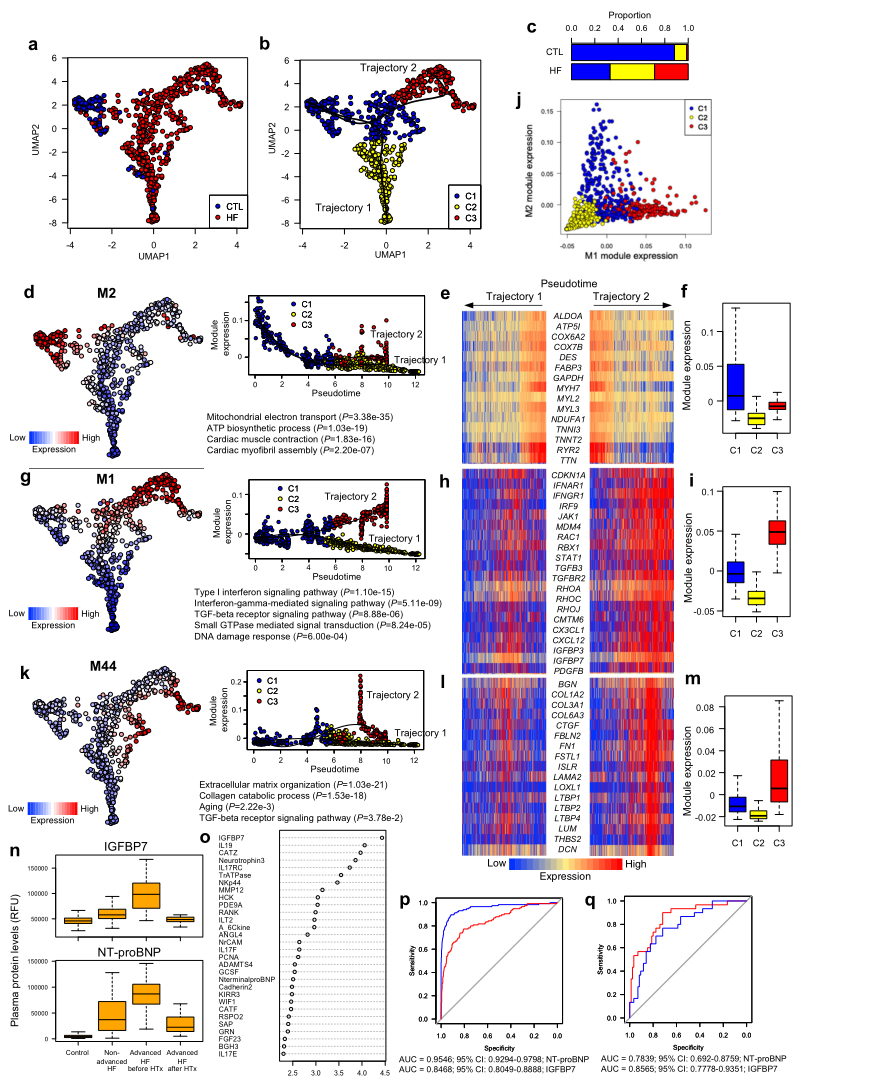
Fig7 心衰患者的单心肌细胞RNA-seq和血浆蛋白组分析
综上所述,本文发现了一些由衰竭心肌细胞分泌的与心力衰竭严重程度相关的分泌因子。作者证明了心脏成纤维细胞通过诱导不仅在心脏衰竭的发展中发挥重要作用,心肌细胞也通过Htra3-TGF-β-IGFBP7轴分泌表型。有利于推动有关心力衰竭发病机制的进一步研究。
参考文献:
Ko, T., et al., Cardiac fibroblasts regulate the development of heart failure via Htra3-TGF-beta-IGFBP7 axis. Nat Commun, 2022. 13(1): p. 3275.






