间歇性禁食不仅能减重还能预防痴呆?
血管性痴呆(VaD)是全球第二大常见的痴呆病因。与生活习惯相关的风险因素对VaD的贡献越来越大,这表明基因-环境的相互作用。因而本研究旨在探究慢性脑灌注不足(CCH)的VaD小鼠模型中的DNA甲基化景观。作为基因-环境相互作用之间的联系,间歇性禁食(IF)作为一种预防性干预被引入。本研究帮助我们了解IF如何保护大脑不受CCH损伤并有望为减轻VaD的神经病理和认知缺陷提供潜在的有益作用。本文于2022年3月发表在《Theranostics》IF:11.556期刊上。
技术路线:

主要实验结果:
1、在生理条件下IF诱导代谢转换提高工作记忆并调节DNA甲基化景观
为验证IF实施的有效性,首先定期检测了小鼠的体重,血糖和酮水平,结果显示,和随意饮食(AL)喂养小鼠比较,IF小鼠的体重/摄食量、血糖水平均显著下降,酮水平显著升高。表明IF小鼠发生代谢转换。
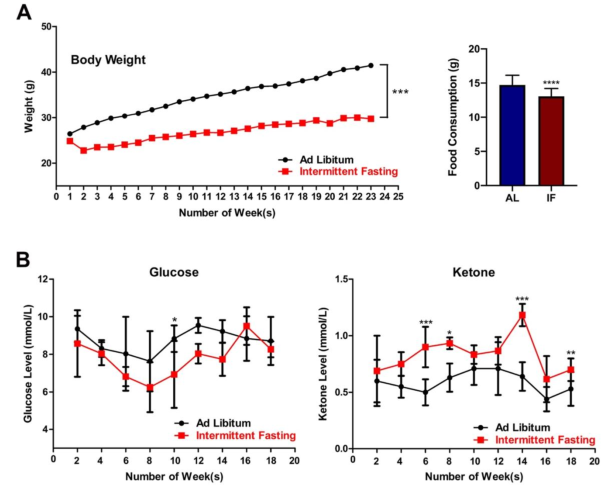
附图1在CCH生理条件下IF对小鼠的影响
为了探究在正常生理调节下IF是否可以改善认知功能和调节DNA甲基化景观,对AL野生小鼠(ALWT)和IF野生小鼠(IFWT)进行行为学测试和RRBS实验。结果显示,和ALWT比较,IFWT组的的学习能力更强(图1A-1C),并且这种能力改变不是由于运动能力受损(图1D)。
DNA甲基化包括三种:CG,CHG,CHH。如图1E展示了ALWT和IFWT小鼠在CG和非CG水平的差异甲基化基因(DMGs),IFWT小鼠的甲基化状态偏向低甲基化状态。与ALWT小鼠相比,IFWT小鼠的差异甲基化区域(DMRs)总体甲基化水平较低(图1F-K)。为探究DNA甲基转移酶(DNMT)和脱甲基酶,作者检测了DNMT1,DNMT3A,DNMT3B和TET1的丰度,与AL鼠比较,前三者的丰度在IF小鼠中上调,后者则显著下调(图1L)。表明DNMTs和TET1在生理状态下调节DMGs的表达。
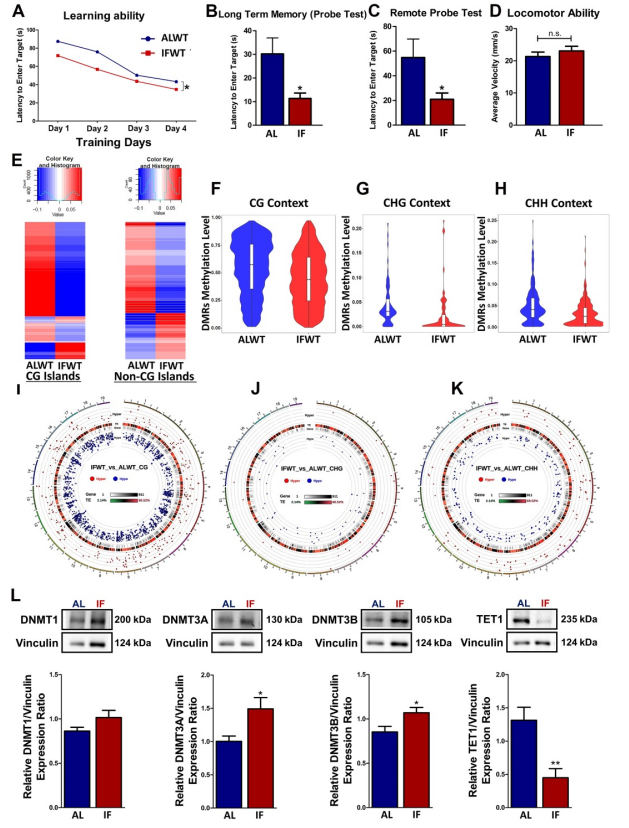
图1间歇性禁食改善认知功能和调节生理条件下的DNA甲基化景观
2、IF可减轻CCH患者的认知功能障碍和神经病理改变
为探究IF在VaD的CCH模型中的作用,评估了认知功能和神经病理(图2A)。与AL sham组比较,AL喂养鼠构建的CCH(AL BCAS)小鼠表现出更差的学习能力和更长的潜伏期,而IF BCAS鼠则学习能力更强,潜伏期更短,且这种潜伏期改变不是由于运动能力受损(图2B)。这些表明IF可改善认知功能。
图2C-D表明在所有不同的时间点,AL BCAS小鼠的白质病变均显著高于AL Sham组小鼠,而白质损伤在IF BCAS小鼠中则显著减少。CCH 诱导的神经元丢失在 AL BCAS 小鼠的海马 CA1、CA2 和 CA3 区域中很明显,而AL Sham显示正常的神经元细胞体,在所有三个海马区都有不同的细胞核、核仁和密集的神经元,而IF BCAS 小鼠的神经元损失较少(图2E-F)。表明IF改善神经病理损伤。
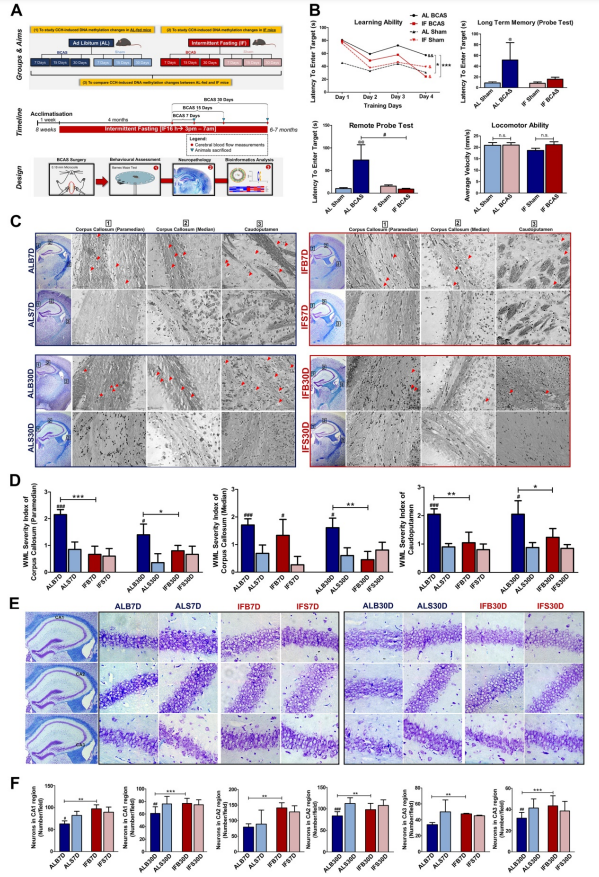
图2间接性禁食可减轻慢性脑灌注不足患者的认知功能障碍和神经病理改变
3、CCH条件下的DNA甲基化景观改变被预防性IF校正
为了研究CCH下的DNA甲基化情况,进行了RRBS实验,并对数据进行了分析(图3)。根据DMGs绘制的热图,AL BCAS小鼠的整体DNA甲基化模式与相应的sham有明显的偏差(图3A)。这种与对照组差异甲基化的偏差在AL BCAS小鼠的所有三个时间点都一致观察到。如果使用IF,BCAS小鼠与AL BCAS小鼠的甲基化图谱出现偏差(图3B)。圆环图显示,在AL BCAS小鼠的三个不同时间点上,基因低甲基化趋势一致增加(图3C)。除了这些视觉证据外,AL BCAS小鼠在7、15和30天时间点分别特有427、379和377个差异甲基化基因(图4A)。此外,41个基因在三个不同的时间点上的差异甲基化共享。这些结果表明在CCH状态下,总体DNA甲基化景观发生了改变。
与喂食 AL 的小鼠相比,在接受 CCH 的 IF 小鼠的三个时间点上观察到的低甲基化趋势一致下降(图3D),表明甲基化趋势发生逆转。有538、318和328个DMGs分别为IF BCAS小鼠7、15和30天时间点所独有(图4B)。45 个基因在三个不同的时间点均发生差异甲基化。因此,在CCH条件下被改变的DNA甲基化格局在引入预防性IF后被进一步校正。
此外,为了确定DNA甲基转移酶和去甲基化酶是否在CCH病理状态下调节基因差异甲基化中发挥作用,研究了DNMT1、DNMT3A、DNMT3B和TET1的丰度。与AL BCAS小鼠相比,在30天时间点,IF BCAS小鼠的所有三种DNMTs和TET1均显示有统计学意义的增加(图3E)。这一发现强调了DNMTs和TET1通过引入IF在CCH调控DMGs表达中发挥作用。
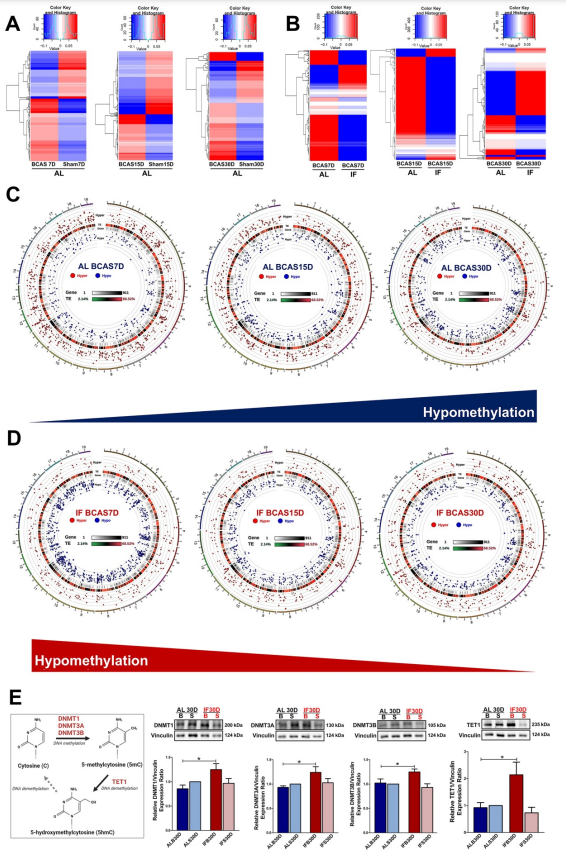
图3 间歇性禁食调节慢性脑灌注不足下DNA甲基化的异常变化
4、预防性IF提示CCH状态下启动子区DNA甲基化状态发生逆转
作者分别分析了高甲基化hyper-和低甲基化hypo-基因,以缩小它们在CCH下的潜在功能。AL条件下共有929个基因发生高甲基化,771个基因发生低甲基化(图4A)。ACTN1和GNAS的基因表达用于验证甲基化状态(图4C)。此外,在IF条件下有599个基因高甲基化,1113个基因低甲基化(图4B)。值得注意的是,根据文献证据,这些基因大多数与痴呆症或其他神经退行性疾病有关。且MRP4的基因表达已被验证为甲基化状态(图4C)。
为了研究IF对DNA甲基化的影响,分析了CCH病理状态下和预防性IF下的差异甲基化基因(DMGs)。CCH状态共检测到355个DMGs,其中7、15和30天时间点分别有107、104和104个DMGs是唯一的,3个不同时间点有5个DMGs重叠(图4D)。与饲喂AL的CCH小鼠相比,饲喂预防性IF的小鼠共检测到348种DMGs。在这些DMGs中,分别有121、86和97个DMGs在7、15和30天时间点是唯一的,4个DMGs在三个时间点重叠(图4E)。对重叠的DMGs进一步分析其甲基化状态,以观察是否存在时间调控(图4F)。基因甲基化水平的时间调控对每个基因都是独特的,在某些情况下(如DDX3Y, GNAS, PAX6, ZRSR1),这种变化足以从高甲基化状态切换到低甲基化状态或反之亦然。
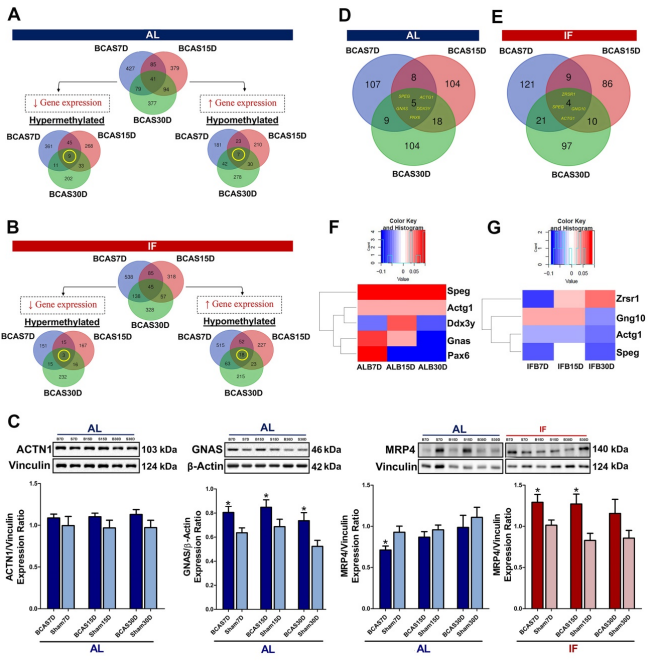
图4 间歇性禁食提示慢性脑灌注不足下启动子区DNA甲基化状态发生逆转
参考文献:
Selvaraji, Sharmelee et al. “Time-restricted feeding modulates the DNA methylation landscape, attenuates hallmark neuropathology and cognitive impairment in a mouse model of vascular dementia.” Theranostics vol. 12,7 3007-3023. 21 Mar. 2022, doi:10.7150/thno.71815






