鼠乳杆菌减轻肠道缺血/再灌注损伤
肠道缺血/再灌注(I/R)损伤具有较高的发病率和死亡率。肠道微生物群是影响肠道I/R损伤的潜在关键因素。不同人群对肠道I/R损伤表现出不同的敏感性。然而,这种种群间的差异是否与肠道微生物群的变异有关尚不清楚。在本文中,肠I/R敏感(Sen)和肠I/R耐受(Res)小鼠首先根据肠I/R小鼠的不同生存结局进行定义。结果表明,肠缺血前Sen和Res小鼠粪便微生物群落组成和多样性存在差异。鼠乳杆菌(Lactobacillus murinus, L. murinus)在物种水平上的相对丰度在Res组显著高于Sen组。临床上,体外循环手术患者术前粪便中鼠乳杆菌的丰度与术后肠道I/R损伤程度密切相关。L. murinus治疗显著预防了肠道I/R诱导的肠道损伤,提高了小鼠的生存,这依赖于巨噬细胞的参与。此外,体外实验表明,通过TLR2促进巨噬细胞释放IL-10可能是鼠乳杆菌减轻肠道I/R损伤的潜在机制。本研究揭示了肠道I/R损伤的新机制,为临床实践提供了新的治疗策略。本文于2022年3月发表于“Microbiome”(IF=14.652)杂志上。
技术路线

结果:
1)Sen和Res小鼠肠道组织损伤及肠道菌群特征
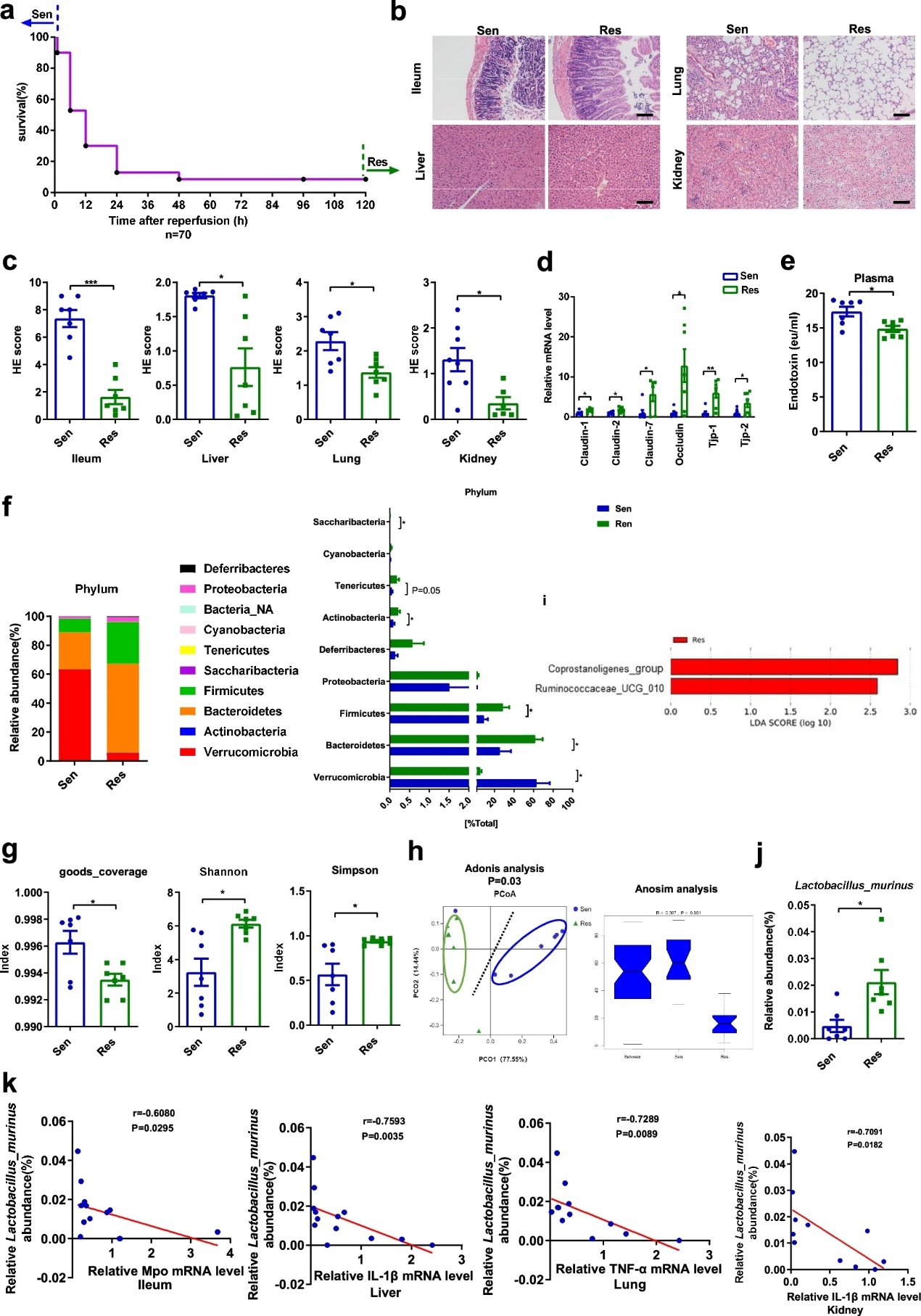
观察小鼠肠I/R损伤后的存活率,发现小鼠对肠I/R损伤的易感性有明显差异。再灌注后1小时内死亡的小鼠被定义为“Sen小鼠”,而存活5天的小鼠被定义为“Res小鼠”(图1a)。与Res小鼠相比,Sen小鼠回肠、肝、肺、肾组织病理损伤和组织学评分明显加重,Il-1β、Il-6、Tnf-α mRNA表达上调。(图1b、c)。此外,与Sen小鼠相比,Res小鼠回肠肠道紧密连接标记物mRNA水平显著升高,血浆内毒素水平降低(图1d, e)。16S DNA测序结果显示,Sen和Res小鼠粪便样本中的细菌组成在细菌门和细菌纲上均有显著差异(图1f)。Alpha多样性分析和主坐标分析(PCoA)表明,Sen和Res小鼠的肠道微生物群落整体结构存在显著差异(图1g, h)。LEfSe分析显示,在属水平上,Res小鼠的Coprostanolignes-group和Ruminococcaceae-UCG-010的相对丰度高于Sen小鼠 (图1i)。此外,在物种水平上,鼠乳杆菌在Res的相对丰度是Sen小鼠的4倍,变化最大(图1j)。鼠乳杆菌的相对丰度与肠道I/R损伤的炎症因子呈负相关(图1k)。
2)Res小鼠肠道菌群可独立减轻I/R诱导的组织损伤
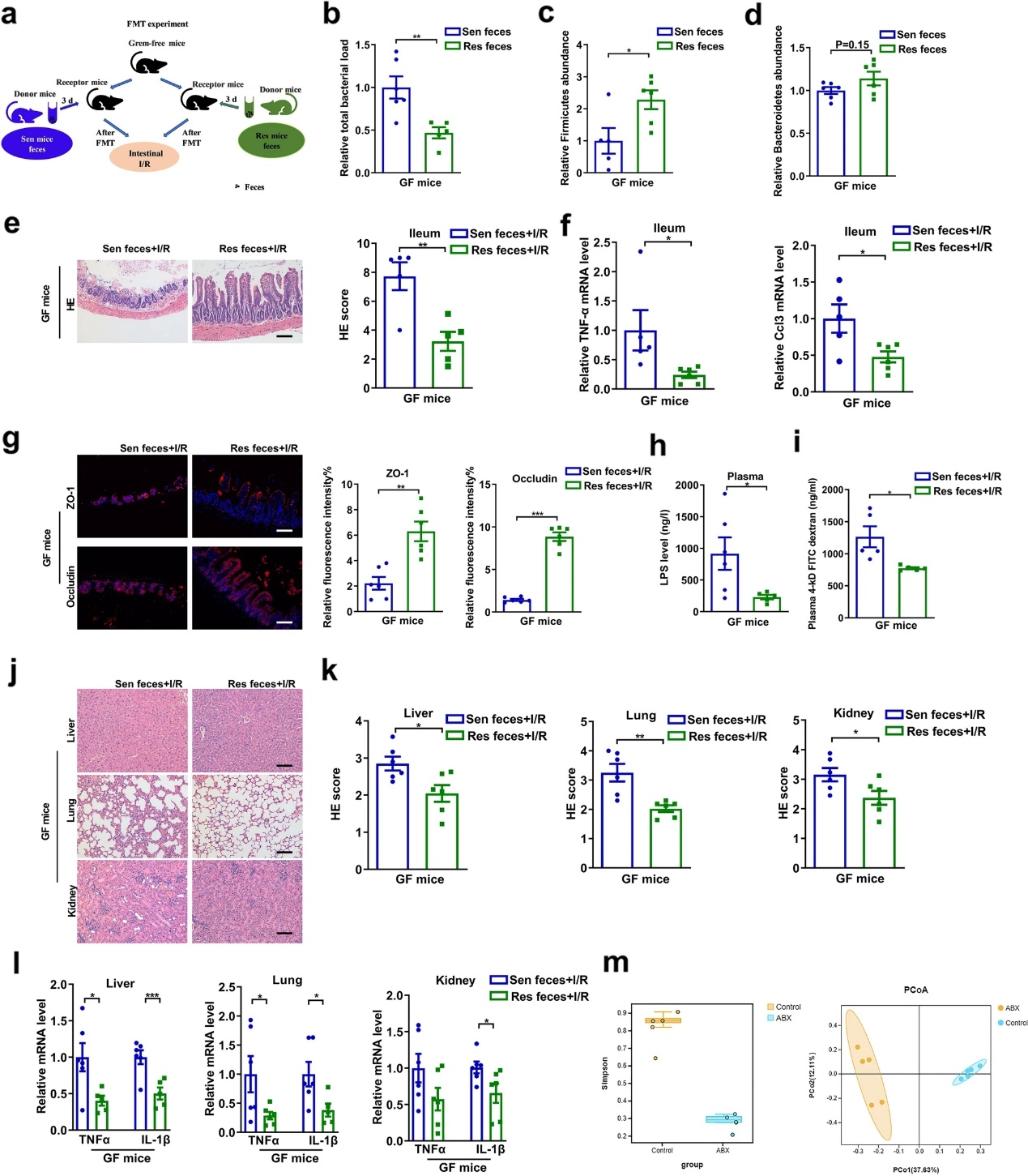
通过FMT实验进一步证明肠道菌群在肠道I/R损伤中发挥重要作用(图2a)。于FMT后第三天收集受体小鼠粪便。接收Sen小鼠粪便的GF小鼠(Sen粪便组)与接收Res小鼠粪便的GF小鼠(Res粪便组)相比,厚壁菌门水平显著下降,相对总细菌载量增加(图2b-d)。上述结果表明,FMT实验是成功的。FMT 3天后进行肠I/R。与Sen粪便+I/R组相比,Res粪便+ I/R组肠组织病理损伤、Chiu评分及回肠Tnf-α、Ccl3 mRNA水平均显著降低(图2e, f)。如图2g-i所示,Res粪便+ I/R组回肠ZO-1和occludin mRNA和蛋白水平高于Sen粪便+ I/R组,血浆LPS水平和FD-4通透性较低。此外,与Sen粪便+ I/R组相比,Res粪便+I/R组肝、肺、肾组织病理损伤和炎症因子mRNA水平均降低(图2j-l)。此外,α和β多样性分析显示,ABX处理的小鼠肠道微生物多样性显著低于对照组小鼠,且可以完全聚类(图2m)。FMT实验证实,肠道缺血前的肠道菌群与肠道I/R术后的结局密切相关。
3)鼠乳杆菌可减轻肠道I/R引起的肠道损伤
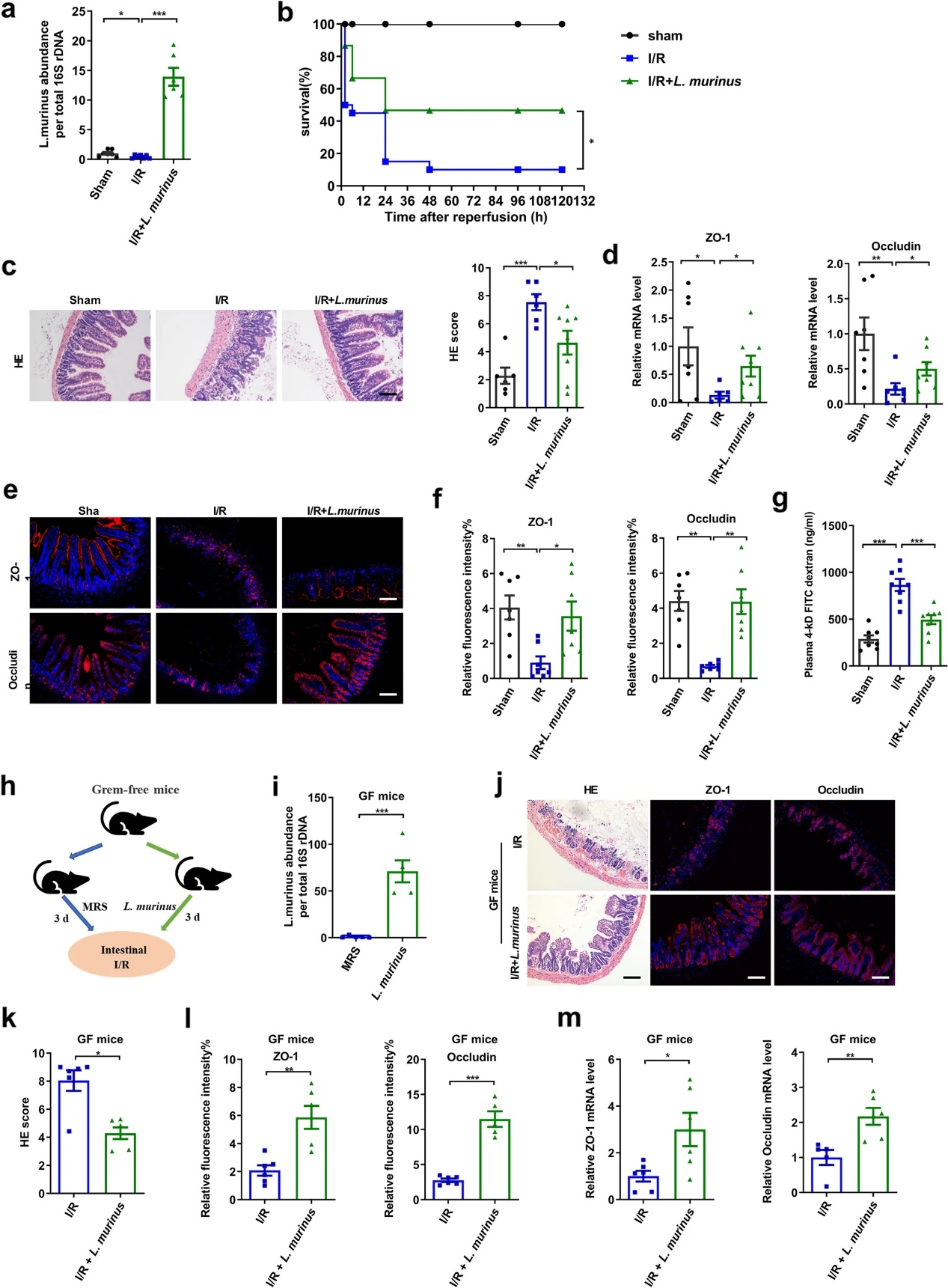
16S rRNA基因测序分析发现,鼠乳杆菌在Res小鼠中的相对丰度是Sen小鼠的4倍(图1j)。此外,肠道I/R后,该物种的相对丰度显著下降 (图3a)。这一结果促使我们研究口服鼠乳杆菌是否可以改善肠道I R引起的肠道损伤。与I/R小鼠相比,鼠乳杆菌处理显著增加了盲肠中鼠乳杆菌的相对丰度,提高了存活率,减少了组织病理学损伤(图3a-c)。与I/R小鼠相比,I/R+鼠乳杆菌和假手术小鼠ZO-1和occludin mRNA和蛋白水平显著升高,FD-4通透性降低(图3d-g)。为了进一步证明单株鼠乳杆菌在肠道I/R中的作用,在I/R之前,GF小鼠灌胃鼠乳杆菌3天(图3h)。RT-PCR结果显示,鼠乳杆菌处理的GF小鼠粪便中鼠乳杆菌的相对丰度高于MRS培养基处理的GF小鼠(图3i)。如图3j-m所示,鼠乳杆菌可减轻GF小鼠I/R后肠道病理损伤,回肠ZO-1和occludin mRNA和蛋白水平升高。上述结果表明,鼠乳杆菌能减轻GF小鼠肠道I/R诱导的肠道损伤。
4)鼠乳杆菌与体外循环术后肠道损伤的关系
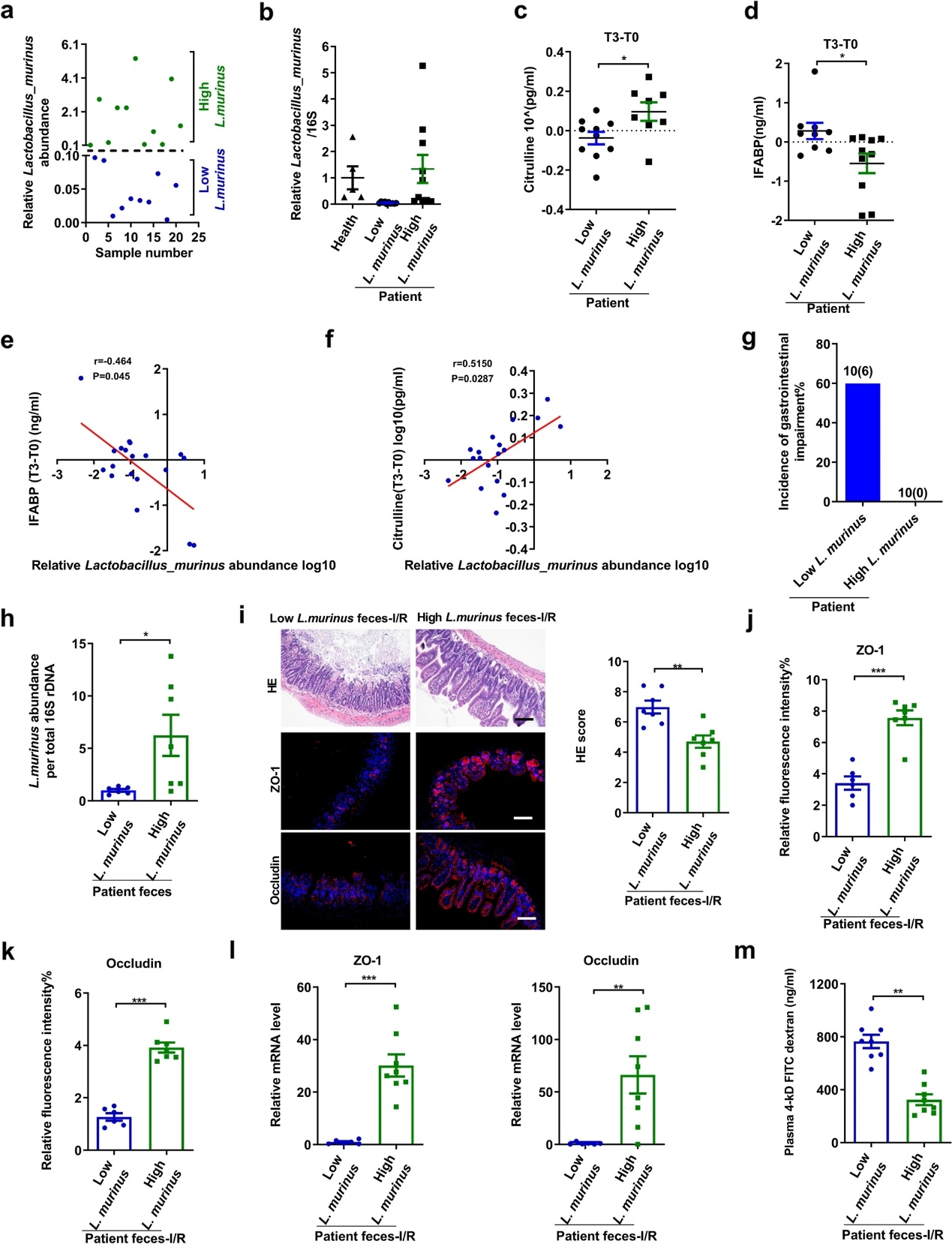
在接受心脏手术的患者中,体外循环可能会导致肠道缺血和损伤;因此,本研究将其作为肠I/R的临床模型。首先,将体外循环手术患者术前粪便中血乳杆菌的相对丰度分为低(小于0.1)和高(大于0.1)两类(图4a,b)。两组血浆瓜氨酸和IFABP浓度均被测量为人体吸收肠上皮细胞量和肠衰竭的标记物。如图4c-f所示,体外循环手术患者术前粪便中鼠乳杆菌的丰度与术后6 h IFABP浓度变化呈负相关,与瓜氨酸浓度变化呈正相关。术后7天进一步评估患者胃肠功能,低鼠乳杆菌丰度组患者胃肠损伤发生率为60%。相比之下,高鼠乳杆菌丰度组患者在临床上无胃肠道并发症发生(图4g)。为了进一步证明鼠乳杆菌在改善肠道损伤中的作用,进行了一项FMT实验,将术前从鼠乳杆菌高丰度组和鼠乳杆菌低丰度组收集的粪便细菌分别移植到小鼠体内,并相应地分为鼠乳杆菌高丰度组和鼠乳杆菌低丰度组。RT-PCR显示,FMT后,高鼠乳杆菌粪便组中鼠乳杆菌的相对丰度显著高于低鼠乳杆菌粪便组(图4h)。与低浓度鼠乳杆菌粪便组相比,高浓度鼠乳杆菌粪便组显著降低了I/R诱导的肠道病理损伤和通过血浆FD-4水平测定的肠道通透性,并增加了回肠中ZO-1和occludin的mRNA和蛋白质水平(图4i–m)。
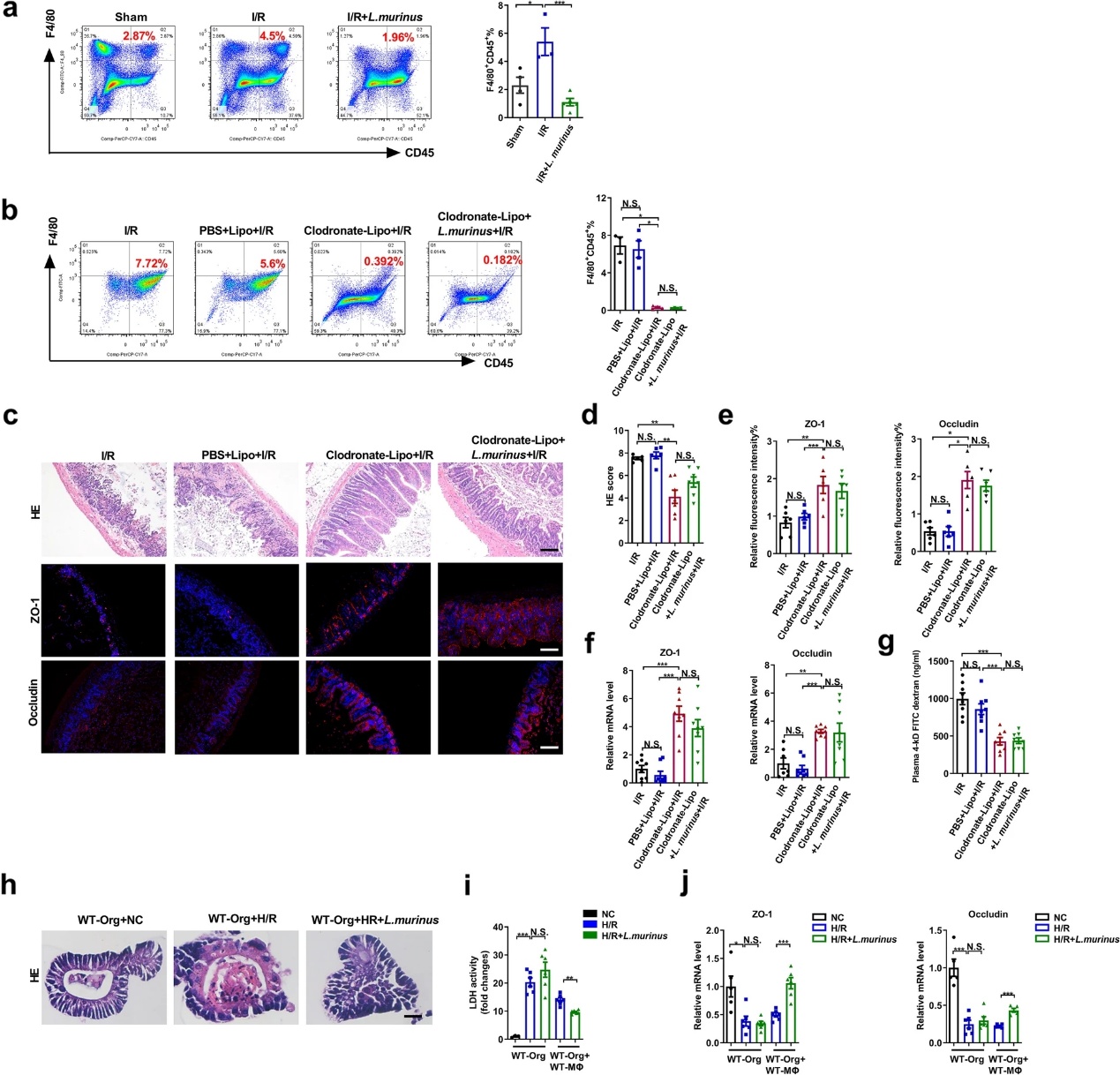
5)小鼠肠道I/R损伤的改善依赖于巨噬细胞的参与
上述动物和临床实验结果证实,鼠乳杆菌对肠内I/R损伤有保护作用;然而,其机制尚未阐明。鼠乳杆菌影响免疫反应;然而,它是否调节肠道I/R中的巨噬细胞尚不清楚。流式细胞术结果显示,肠道I/R诱导巨噬细胞数量显著增加(F4/80+CD45+),这种效应被鼠乳杆菌治疗逆转(图5a)。为了进一步验证小鼠乳杆菌的保护作用是否与巨噬细胞有关,在I/R前2天,给小鼠腹腔注射氯膦酸二钠脂质体以消耗巨噬细胞。与I/R小鼠和PBS Lipo+I/R组相比,氯膦酸二钠脂质体+I/R组的巨噬细胞数量减少(图5b),I/R引发的组织病理学损伤减少,ZO-1和occludin的mRNA和蛋白质水平上调(图5c-f),以及血浆FD-4水平测定的肠道通透性降低(图5g),但与氯膦酸二钠脂质体+鼠乳杆菌+I/R组相比,无统计学差异。建立小肠类器官的H/R模型以进一步证实小鼠的结果。如图5h,i所示,在H/R后,在巨噬细胞和类器官共培养体系中,鼠乳杆菌降低了肠道形态损伤和LDH水平,并增加了ZO-1和occludin的mRNA水平(图5j),但在单独培养的类器官中对这些因子没有明显影响。与体内实验结果一致,鼠乳杆菌对肠道I/R损伤的保护作用可能依赖于巨噬细胞的参与。
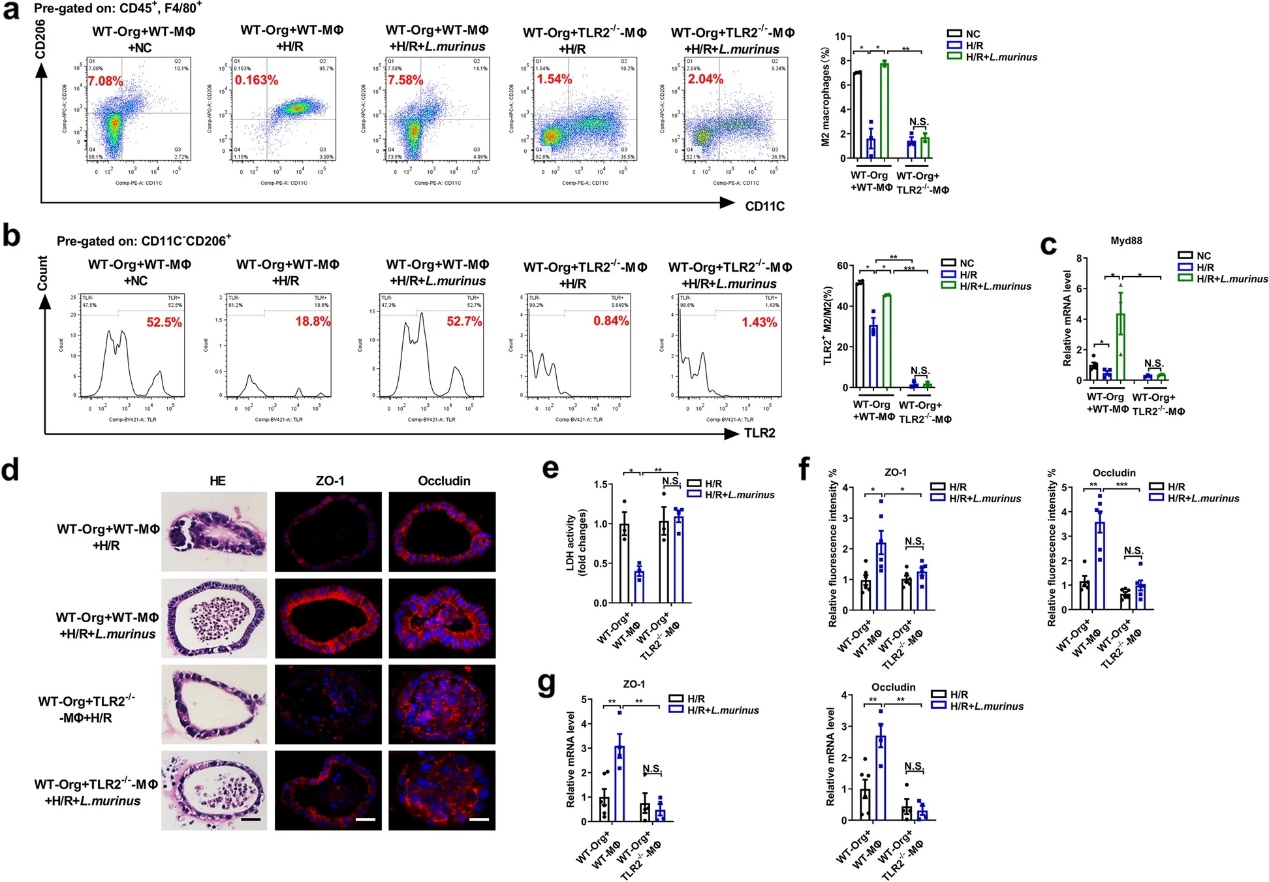
6)鼠乳杆菌可通过TLR2信号途径促进巨噬细胞释放IL-10,从而减轻类器官H/R损伤
我们已经证实小鼠乳杆菌对肠I/R损伤的保护作用可能依赖于巨噬细胞的参与;因此,我们探索了巨噬细胞在小肠类器官中的具体机制。建立从TLR2-/-、IL-10- /-或WT小鼠中提取的巨噬细胞与WT小鼠中提取的类器官的transwell共培养体系。我们发现,在WT-MΦ和WT-Org共培养体系中,鼠乳杆菌处理增加了H/R后M2巨噬细胞的比例,增加了M2巨噬细胞表面TLR2的表达,增加了Myd88 mRNA的水平(图6a-c)。在WT-MΦ和WT-Org共培养系统中,鼠乳杆菌降低了类器官病理损伤和LDH水平,同时增加了ZO-1和occludin的mRNA和蛋白质水平(图6d-g)。此外,流式细胞术结果显示,鼠乳杆菌抑制了WT-MΦ和WT-Org的transwell共培养系统中H/R诱导的IL-10+M2巨噬细胞/总M2巨噬细胞比例的下降(图7a)。在H/R后,WT-MΦ和WT-Org共培养系统中,鼠乳杆菌降低了类器官病理损伤和LDH水平,同时增加了ZO-1和occludin的mRNA和蛋白质水平(图7b-e)。上述结果表明,小鼠乳杆菌可能通过TLR2信号途径促进M2巨噬细胞释放IL-10,从而减轻巨噬细胞和类器官共培养系统中类器官H/R损伤。
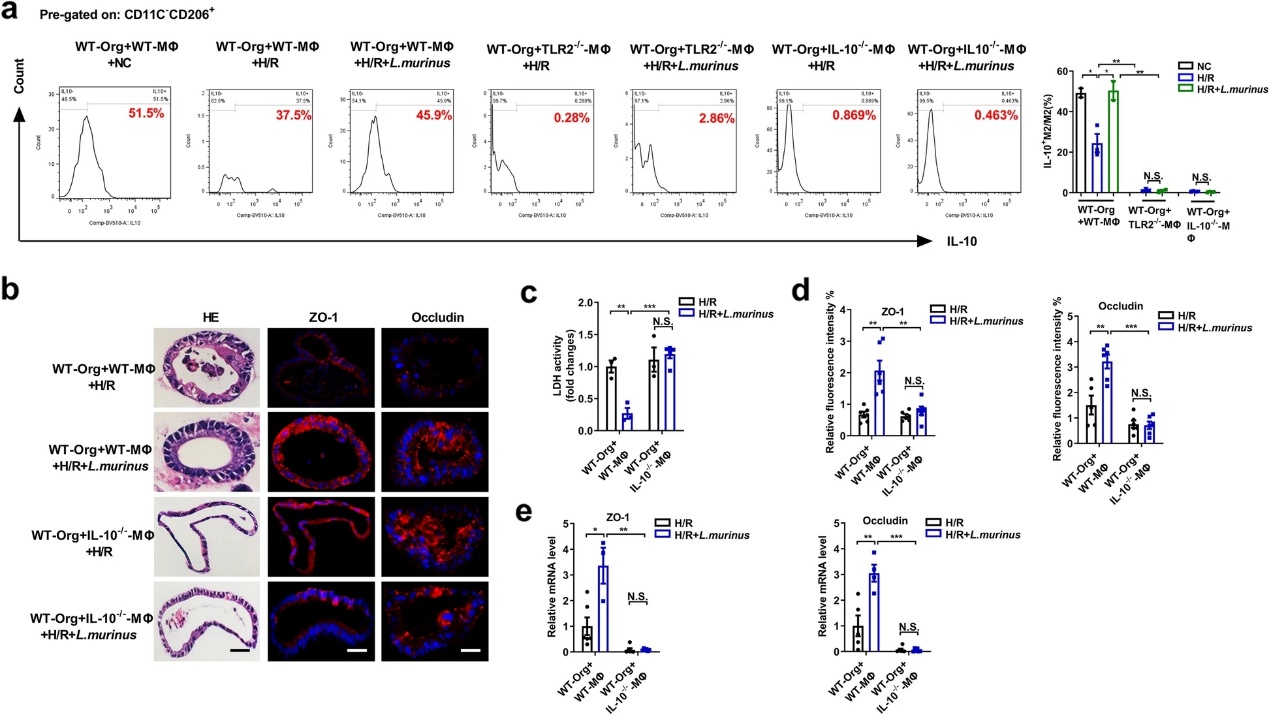
结论:肠道微生物群参与了肠I/R术后的结局。鼠乳杆菌通过巨噬细胞减轻肠I/R损伤,通过TLR2促进巨噬细胞释放IL-10可能是鼠乳杆菌在体外改善类器官H/R损伤的潜在机制。这项研究揭示了肠道I/R损伤的一种新机制,并表明通过靶向微生物的治疗是预防肠道I/R损伤的一种有希望的策略。
参考文献:
Hu J, Deng F, Zhao B, Lin Z, Sun Q, Yang X, Wu M, Qiu S, Chen Y, Yan Z, Luo S, Zhao J, Liu W, Li C, Liu KX. Lactobacillus murinus alleviate intestinal ischemia/reperfusion injury through promoting the release of interleukin-10 from M2 macrophages via Toll-like receptor 2 signaling. Microbiome. 2022 Mar 3;10(1):38. doi: 10.1186/s40168-022-01227-w.






