外泌体来源的CircTRPS1在膀胱癌微环境中促进恶性表型和CD8+ T细胞衰竭
环状RNA (CircRNAs)在不同疾病中发挥着重要作用。外泌体是细胞间通讯的重要中间体。虽然两者在癌症中都有广泛报道,但外泌体来源的环状RNA很少被研究。本研究中,作者通过高通量测序确定了膀胱癌(BCa)组织和外泌体中不同表达的环状RNA对BCa的影响。本文于2022年3月发表于《Molecular Therapy》,IF= 8.986。
本文技术路线:

本文主要内容:
1 CircTRPS1在BCa肿瘤和外泌体中作为预后相关的上调CircRNA
作者从4个BCa组织中提取总RNA,并将其与正常组织配对,以识别在BCa中具有重要生物学功能的环状RNA (Fig 1A)。其中CircTRPS1 (hsa_ Circ_0085361)是所有差异表达CircRNA中差异表达最显著的(Fig. 1B)。CircTRPS1的基因组定位为chr 8 nc_000008.11: 115382382 -115,695,751,来源于TRPS1基因(Fig 1C)。放线菌素D处理表明TRPS1的环状RNA形式比线性形式更稳定(Fig 1D)。核糖核酸酶R降低了BCa细胞系中线性TRPS1 mRNA的水平,而对CircTRPS1的水平没有影响,进一步证实了CircTRPS1结构(Fig 1E)。此外,CircTRPS1主要位于细胞质中(Fig 1F)。Kaplan-Meier图显示高表达的CircTRPS1与较低的总生存率相关(Fig 1G)。有趣的是,CircTRPS1 在BCa肿瘤组织的积累不仅限制在细胞质中,而且在一些细胞膜和细胞间隙观察到CircTRPS1信号,这表明CircTRPS1在BCa微环境中聚集在外泌体中发挥生物功能(Fig 1H)。此外还发现CircTRPS1在尿源性外泌体中的表达与BCa的临床分期呈正相关(Fig 1I-K)。
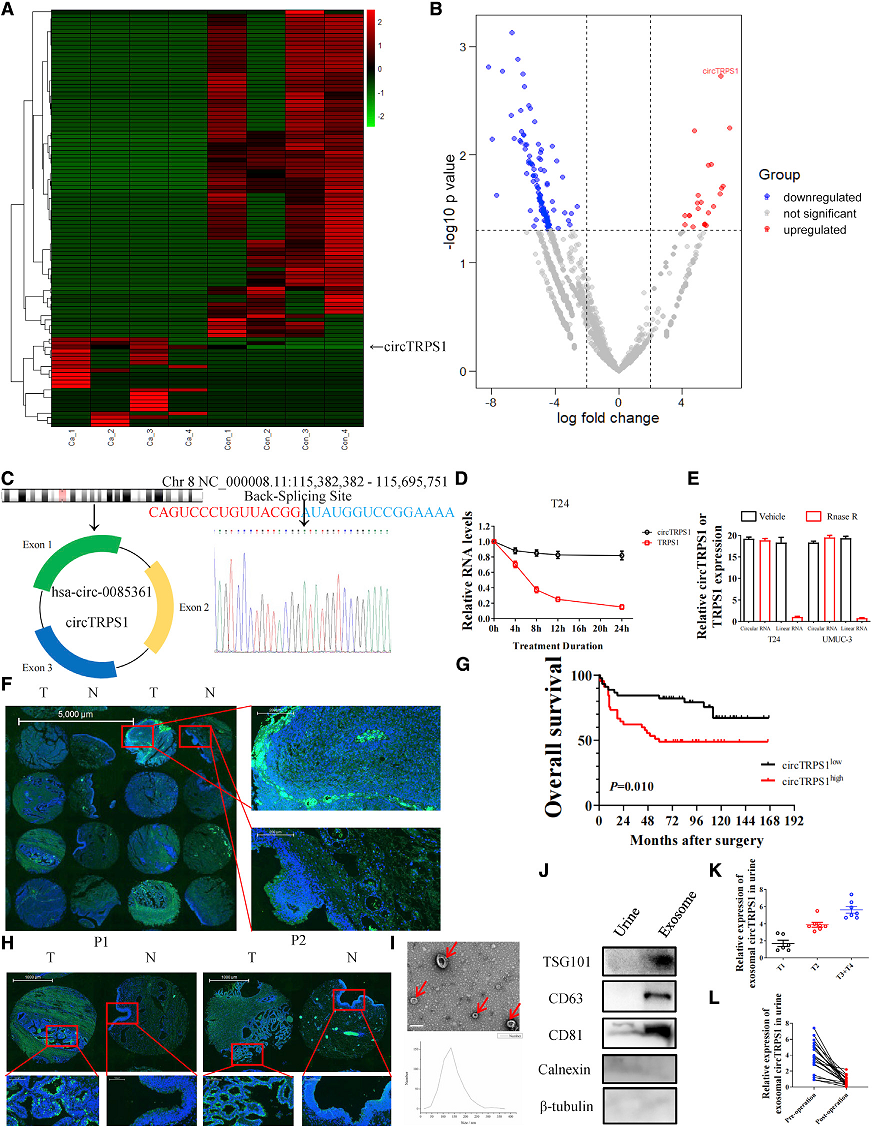
Fig1 CircTRPS1在BCa肿瘤和外泌体中作为预后相关的CircRNA上调
2、外泌体来源的CircTRPS1在体外促进BCa细胞的增殖和侵袭
与泌尿上皮细胞系(SV-HUC-1)比较,CircTRPS1在5种膀胱癌转移的细胞癌细胞系(RT4、UM-UC-3、T24、5637、J82)中高表达(Fig 2A)。CCK-8实验证实CircTRPS1敲低显著抑制BCa细胞的增殖(Fig 2B,C),5-EdU测定得到相似结果(Fig. 2D)。作者进一步分析发现CircTRPS1敲低后,细胞凋亡率显著增加,这表明si-CircTRPS1对细胞凋亡有轻微的抑制作用(Fig. 2E)。与SV-HUC-1细胞相比,BCa细胞来源的外显子中CircTRPS1表达更高(Fig 2F)。电子显微镜分析发现通过表达外泌体标志物TSG101、CD63和CD81(Fig 2H)。此外,作者用PKH67标记BCa细胞来源的外泌体,并将外泌体与癌细胞孵育。在BCa细胞中观察到几个密集的PKH67,表明外泌体被内吞到BCa细胞中 (Fig 2I)。si- CircTRPS1转染的T24和来自外泌体的UMUC-3细胞减少了增殖和侵袭(Fig 2J,K)。

Fig2 外泌体来源的CircTRPCircTRPS1作为miR-141-3p的海绵在体外促进BCa细胞的增殖和侵袭
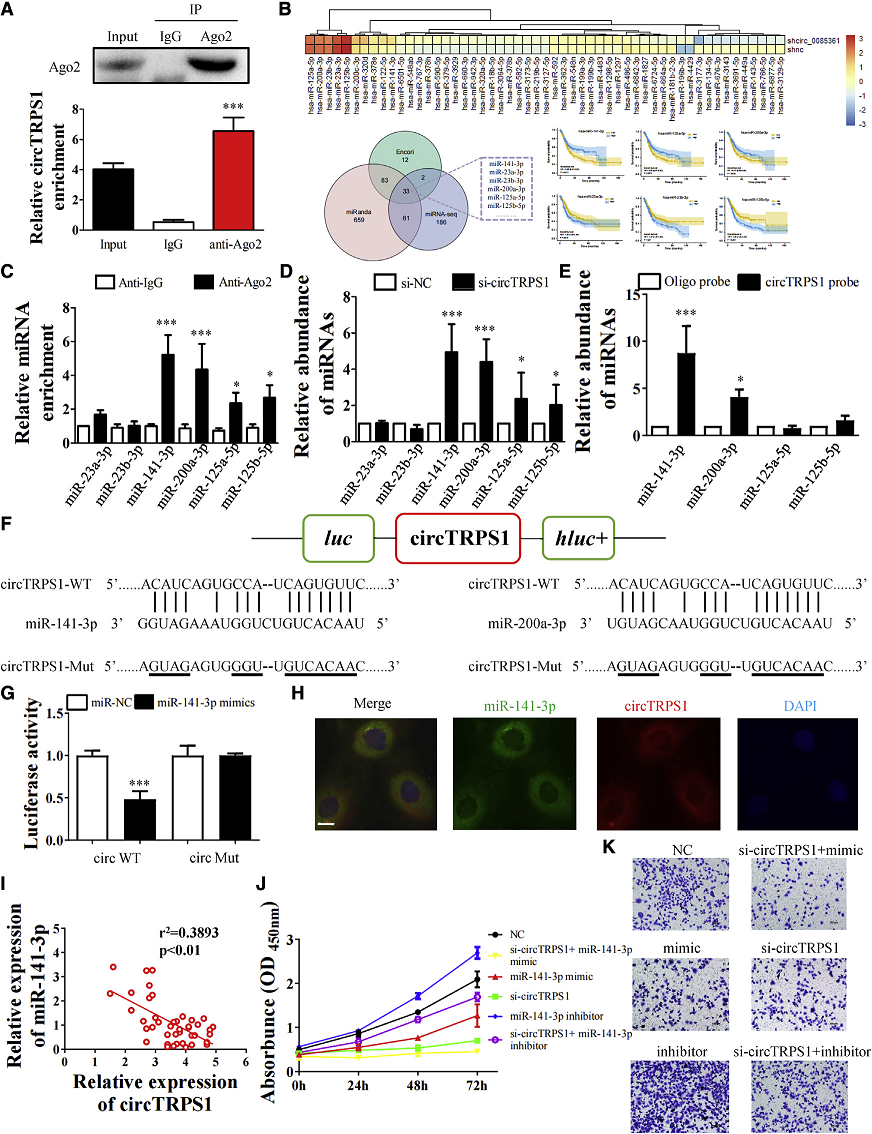
3. CircTRPS1作为miR-141-3p的海绵
AGO2 RIP测定T24细胞显示内源性的CircTRPS1被富集(Fig 3A),这表明miRNA可能与CircTRPS1结合。作者进行了miRNA测序,发现CircTRPS1敲除后差异表达的miRNA。通过生信分析筛选出miR-23b-3p、miR-141-3p、miR-200a-3p、miR-125a-5p和miR-125b-5p是与CircTRPS1相关的潜在miRNAs,在H1299细胞中使用CircHMGB2探针进行CircRIP,通过qRT-PCR观察miR-181a-5p的显著富集(Fig 3a)。通过RIP进一步验证CircHMGB2和miR-181a-5p之间的相互作用,发现抗AGO2抗体显著富集了CircHMGB2和miR-181a-5p (Fig 3B),而这些miRNA均与BCa预后相关。通过AGO2 RIP对富集的miRNA进行qRT-PCR,发现miR-141-3p和miR-200a-3p是AGO2-CircTRPS1复合物中最丰富的miRNA(Fig. 3C)。同样的,miR-141-3p和miR-200a-3p在CircTRPS1敲低BCa细胞中上调(Fig. 3D)。RNA下拉实验证实CircTRPS1与miR-141-3p的相互作用大于miR-200a-3p(Fig 3E)。作者只检索到了CircTRPS1与miR-141-3p和miR-200a-3P均有1个预测的结合位点。为了进一步验证miR-141-3p和miR-200a-3p与CircTRPS1的直接结合相互作用,作者生成了具有预测miRNA结合位点的CircTRPS1片段,并将其插入到双荧光素酶报告质粒中(Fig 3F)。miRNA模拟物导致相对荧光素活性显著降低,但在CircRNA突变组中只发现了可以忽略的荧光素活性变化(Fig 3G)。此外,FISH实验证实CircTRPS1在细胞质中与miR-141-3p共定位,表明CircTRPS1直接结合 miR-141-3p(Fig 3H)。此外,miR -141- 3p的相对表达与CircTRPS1呈负相关(Fig 3I)。接下来转染了阴性对照(NC)或CircTRPS1敲低的miR-141-3p 模拟物/抑制剂T24细胞。CCK8(Fig 3J)和Transwell实验(Fig 3K)显示miR-141-3p抑制剂促进了BCa细胞的增殖和侵袭表型,而si-CircTRPS1消除了BCa细胞的这一生物学过程。综上所述,作者的结果表明CircTRPS1作为miR-141-3p的海绵。
4. CircTRPS1通过调节GLS1的表达改变谷氨酰胺代谢,导致BCa氧化还原平衡失调
考虑到CircTRPS1敲除后显著的表型改变,作者使用代谢组学进一步研究sh-CircTRPS1 T24细胞的代谢功能障碍(Fig 4A)。在sh-CircTRPS1 T24细胞中,参与TCA循环的L-谷氨酸、GSH和几种代谢物下调(Fig 4A)。GSH代谢、糖异生、谷氨酸代谢和脂肪酸氧化是主要富集的代谢途径,这表明BCa细胞存在能量饥饿和氧化还原稳态失调(Fig 4B)。这些代谢途径都是谷氨酰胺代谢的下游。接下来从T24和T24 sh-CircTRPS1细胞的RNA-seq中观察CircTRPS1相关代谢功能障碍相关的关键酶(Fig 4C)。发现当抑制GLS1在癌细胞中的表达,细胞内谷氨酸水平显著降低,伴随着GSH和ɑ-KG降低,导致TCA循环成分减少,糖异生增加(Fig 4D)。同时发现miR-141-3p和GLS1的表达呈负相关 (Fig 4E)。双荧光素酶实验表明GLS1 mRNA与miR-141-3p直接结合(Fig4F)。TCGA中BCa患者的基因集富集分析显示,GLS1差异表达引起的能量饥饿主要影响mTOR通路(Fig 4G)。谷胱甘肽缺乏会提高细胞内ROS水平,从而降低细胞活力,类似于能量饥饿。接下来发现si-CircTRPS1 T24细胞中ROS水平显著升高,与GSH水平下降相关(Fig 4H)。有趣的是,之前关于miR-141-3p的研究表明,ROS平衡与其生物学功能相关。mir - 1413p抑制剂和GLS1过表达可以挽救CircTRPS1敲除引起的mTOR和上皮-间质转化(EMT)通路的抑制作用以及细胞内ROS水平的降低(Fig 4H),恢复氧化还原平衡(Fig 4I)。
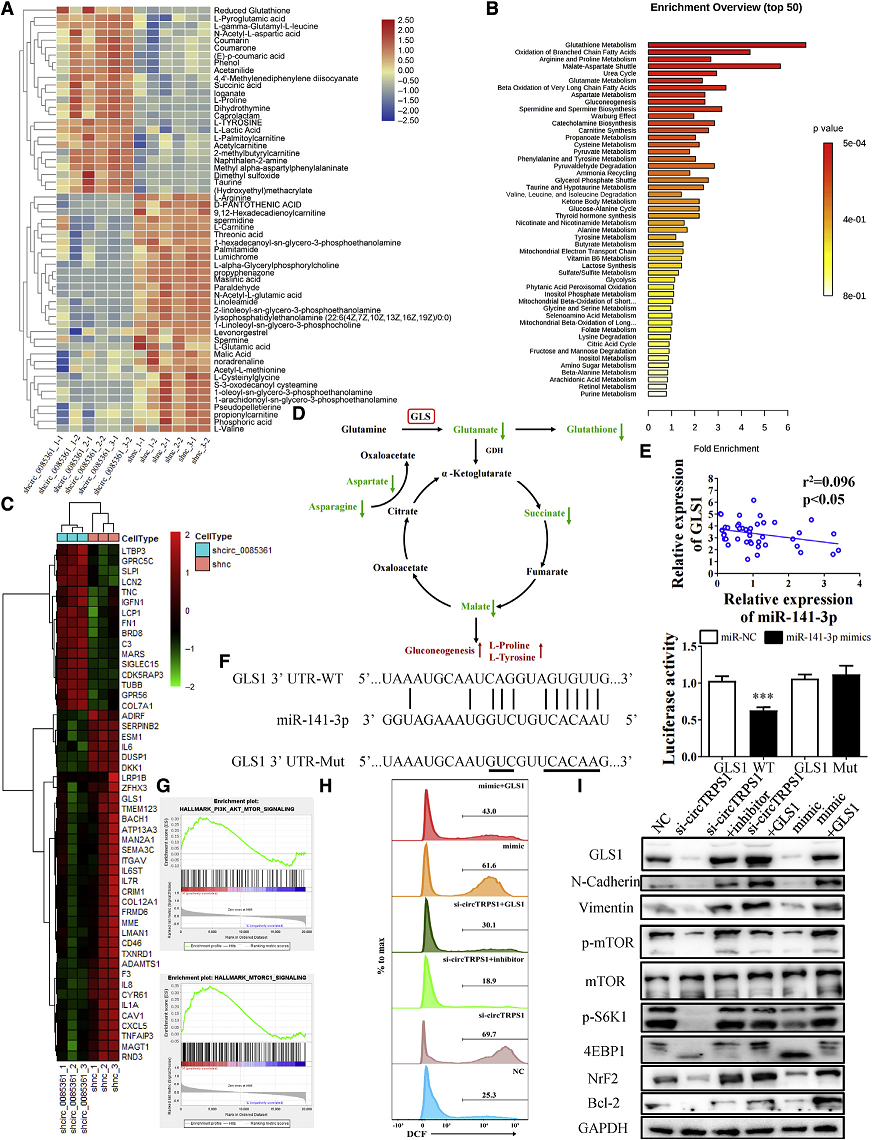
Fig 4 CircTRPS1通过调节GLS1的表达改变谷氨酰胺代谢,导致BCa氧化还原平衡失调进入翻译页面
5. 外泌体来源的CircTRPS1诱导BCa TMEs中的T细胞衰竭
CD8+ T细胞是多种免疫调节轴的最终执行者,也是主要的预后相关免疫细胞类型之一。作者进一步发现CircTRPS1在与BCa细胞的外泌体中是否对CD8 + T细胞发挥作用。于是根据CD8和CircTRPS1的相对表达水对90名患者分为四组(Fig 5A)。有趣的是,虽然高CD8+ T细胞浸润表明BCa预后较好(Fig 5B),但CD8+高表达CircTRPS1地表达组预后最好,而CD8+低表达CircTRPS1高表达组预后最差(Fig 5C)。作者发现当用Exo-si-CircTRPS1或BPTES处理时,CD8+ T细胞中干扰素IFN-g(Fig 5D)、颗粒酶 B (GZMB)(Fig 5E)和穿孔素(Fig 5F)的表达上调。同时,研究发现,在Exo-si-CircTRPS1或BPTES处理下,CD8+ T细胞表达的PD-1减少(Fig 5G),在BPTES处理下Tim-3的表达减少(Fig 5H)。此外,与Exo-si-CircTRPS1和BPTES结合, CD8+ T细胞表现出强大的抗肿瘤细胞毒性(Fig 5I)。
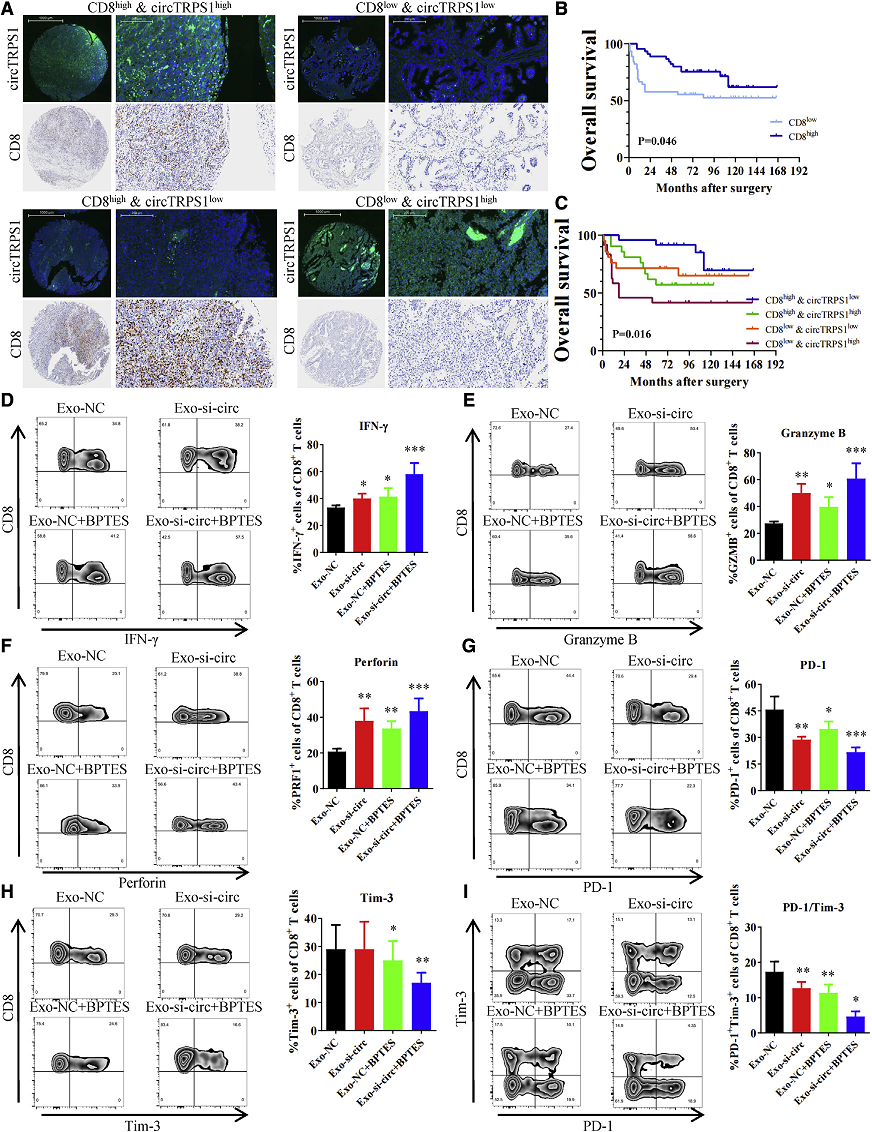
Fig5外泌体来源的CircTRPS1在BCa肿瘤微环境中诱导T细胞衰竭
6、 沉默外泌体来源的CircTRPS1通过GLS1调控抑制了BCa在体内的生长和转移
为了进一步探索外泌体来源的CircTRPS1在体内的作用,建立了T24细胞形成的肿瘤,每3天静脉注射20mg外泌体BPTES(Fig. 6A)。发现BPTES单独抑制T24细胞在体内的恶性表型。外泌体si-CircTRPS1显著降低肿瘤生长速度(Fig. 6B)。与之前的体外实验结果一致,免疫组化(IHC)肛门溶解显示mTOR通路标记物(GLS1),ROS调控标记物(Nrf2), EMT标记物(vimentin和N-cadherin),细胞凋亡标记物(Bcl-2)和细胞增殖标记物(Ki-67)的表达在si-CircTRPS1外泌体处理后被抑制,在BPTES处理后进一步降低(Fig. 6C)。HE染色显示,经xosome-si- CircTRPS1处理的T24细胞在肺内形成的结节较少,BPTES进一步抑制了T24细胞的转移能力(Fig. 6D,E),与生物发光成像一致(Fig. 6F,G)。总之,CircTRPS1相关的谷氨酰胺代谢重编程在BCa TME中的系统调节作用被提出(Fig. 6H)。
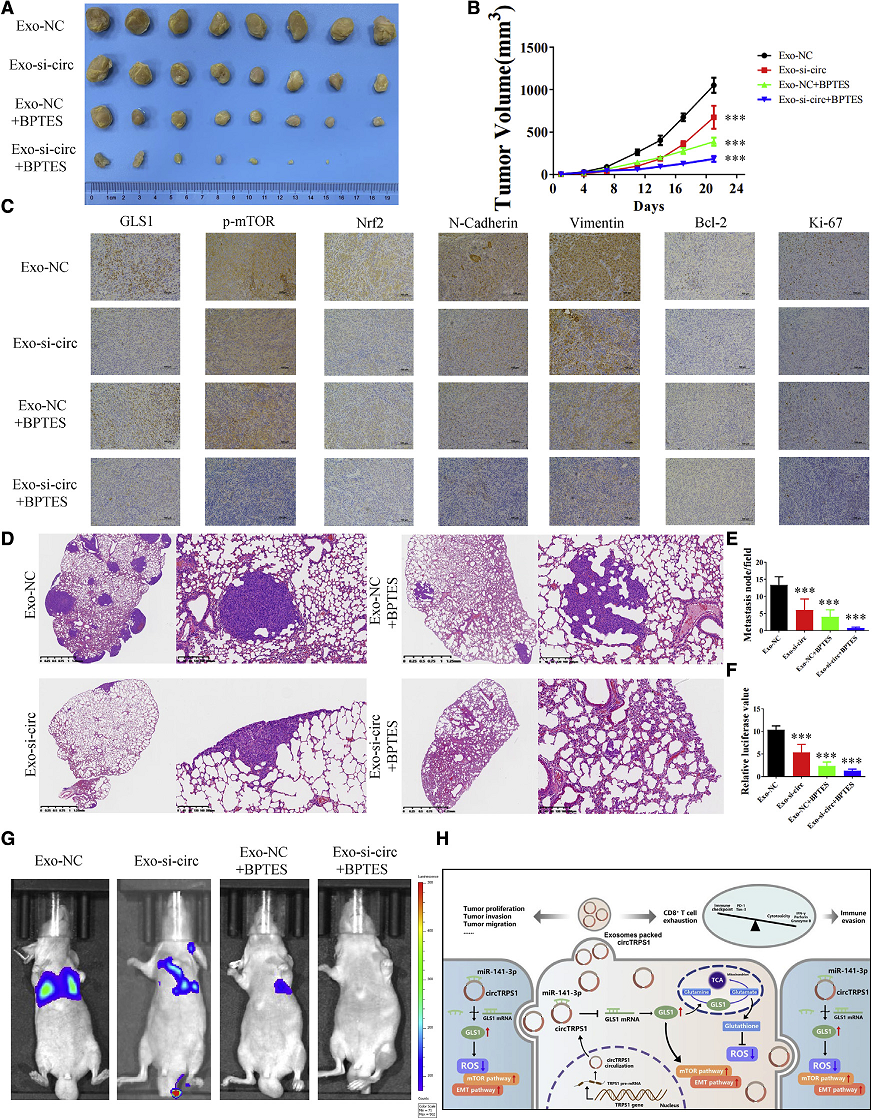
Fig 6 沉默外泌体来源的CircTRPS1可通过GLS1调控在体内抑制BCa的生长和转移
综上所述,作者的研究通过CircTRPS1/miR-141-3p/GLS1轴证实了CircTRPS1作为肿瘤启动子的作用。外泌体来源的CircTRPS1可以海绵化miR-141-3p,增强谷氨酰胺代谢中的关键酶GLS1的功能。过表达GLS1可同时增强BCa细胞的增殖能力和侵袭能力,削弱BCa微环境的抗肿瘤免疫功能。因此,作者的研究为BCa提供了新的生物标志物和治疗靶点。
参考文献:
Yang, C., et al., Exosome-derived circTRPS1 promotes malignant phenotype and CD8+ T cell exhaustion in bladder cancer microenvironments. Mol Ther, 2022. 30(3): p. 1054-1070.






