遗传学福利——15.88分可变剪接文章搞起来
肌萎缩性脊髓侧索硬化症(ALS)一种致命疾病,其特征是异常的可变剪接(AS)。运动神经元(MN)中剪接因子TDP-43的核丢失和细胞质积累是ALS疾病晚期的标志。然而,尚不清楚在TDP-43病理发生前是否存在改变的AS。本研究利用散发性和家族性ALS患者的人类诱导多能干细胞来源的运动神经元(MNs),研究了在ALS早期阶段的改变AS及其起源。这项研究强调,ALS中附加的RBP-RNA扰动与TDP-43同时发生。本研究于2022年6月发表在《Acta Neuropathologica》IF:15.887期刊上。
技术路线:

主要研究内容:
1、质谱(MS)鉴定ALS中非可溶性候选RNA结合蛋白(RBP)
TDP-43的不可溶性是ALS的标志。利用来自散发性ALS(sALS)和家族性ALS(fALS)患者的诱导多能干细胞来源的运动神经元(iPSC-MN)建模,作者首先探究了是否有其他的RBP在ALS iPSC-MN中表现出不溶性增加,分离其不可溶性蛋白组分,用于MS分析(Fig. 1a)。总计鉴定到88个蛋白在ALS的不可溶性蛋白组分中富集(Fig. 1b)。当样本标签被随机打乱时,观察到平均有7.5个蛋白质在相同的统计阈值上差异富集,这表明存在als特异性蛋白质不溶性模式(Fig. 1c)。88个候选蛋白包括细胞骨架成分和运动蛋白,这些功能类别与主要的ALS体外表型相关(Fig. 1d)。这包括一些突出的蛋白,包括KIF5A,和5个RBPs:NOVA1,ELAVL4,FXR2,RBFOX2,RBFOX3(Fig. 1d)。有趣的是,不可溶性TDP-43蛋白在ALS组和对照组间不差异。由于作者主要感兴趣的RBP,所以利用WB监测了这5个候选RBP,结果显示不可溶性NOVA1,NOVA2,ELAVL4, RBFOX2,RBFOX3的表达在ALS组增加(Fig. 1e and f)。而可溶性蛋白NOVA1和NOVA2也增加了。总之,作者在ALS-iPSC-MNs中鉴定到5个丰度增加的非可溶性RBP蛋白。
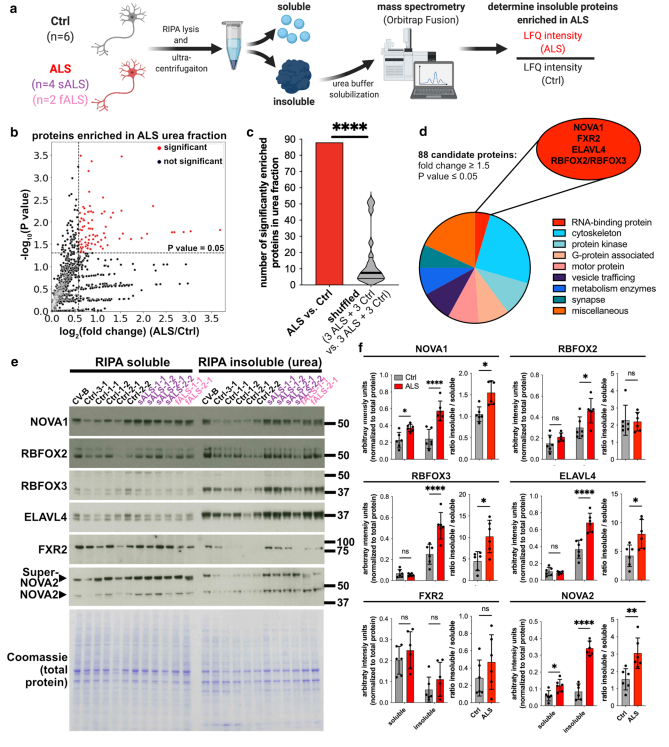
图1对iPSC衍生的运动神经元进行蛋白分馏,然后进行质谱分析,发现RBPs在ALS中溶解度增加
2、NOVA1,NOVA2和RBFOX2和ALS中的可变剪切有关
NOVA1,NOVA2,RBFOX2和TDP-43是著名的AS调控因子。为了鉴定它们的RNA结合位点,对每个RBP在两个对照ALS-iPSC-MNs细胞系(CV-B和 Ctrl-1-2)进行了eCLIP实验并测序了IP文库(Fig. 2a)。NOVA蛋白主要结合内含子序列,RBFOX2和TDP-43与内含子序列和3个UTR相互作用(Fig. 2b)。不出意外的,同源体NOVA1和NOVA2共享了大量的结合位点组分,大约93%的NOVA2结合位点也可与NOVA1结合(Fig. 2c上)。有趣的是,RBFOX2中超过10%的位点和TDP-43共享(Fig. 2c上)。在基因转录水平上,约60%的TDP-43靶点也是NOVA1的靶点(Fig. 2c下)。K-mer分析为TDP-43(Fig. 2d),NOVA(Fig. 2e and f)和RBFOX2(Fig. 2g)检索到可重复的、已知的和高度富集的序列motif。因此,iPSC-MNs中对NOVA1、NOVA2、RBFOX2和TDP-43的eCLIP分析明确揭示了它们在基因区域和序列motif水平上已知的结合偏好。
为了将这些RBP的结合位点与AS变化联系起来,生成了相应的配对端RNA-seq数据集。集中分析在上游外显子和下游外显子所包含的pre-mRNA 区域,观察到相对于Ctrl,NOVA1、NOVA2 和 RBFOX2 结合位点在sALS(Fig. 2h)和 fALS(Fig. 2i)盒式外显子处的AS显著富集。与TDP-43相比,这三种蛋白富集的统计学意义一致更高(Fig. 2h and i)。引人注目的是,与本研究的数据集相似,在AnswerALS联盟的这些数据集中,ALS和Ctrl之间的盒式外显子AS中,NOVA1、NOVA2和RBFOX2结合位点也在统计上丰富(Fig. 2j and k)。为了验证这些结果,作者进行了RNA测序和AS分析,并鉴定到277个显著的AS事件,且在两个eCLIP重复之一的SPG11-HSP中,RBFOX2结合也在AS中显著富集(Fig. 2l)。总之,NOVA1、NOVA2和RBFOX2的结合与ALS中差异调控的AS事件密切相关,并且NOVA1和NOVA2在ALS中表现出强烈的富集。
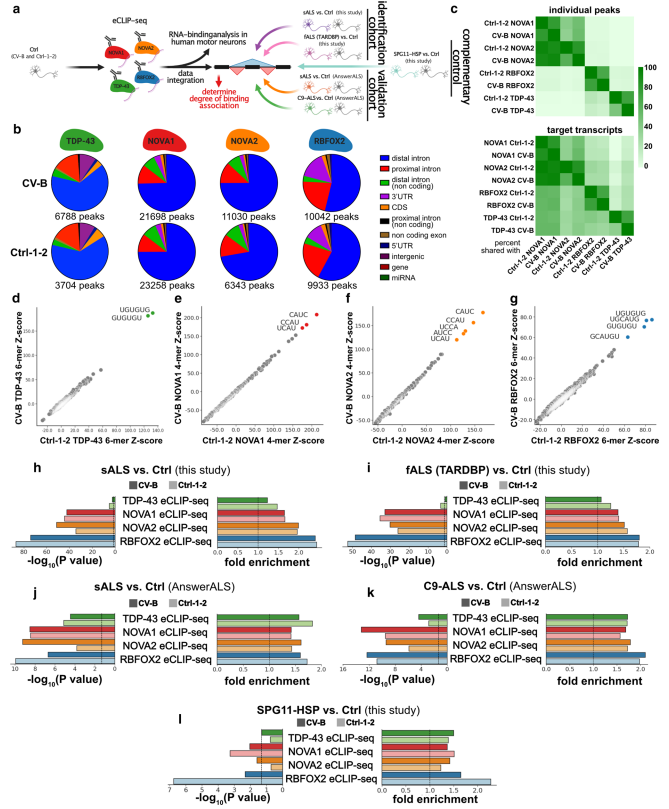
图2 NOVA1、NOVA2和RBFOX2的结合与ALS中差异调节的AS事件相关
3、NOVA1在ALS iPSC-MNs中增加,而在TDP-43细胞质定位的小鼠和化学压力的iPSC-MNs中减少
NOVA蛋白是神经元富集的AS因子。NOVA1敲低小鼠是出生后致死的由于进行性运动功能障碍伴脊髓细胞死亡增加。小鼠的表达分析表明,Nova1和Nova2的表达模式是相互的,其中,Nova2主要表达在皮层和海马,而更高水平的Nova1在中脑和脊髓中观察到。Nova1与脊髓运动神经元生物学之间的紧密联系,使作者专注于Nova1在人类MNs中的关联及其在ALS中的功能改变。
作者观察到sALS iPSC-MN中NOVA1 mRNA水平显著升高(Fig. 3a),在fALS样本中,NOVA1 mRNA水平也明显升高(Fig. 3b)。在 sALS-AA 数据集中也观察到 NOVA1 水平的增加(图 3c),而 C9-ALS-AA 的增加趋势未达到统计学意义(图 3d)。这种NOVA1 mRNA在ALS中的增加也反映在蛋白质水平上(Fig. 3e and f)。接下来,探究TDP-43功能,特别是功能丧失或细胞质毒性功能获得是否与NOVA1 mRNA水平的改变相关。分析了3个常用的TDP-43敲低的RNA-seq数据集,没有发现NOVA1 mRNA水平的变化(Fig. 3g–i)。然而,在缺乏核定位信号的TDP-43过表达的小鼠模型中,NOVA1 mRNA水平显著降低(Fig. 3j)。在iPSC-MN中应用化学应激源嘌呤霉素(puromycin),其可抑制蛋白质翻译,并促进细胞质TDP-43积累,也可导致NOVA1水平的降低(Fig. 3k)。这些结果表明在ALS iPSC-MN中,NOVA1表达增加,细胞质TDP-43水平升高与NOVA1 mRNA水平降低相关。
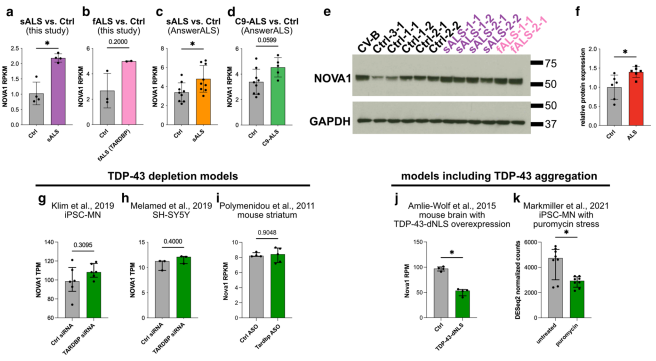
图3在ALS iPSC-MN中,NOVA1表达增加,细胞质TDP-43水平升高与NOVA1 mRNA水平降低相关
4、ALS iPSC来源的运动神经元表现出异常的NOVA1功能
为了理解NOVA1如何影响MN的AS,构建了NOVA1敲低和过表达模型(Fig. 4a-c)。生成RNA-seq数据集后对差异AS事件进行两两比较。结果显示NOVA1过表达导致AS事件增多(n=3046),敲低NOVA1导致AS改变减少(n=174),其中35个AS事件在两者间共享(Fig. 4d)。正如预期的那样,在NOVA1过表达(Fig. 4e)和敲低(Fig. 4f)条件下,NOVA1结合位点在不同AS事件中富集。由于NOVA同源蛋白共享结合位点(图2c),所以NOVA2的结合位点也在AS位点富集也就不意外了(Fig. 4e and f)。为了了解NOVA1对AS的位置依赖效应,确定了在AS事件周围特定位置的NOVA1结合位点富集,并包括了AS变化的方向性(Fig. 4g)。虽然在NOVA1过表达时被排除的外显子在选择性外显子中富集了NOVA1结合位点,但获得NOVA1功能时包含的外显子在上游和下游内含子中富集了NOVA1结合位点(Fig. 4h)。当NOVA1敲除时AS事件中的NOVA1结合模式发生了相反的变化(Fig. 4i)。这些数据表明,NOVA1与选择性外显子结合促进其排除,与下游内含子结合提高外显子包含水平。相反,与上游内含子结合可能会对备选外显子产生距离依赖的影响,近端与远端结合分别介导排斥或包含(Fig. 4j)。
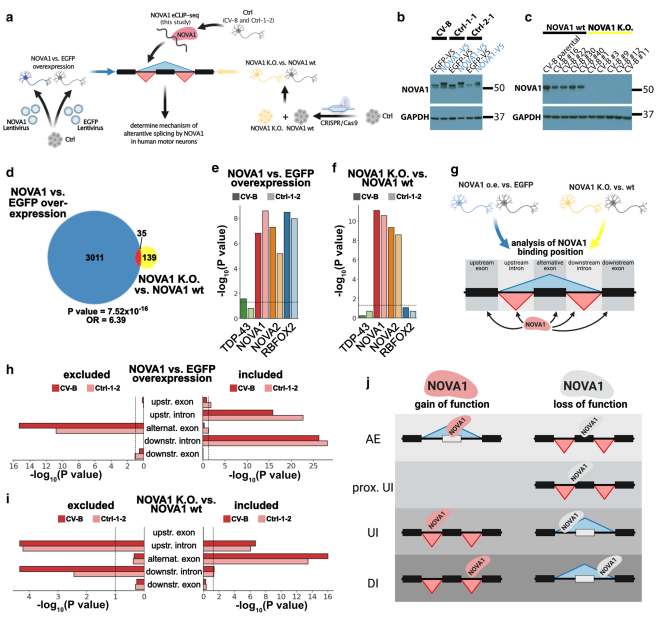
图4在人类iPSC运动神经元中,NOVA1以位置依赖的方式介导AS
为确定NOVA1在ALS中的确切作用模式,采用无监督k-means聚类,使用 7,282 个 AS 事件的包含水平差异显着改变了 4 个 ALS 数据集中至少一个数据集的AS事件。应用了两个NOVA1数据集和互补的SPG11-HSP数据集。此外,整合了从NOVA1的位置依赖AS分析中获得的信息(Fig. 5a)。总共获得了8个集群(0-7)分组AS事件,它们在4次ALS比较中至少有一次发生变化(Fig. 5b)。其中,簇0在所有4个ALS数据集和NOVA1敲除条件下显示外显子不存在,但在NOVA1过表达iPSC-MN中包含(Fig. 5c)。SPG11-HSP患者在cluster 0 AS事件中没有表现出改变(Fig. 5c)。整合本研究的 eCLIP-seq 数据后,检测到簇 1、2、3、4 和 5 中 NOVA1 结合富集的显着性较低(Fig. 5d and e)。 簇 7 表现出与替代外显子的强结合(Fig. 5d and e,棕色条),但改变 NOVA1 水平后的变化是中等的,表明这些事件可能受 NOVA1 影响,但不能仅通过改变 NOVA1 水平来改变。簇 6 的变化伴随着 NOVA1 与上游内含子结合的强烈富集(Fig. 5d and e,黄色条),表明该簇受 NOVA1 的影响,受混合的、患者特异性的方向性模式影响。有趣的是,簇0显示出NOVA1与上游内含子的强结合(Fig. 5d and e,粉红色条,箭头)。结合观察到的AS的变化(图5c),聚类0代表ALS特异性的NOVA1功能缺失特征。
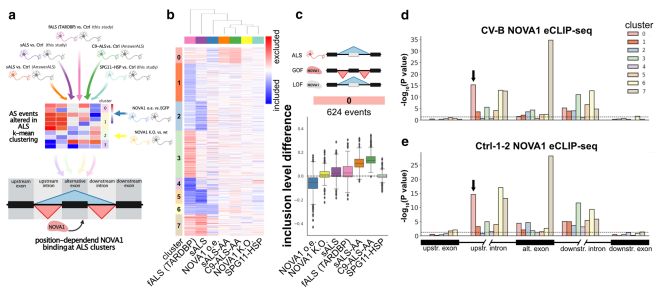
图5 ALS中异常的NOVA1状态表现出功能获得和功能丧失的特征
5、在ALS死后组织MN中,NOVA1的表达随疾病状态而动态变化
iPSC衍生模型代表了疾病的早期阶段。为了研究ALS早期阶段NOVA1细胞表达模式的组织病理学改变,对死后脊髓切片进行了神经病理学分析。对9例sALS和7例Ctrls脊髓MN的TDP-43病理进行了分类然后检测NOVA1的表达模式(Fig. 6a)。sALS中TDP-43核丢失的MNs数量各不相同。Ctrl MNs未观察到TDP-43的核丢失。有趣的是,绝大多数具有TDP-43核保留的sALS MNs并没有表现出细胞质TDP-43的积累。因此,在进一步的分析中只考虑TDP-43的核存在(Fig. 6b,紫色箭头)和核丢失(Fig. 6b,红色箭头)作为将sALS MNs分为两类的指标。随着核TDP-43的丢失,MNs的核NOVA1水平显著降低(Fig. 6c)。核TDP-43存在的MNs细胞质NOVA1明显增加(Fig. 6d)。为了研究这些变化与生理表达模式的比较,还分析了Ctrl样本中的MNs(Fig. 6e)。关于NOVA1的表达,核保留TDP-43的sALS MNs显示NOVA1核正常表达,而TDP-43核丢失的细胞表现出细胞质NOVA1信号显著增加(Fig. 6f)。观察到具有低 STMN2 表达的运动皮层样本中 NOVA1 表达显着降低(Fig. 6i),并且在来自 sALS 的激光捕获的 MN 数据集中有类似的趋势(Fig. 6h),与此前的观察结果一致即NOVA1 水平在 TDP-43表达缺乏其核定位信号时和化学应激源的应用时显著降低(Fig. 3j and k)。
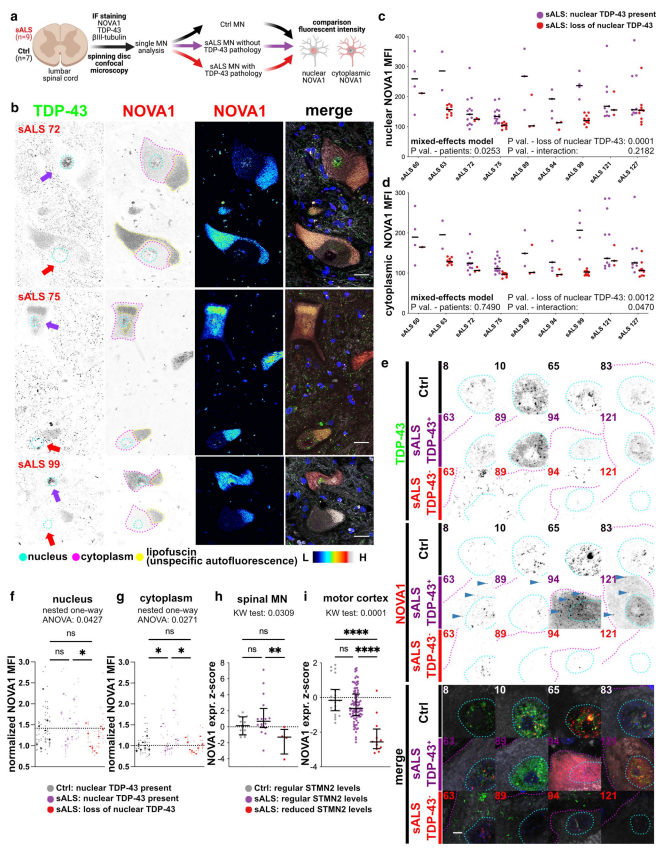
图6 ALS和Ctrl患者腰脊髓死后MN中NOVA1的表达
总之,本研究使用质谱鉴定到88个候选蛋白在ALS 患者衍生的 iPSC-MN 不溶性组分中富集,包括RBPs:NOVA1、NOVA2、ELAVL4、RBFOX2 和 RBFOX3。使用 eCLIP 分析,确定了 NOVA1、NOVA2 和 RBFOX2 在 ALS 中可变剪接的盒式外显子处的富集结合。相反,在非 ALS 运动神经元疾病队列中,NOVA 蛋白在 AS 位点的富集程度较低。整合 NOVA1 过表达和敲除的RNA-seq数据集,发现NOVA1 的 AS功能在 ALS 中被破坏,包括 NOVA1 功能特征的持续丢失。在细胞水平上,检测到ALS 中蛋白质的表达增加。在 ALS 患者的死后脊髓组织中,NOVA1 的表达模式是阶段依赖性的,在尚未表现出 TDP-43 病理学的 MNs中已经存在升高的细胞质 NOVA1 水平。NOVA1 改变的细胞和功能特性是 ALS 的分子发病机制的特征,先于该疾病的神经病理学特征(Fig. 7)。
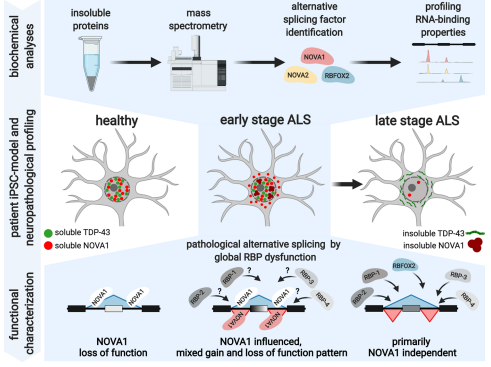
图7 通过TDP-43病理学确定ALS病程早期和晚期的NOVA1病理改变和功能异常的模式图。NOVA1细胞和功能特性的改变在ALS早期特别存在。
参考文献:
Krach Florian., Wheeler Emily C., Regensburger Martin., Boerstler Tom., Wend Holger., Vu Anthony Q., Wang Ruth., Reischl Stephanie., Boldt Karsten., Batra Ranjan., Aigner Stefan., Ravits John., Winkler Juergen., Yeo Gene W., Winner Beate.(2022). Aberrant NOVA1 function disrupts alternative splicing in early stages of amyotrophic lateral sclerosis. Acta Neuropathol, undefined (undefined), undefined. doi:10.1007/s00401-022-02450-3






