炎症性肠病有“杀手”了,口服益生菌就能治疗
炎性肠病(Inflammatory bowel disease, IBD)是一组可诱发结肠和小肠长期炎症的疾病,包括溃疡性结肠炎、克罗恩病等,这些疾病可能进一步诱发更严重、更致命的疾病,如结直肠癌。已有研究报道,IBD的病因和发病机制与肠道黏膜屏障功能受损和肠道微生态失调有关。然而IBD的临床医学干预不能解决炎症性肠病的根本原因,很多药物容易引起严重的不良反应。本研究旨在解决炎症性肠病的根本原因,并降低副作用。本文与2022年6月发表于《Nature Communication》,IF=12.121
本文技术路线

本文主要内容:
1. 工程益生菌治疗炎症性肠病
已有研究表明,壳聚糖/海藻酸钠包裹ECN- pe[ECN-pE(C/A)2]可以调节肠道菌群,提高肠道菌群丰富度(OTU)和多样性(Shannon多样性指数)缓解肠道炎症。对ECN进行基因改造,使其产生能有效清除活性氧的CAT和SOD(Fig 1A)。ECN-pE(C/A)2灌胃小鼠,壳聚糖/海藻酸钠包裹可显著提高其胃肠道内生物利用度(Fig 1B)。ECN-pE(C/A)2通过消除对炎症性肠病有显著的姑息作用,并调节肠道菌群(Fig 1C)。
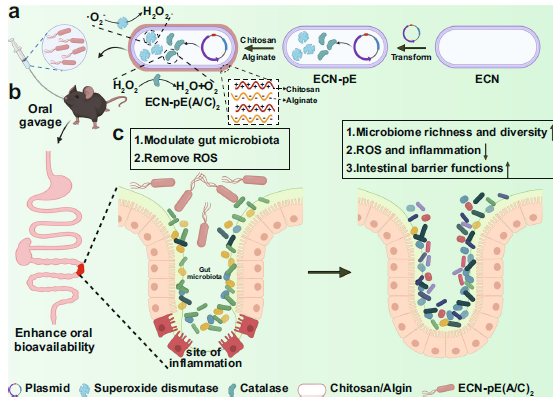
Fig1 工程益生菌治疗炎症性肠病。
ECN是一种著名的益生菌,考虑到其在临床中安全使用的悠久历史,作者选择了ECN,由于其与当前基因操作技术的兼容性,成为工程表达不同蛋白质的最佳选择。为了使增加ECN的ROS清除能力,作者利用含有CAT和SOD基因的pET28a-T5载体,通过诱导剂异丙基-β-d-硫代半乳糖苷(IPTG)转化ECN,形成CAT和SOD稳定表达的ECN (ECN- pe)。成功构建表达CAT、SOD的ECN。
如图2a所示,阳离子壳聚糖成功包覆ECN-pE(ECN-pE(C)),zeta电位由37.3 mV上升到5.9 mV,而阴离子海藻酸钠有效包覆ECN-pE(C/A)的zeta电位下降到36 mV。进一步加入壳聚糖后,ECN-pE(C/A)1.5的zeta电位再次变为4.4 mV。经海藻酸钠进一步包覆后,ECN-pE(C/A)2再次呈现负的zeta电位(38.1 mV)。为了进一步证明壳聚糖和海藻酸钠的成功涂层,作者使用了荧光标记壳聚糖和海藻酸钠,荧光强度也随着层数的增加而增加,证实了壳聚糖和海藻酸钠在ECN-pE上的成功涂层(Fig. 2b)。接下来,研究了不同层壳聚糖/海藻酸钠对ECN-pE的活力(Fig. 2c)。经1 ~ 2层壳聚糖/海藻酸钠包裹后,ECN-pE仍保持良好的细胞活性,仅比未包裹的ECN-pE略有降低。但三层包裹明显降低了细菌的活力,说明三层包裹可能损害了细菌的代谢活性。因此,本实验采用双层壳聚糖/海藻酸钠涂层(ECN-pE(C/ a)2)进行实验。此外,壳聚糖/海藻酸钠涂层对CAT和SOD的表达也没有影响(Fig 2d)。之后,检测了ECN(C/A)2, ECN(C/A)2+IPTG, ECN-pE(C/A)2, 以及ECN-pE(C/A)2 + IPTG的SOD能力。ECN-pE(C/A)2在IPTG作用下表现出较高的SOD活性,O2−清除率达94%,进一步证实ECN-pE(C/A)2在IPTG孵育下能正确生成重组SOD。ECN-pE和ECN-pE(C/A)2在IPTG作用下表现出相似的浓度依赖性SOD催化活性(Fig. 2f)。此外,ECN-pE和ECN-pE(C/A)2在IPTG培养下也表现出类似的过氧化氢分解能力,且呈浓度依赖性,表明重组CAT的合成成功(Fig. 2g, h)。
由图2I, j可以看出壳聚糖/海藻酸钠包裹益生菌对胃肠道的保护作用,在SGF或4%胆盐孵育2 h后,ECN-pE(C/A)2的形态完全没有损伤,而未包裹的ECN-pE则出现了细菌细胞壁的损伤,这表明双层壳聚糖/海藻酸钠包裹对益生菌具有良好的保护作用胃肠道环境。为了进一步验证其作用机制,首先将ECN-pE和ECN-pE(C/A)2置于SGF溶液中孵育。如图2k所示,ECN-pE暴露于SGF后2 h内迅速死亡,而双层壳聚糖/海藻酸钠涂层(ECN-pE(C/ a)2)的CFU每毫升仅下降10倍,进一步说明了两层壳聚糖/海藻酸钠涂层对胃肠道环境中益生菌的保护作用。如图2l-n所示,来自 ECN-lux(C/A)2的生物发光信号较ECN-lux高5倍, 表明ECN在胃肠道的生存率 经壳聚糖/海藻酸钠包裹后,肠道结构得到了较大的改善。值得注意的是,与未包裹ECN-pE相比,给药1小时后胃中存活ECN-pE(C/A)2的数量几乎高出4倍(Fig. 2o)。更有趣的是,口服ECN-pE后,肠、结肠和盲肠内存活ECN-pE(C/A)2的数量也明显高于未包裹的(Fig. 2p–r)。
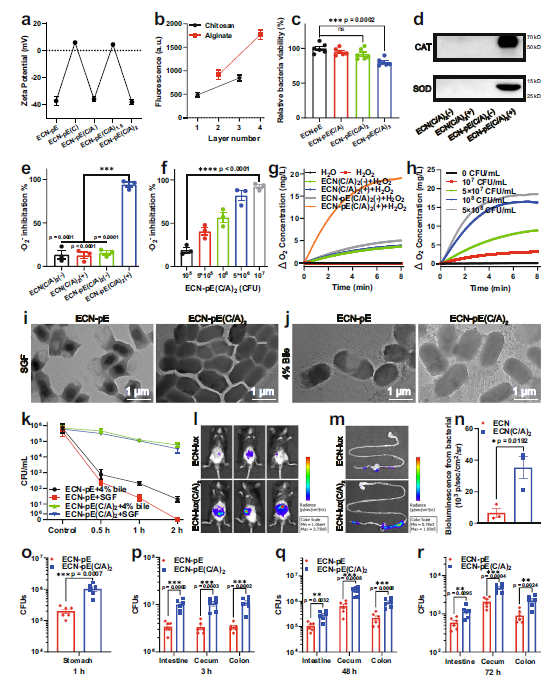
Fig2壳聚糖/海藻酸钠包裹的益生菌对胃肠道的保护作用
3. 壳聚糖/海藻酸钠包裹ECN-pE可以有效缓解dss诱导的急性IBD
急性IBD C57BL/6小鼠分别用PBS、ECN(C/A)2、ECN- pe (C/A)2或ECN- pe治疗,在此过程中,所有IBD小鼠都饮用含有IPTG (1 mM)的饮用水,诱导CAT和SOD的持续表达(Fig. 3a)。与对照组(PBS + 3% DSS)相比,ECN-pE(C/A)2处理对DSS诱导的IBD有明显的保护作用,包括体重减轻、结肠长度缩短和结肠组织损伤。相比之下,ECN-pE不能完全缓解小鼠体重减轻和DAI升高,因为ECN-pE在没有壳聚糖/海藻酸钠包裹的情况下生物利用度较低(Fig. 3b–h)。此外,ECN(C/A)2处理的小鼠由于缺乏CAT和SOD的表达,也表现出明显的体重下降和结肠长度缩短(Fig. 3b, e)。CN-pE(C/A)2处理的小鼠结肠组织病理学评分较低,与对照组(PBS+水)接近,上皮完整,指状隐泡结构规则,炎症细胞比例较低,表明ECN-pE(C/A)2能显著促进结肠组织的修复。ECN(C/A)2处理的小鼠结肠组织病理组织学评分较高,与DSS处理组(PBS + 3% DSS)接近,隐窝变形完全,杯状细胞严重丢失,炎症细胞浸润明显(Fig. 3g, h)。由于缺乏壳聚糖/海藻酸钠涂层保护,ECN-pE只能部分缓解小鼠结肠组织损伤。此外,ECNpE小鼠结肠中ibd相关的MPO活性(C/A)2处理也显著下降,表明ECN-pE(C/A)2能有效缓解氧化应激,缓解IBD (Fig. 3i)。采用ELISA法检测典型促炎细胞因子白细胞介素-1β (IL-1β)、肿瘤坏死因子-α (TNF-α)、白细胞介素-6 (IL-6)的水平。如图3j-l所示,IL-1β、DSS处理小鼠结肠组织中TNF-α、IL-6显著上调。抗炎细胞因子,如白细胞介素-10 (IL-10)和转化生长因子-β (TGF-β)的水平相应上调, 进一步证明ECN-pE(C/A)2(Fig 3m, n)具有良好的抗炎作用。综上所述,壳聚糖/海藻酸钠包裹ECN-pE表达CAT和SOD,可以有效缓解dss诱导的急性IBD。
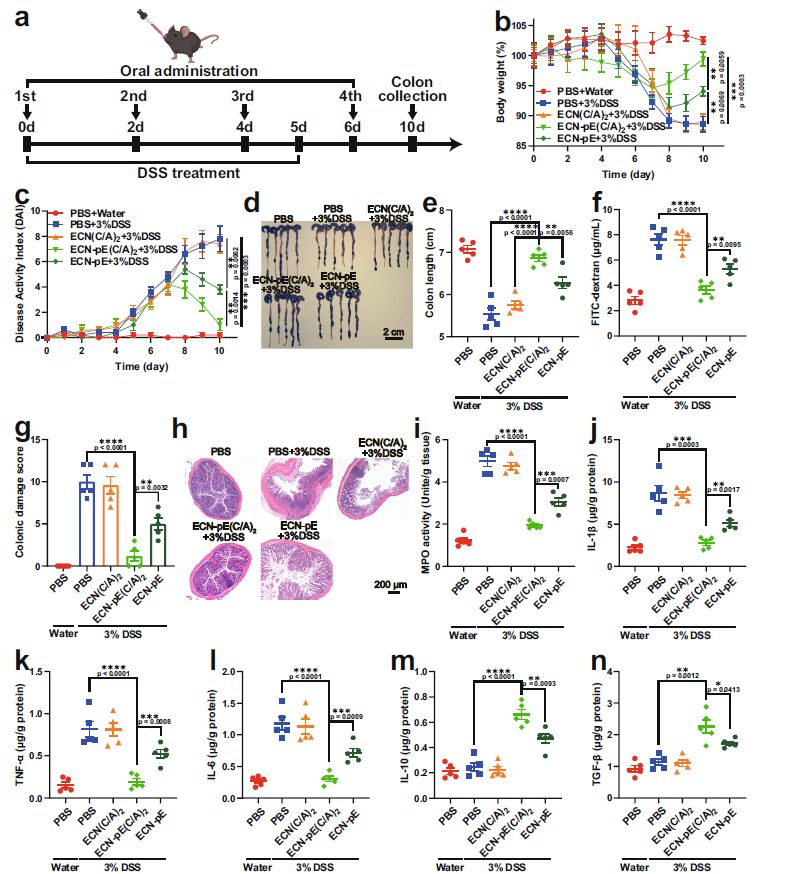
Fig 3壳聚糖/海藻酸钠包裹ECN-pE可以有效缓解dss诱导的急性IBD
4. ECN-pE(C/A)2对不同小鼠IBD模型均表现出良好的治疗效果。
然后,作者研究了ECN-pE(C/A)2对结肠上皮细胞和受损的结肠上皮屏障的影响,这是dss诱导的急性IBD32的关键特征。根据免疫荧光染色结果(Fig. 4a, b, d, e)。与ECN-pE相比,ECN(C/A)2、ECN- pe (C/A)2处理均能有效上调结肠组织中ZO-1和Occludin的表达,进一步说明抗氧化酶(CAT和SOD) 和壳聚糖/海藻酸钠涂层在结肠上皮修复中的作用的关键作用。此外,FITC -右旋糖酐灌注试验也用于评估结肠通透性。与dss处理的小鼠相比,ECN-pE(C/A)2处理的小鼠血清中fitc -右旋糖酐信号明显降低,表明DSS诱导结肠炎小鼠中肠屏障修复(Fig. 3f)。ECN-pE(C/A)2处理显著缓解结肠上皮细胞凋亡水平,与健康小鼠的凋亡水平非常接近(Fig 4C.4F)。为了评估其安全性,作者进行了多项指标的检测,发现ECN-pE(C/A)2处理各项指标与健康小鼠无明显差别(Fig. 4g)。

Fig 4 ECN-pE(C/A)2对不同小鼠IBD模型均表现出良好的治疗效果
5. ECN-pE(C/A)2对肠道菌群的调节作用
作者研究了ECN-pE(C/A)2对抗生素预处理的dsd小鼠急性IBD的治疗效果。经抗生素预处理后ECN-pE(C/A)2的治疗效果明显降低,提示肠道菌群可能在急性IBD的调节中发挥重要作用(Fig. 5a-g)。因此,作者进一步研究了ECN-pE(C/A)2是否可以调节dss诱导的小鼠IBD模型中肠道菌群的丰度。然后,通过16S rRNA基因测序分析肠道菌群丰度,结果表明口服ECN-pE(C/A)2能显著改变dss处理小鼠肠道菌群丰度和多样性(Fig. 5h, i)。此外, ECN-pE(C/A)2处理之后,健康组和DSS处理组小鼠 Escherichiashigella (一个能促进炎症性肠病致命的病原体) 的相对丰度降低(Fig. 5j–n)。

Fig 5 ECN-pE(C/A)2在IBD治疗期间调节肠道菌群
6. ECN-pE(C/A)2对IBD具有缓解作用
为了进一步探讨ECN-pE(C/A)2对IBD延迟治疗的疗效,作者研究ECN-pE(C/A)2对IBD延迟治疗的疗效。建立C57BL/6小鼠急性IBD之后,在第5、6、7、9天进行ECN(C/A)2、ECN- pe (C/A)2或ECN- pe小鼠灌喂(Fig. 6a)。值得注意的是,ECN-pE(C/A)2治疗有效地保护小鼠免受dss诱导的急性IBD,包括结肠长度缩短、体重减轻、结肠上皮组织损伤和MPO活性增加 (Fig. 6b–g)。此外,ECN-pE(C/A)2处理还能抑制IL-1β、TNF-α、IL-6等促炎细胞因子的水平,并且上调抗炎细胞因子水平(Fig. 6h–l)。这些结果验证了ECN-pE(C/A)2对dss诱导的急性IBD具有明显的延缓缓解作用。
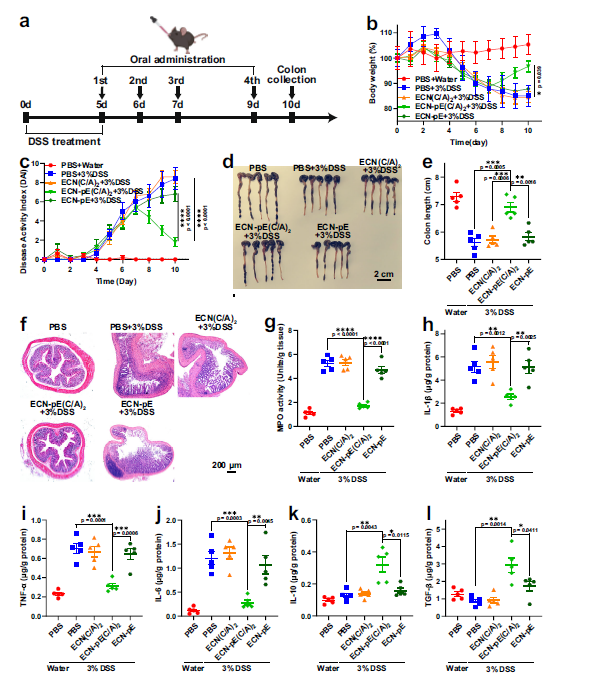
Fig 6 ECN-pE(C/A)2对IBD具有缓解作用
本研究表明,在小鼠模型中口服具有生物膜自我涂层的基因工程益生菌可以有效地调节炎症和肠道菌群,缓解急性结肠炎。鉴于肠道菌群失调和肠道炎症与许多其他系统性疾病高度相关,益生菌基因工程结合功能性表面涂层可能为许多其他疾病的治疗提供方便和有益的平台。
参考文献:
Zhou, J., et al., Programmable probiotics modulate inflammation and gut microbiota for inflammatory bowel disease treatment after effective oral delivery. Nat Commun, 2022. 13(1): p. 3432.






