国自然新方向——组蛋白乳酸化修饰与肿瘤
组蛋白的翻译后修饰通过调节 DNA 依赖性过程(包括转录、复制和 DNA 修复)在维持体内平衡中发挥重要作用,这些修饰通过改变核小体之间的接触或通过招募非组蛋白来发挥作用。组蛋白修饰与生物学过程有着密切的关系,组蛋白修饰的功能意义一直是研究热点。组蛋白修饰的失调可以改变转录激活和抑制的平衡,从而导致疾病的发生和进展。因此,组蛋白修饰是与疾病发生和发展密切相关的多功能标记。
组蛋白可以通过多种方式进行修饰,包括乙酰化、甲基化、磷酸化、泛素化和 SUMO 化,这些方式早已为人所知。随着高灵敏度质谱技术的发展,新发现了各种来源于细胞代谢物的组蛋白酰化标记,如丙酰化、丁酰化、琥珀酰化和丙二酰化。乳酸化修饰 (lactylation) 为芝加哥大学赵英明教授团队于2019年在Nature杂志首次报道的一种组蛋白翻译后修饰,发挥着基因转录调控的功能。组蛋白乳酸化在肿瘤发生中的作用仍不清楚。由于 Warburg 效应(有氧糖酵解)是癌症的标志之一,即使在有氧条件下,癌细胞也倾向于将葡萄糖转化成乳酸来产生能量,与正常细胞相比,葡萄糖代谢的乳酸更多。因此,肿瘤中的组蛋白乳酸化很可能是异常的,探索组蛋白修饰在疾病发病机制尤其是肿瘤发生中的作用越来越受到关注。
有研究表明,组蛋白乳酸化水平在眼部黑色素瘤中上调,组蛋白乳酸化的抑制有效地抑制了肿瘤进展。该文章发表在Genome Biology期刊上,IF=17.906.
组蛋白乳酸化水平升高与眼部黑色素瘤患者的不良预后相关
为了证明眼部黑色素瘤中蛋白质乳酸化水平异常,免疫荧光检查了眼部黑色素瘤中的蛋白质乳酸化水平及其可能的临床意义。眼部黑色素瘤组织的整体乳酸化水平显着高于正常黑色素细胞组织。更高的整体乳酸化水平预示着癌症的早期复发和增强的侵袭性。WB显示,在大多数眼部黑色素瘤细胞系中,整体乳酸化水平也升高。有趣的是,通过免疫荧光染色,乳酸化蛋白主要位于细胞核中,并且蛋白质印迹分析中的主要条带接近 17 kDa。然后我们在对乳酸化蛋白进行免疫沉淀后进行银染质谱(MS),结果显示该条带是组蛋白H3。因此,决定调查上述现象是否是由 H3K18la 引起的。类似地,与正常黑色素细胞组织相比,眼部黑色素瘤组织中的 H3K18la 水平显示出与整体乳酸化水平相同的趋势,H3K18la 水平升高表明预后较差。因此,在大多数眼部黑色素瘤细胞系中也观察到了较高的 H3K18la 水平。通过WB分析证实了眼部黑色素瘤组织中升高的整体乳酸化和 H3K18la 水平。这些数据表明,大部分眼部黑色素瘤的特征是组蛋白乳酸化升高,这可能与眼部黑色素瘤的肿瘤发生有关。
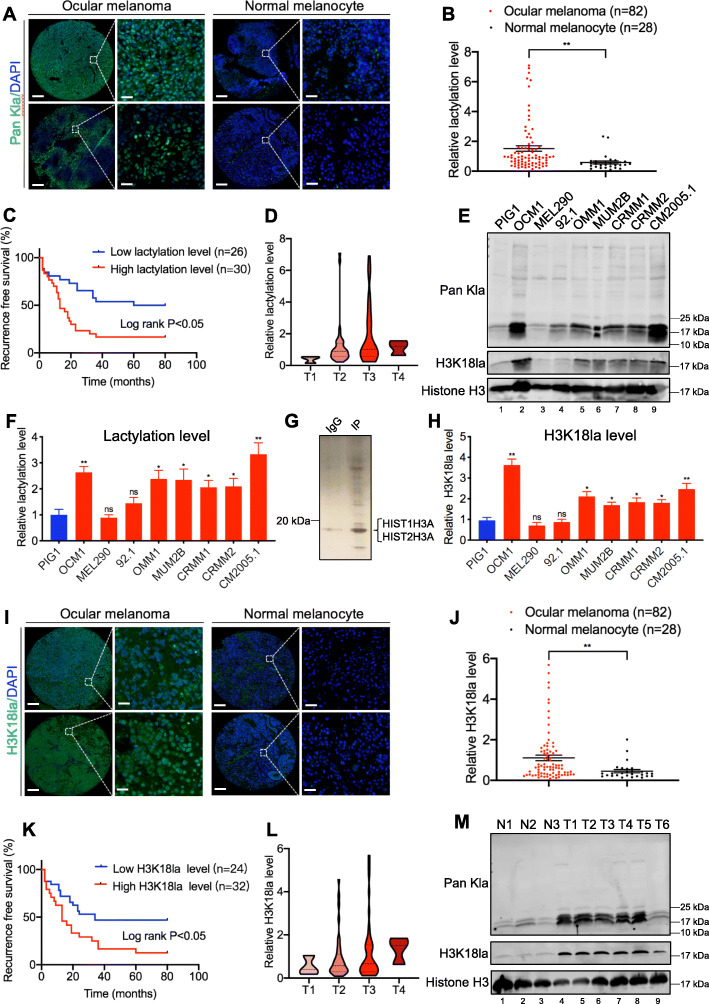
抑制组蛋白乳酸化抑制眼部黑色素瘤的肿瘤发生
为了评估组蛋白乳酸化抑制是否减弱了眼部黑色素瘤的肿瘤发生,使用糖酵解抑制2-DG和草酸盐以及乳酸脱氢酶 (LDHA 和 LDHB) 的 siRNA降低了肿瘤细胞中的整体细胞内组蛋白乳酸化水平。在眼部黑色素瘤细胞(OCM1 和 CRMM1细胞)中,两种糖酵解抑制剂均实现了细胞内乳酸的显着剂量依赖性降低,以及整体乳酸化和 H3K18la 水平。接下来,组蛋白乳酸化降低可有效抑制眼部黑色素瘤细胞增殖。此外,菌落测定表明,组蛋白乳酸化水平较低的眼部黑色素瘤细胞形成的菌落越来越少。transwell 和伤口愈合试验表明,这些细胞的迁移能力较弱。在体内,我们使用糖酵解抑制剂预处理的 OCM 细胞在裸鼠中建立了原位异种移植物。正如预期的那样,减少组蛋白乳酸化组的肿瘤重量显着低于对照组。由于2-DG和草酸盐可能具有与抑制乳酸产生和乳酸化无关的其他作用,我们进一步沉默 LDHA 和 LDHB 以抑制组蛋白乳酸化。结果发现要么缺乏 LDHA或 LDHB眼部黑色素瘤细胞没有表现出整体组蛋白乳酸化的显着降低。然而,同时沉默 LDHA 和 LDHB显着损害组蛋白的乳酸化,同时引发细胞增殖的显着抑制和迁移。此外,向 LDHA/LDHB 缺陷细胞中添加回乳酸钠 (Nala) 成功地增加了组蛋白的乳酸化水平和部分恢复的细胞增殖和迁移。
接下来,乳酸钠、葡萄糖和鱼藤酮用于提高眼部黑色素瘤细胞(OCM1 和 CRMM1 细胞)中的组蛋白乳酸化。然而,我们没有观察到细胞生长的显着变化或集落形成能力。总之,组蛋白乳酸化的上调不能进一步促进眼部黑色素瘤细胞的肿瘤进展。这可能是由于眼部黑色素瘤中组蛋白乳酸化水平升高达到饱和,这足以导致肿瘤发生。尽管眼部黑色素瘤的肿瘤进展需要升高的组蛋白乳酸化,但在肿瘤发生过程中需要多因素合作。
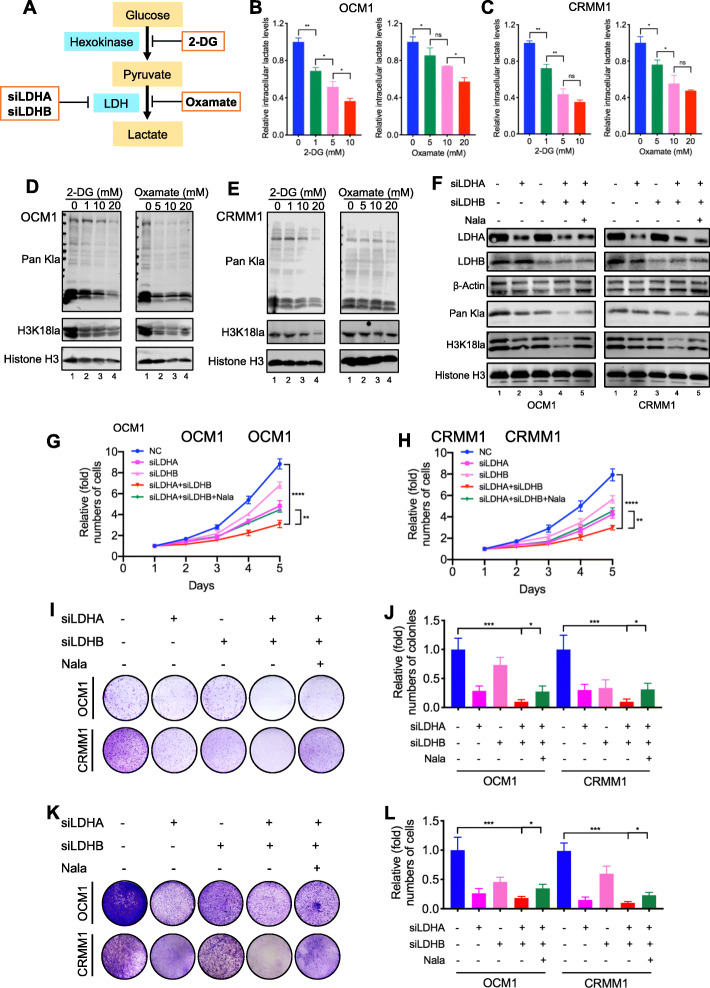
鉴定组蛋白乳酸化的潜在下游靶基因
为了揭示组蛋白乳酸化在基因表达中的调节作用,首先进行染色质免疫沉淀,然后使用抗 H3K18la 抗体进行测序(ChIP-seq)。ChIP-seq 数据显示 H3K18la 在启动子区域富集。KEGG分析显示,这些H3K18la特异性基因富含代谢途径和肿瘤相关途径,表明组蛋白乳酸化在肿瘤发生中的调节作用。草酸盐处理后下调基因的 KEGG 分析也富含代谢相关途径。接下来,通过将ChIP-seq数据与是否使用糖酵解抑制剂处理的细胞的转录组以及正常和肿瘤细胞的转录组的RNA 测序(RNA-seq)数据相结合,我们鉴定了4个抗H3K18la-ChIP靶基因,它们在用糖酵解抑制剂处理的细胞中mRNA水平显着降低,并且在肿瘤细胞中也高度表达。在这些候选基因中,YTHDF2 是m6A阅读器之一,据报道在几种肿瘤中充当癌基因;因此,决定专注于它。为了证实 YTHDF2 的转录被 H3K18la 激活,我们首先在YTHDF2启动子处观察到 H3K18la 信号的显着富集。ChIP-qPCR 分析还表明,H3K18la 在YTHDF2启动子区域中富集,并且这种富集被糖酵解抑制剂降低。此外,ChIP-qPCR 分析表明,EP300是一种组蛋白乳酸化写入器,在用糖酵解抑制剂处理后,YTHDF2 启动子的结合水平显着降低。然而,EP300 的整体蛋白表达在 YTHDF2 缺陷细胞中保持不变。值得注意的是,在这种情况下,YTHDF2 启动子的 H3K27ac 水平略有下降。正如预期的那样,mRNA和蛋白质用糖酵解抑制剂治疗后 YTHDF2 表达水平显着降低。此外,mRNA 稳定性分析表明糖酵解抑制剂不影响 YTHDF2 的 mRNA 稳定性。此外,与 EP300 缺陷或糖酵解抑制组相比,我们注意到 YTHDF2 表达在同时沉默 EP300 和糖酵解抑制后保持不变。总的来说,这些数据表明 YTHDF2 的转录受到 H3K18la 的正向调节。

YTHDF2 是眼部黑色素瘤中的一种新癌基因
由于 YTHDF2 可以直接受 H3K18la 调节,我们接下来探讨了它在眼部黑色素瘤中的功能。首先,我们发现 YTHDF2 在眼部黑色素瘤细胞系中的两个 RNA 都高度表达和蛋白质水平。此外,免疫荧光染色显示,与正常黑色素细胞组织相比,眼部黑色素瘤组织中 YTHDF2 的表达显着上调,并且 YTHDF2 的较高表达与预后不良呈正相关。基因表达谱交互分析(GEPIA)数据库证实,高 YTHDF2 水平与较差的预后相关。然后,我们通过用三种shRNA沉默其表达来验证 YTHDF2 在眼部黑色素瘤细胞中的功能。YTHDF2被成功敲低后,我们进行了CCK-8测定,结果表明与对照细胞相比,细胞生长显着降低。此外,我们观察到 YTHDF2 敲低抑制了肿瘤细胞集落的形成和迁移,分别通过平板集落形成测定和 transwell 测定来测量。总之,这些数据表明 YTHDF2 在眼部黑色素瘤中充当癌基因。

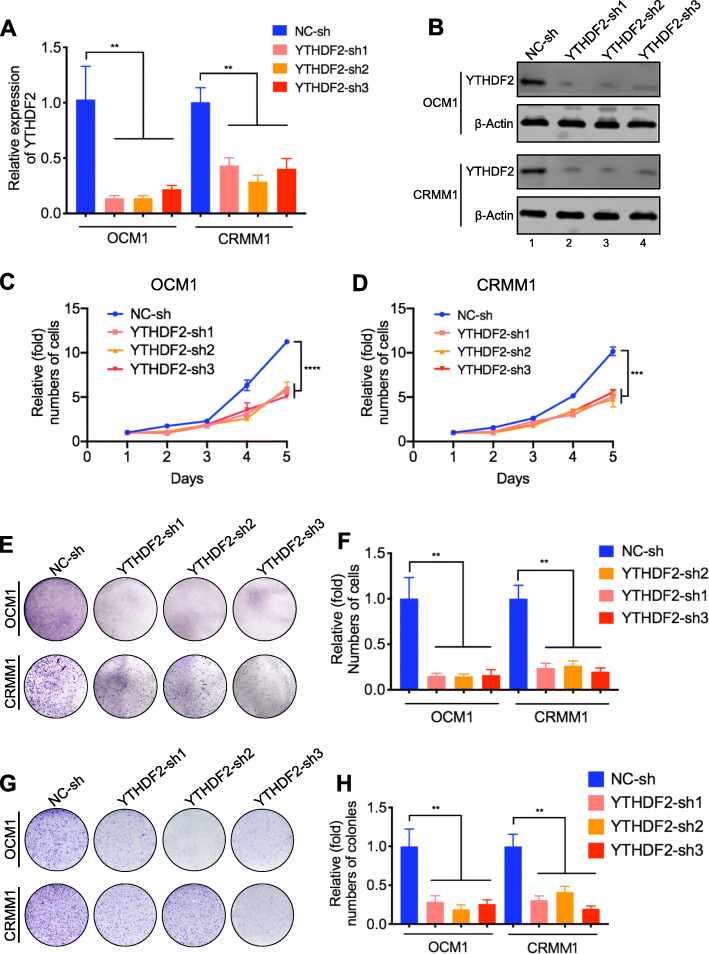
组蛋白乳酸化通过m6A阅读器YTHDF2促进癌症
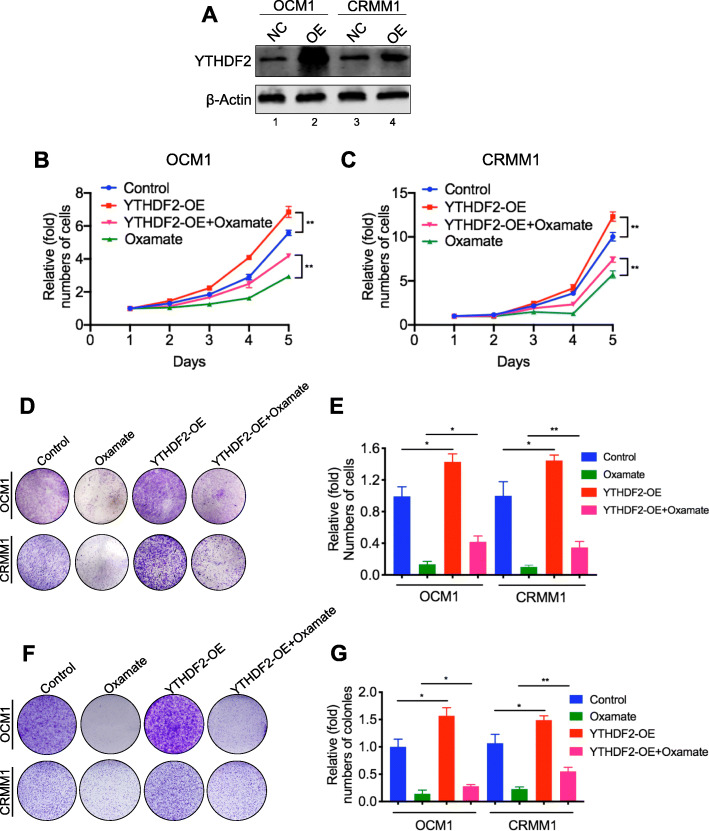
在确定YTHDF2的表达受H3K18la调节后,我们想确定是否可以通过获得 YTHDF2来挽救组蛋白乳酸化诱导的肿瘤抑制。在眼部黑色素瘤细胞中过表达 YTHDF2 后,糖酵解抑制剂的抗癌作用受到部分损害,包括细胞生长,菌落形成和迁移。此外,眼部黑色素瘤细胞中 YTHDF2 的过表达加速了肿瘤发生,这进一步表明 YTHDF2 功能的致癌增益。总的来说,这些结果表明 H3K18la 部分通过 YTHDF2 促进肿瘤发生。
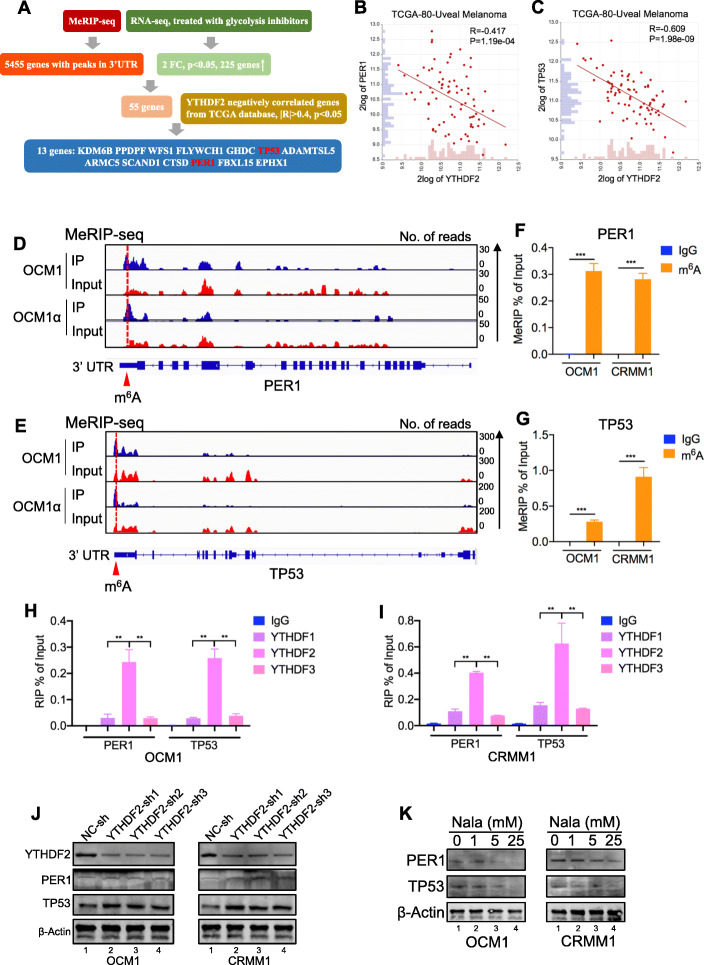
PER1 和 TP53 可能是与 YTHDF2 相关的关键候选基因
为了了解 YTHDF2 在肿瘤发生中的作用机制,我们探索了数据库,发现与 YTHDF2 相关的基因在肿瘤相关生物学中富集。 DNA修复、细胞凋亡和细胞周期等过程。进一步的 KEGG 分析表明,正相关基因在RNA降解途径等途径中富集,而负相关基因在代谢途径中富集。接下来,通过将MeRIP-seq数据与用糖酵解抑制剂处理的细胞的 RNA-seq 数据,我们发现在3'UTR中具有m6A峰的13个基因在用糖酵解抑制剂处理的细胞中显着增加,并且与TCGA数据库中的YTHDF2呈负相关。进一步的实时 PCR (RT-PCR) 分析表明,在两种肿瘤细胞系中,用糖酵解抑制剂处理后 ,其中2个基因(PER1 和 TP53)显着上调。具体而言,肿瘤抑制基因 PER1和 TP53在 TCGA 数据库中与 TYHDF2 呈负相关,而 NRAS 和 BRAF 等癌基因与 TYHDF2 呈正相关。因此,我们假设 YTHDF2 通过与各自的 m 6 A 位点结合来促进 PER1 和 TP53 的降解。
MeRIP-seq和meCLIP-seq 数据显示 PER1 和 TP53在3' UTR区域具有 m6A位点。然后应用MeRIP-qPCR来证明 PER1和TP53 的m6A修饰。与IgG 组相比,通过与m6A特异性抗体的反应获得了 PER1 和TP53 mRNA的富集。正如预期的那样,RIP-qPCR分析显示 PER1和TP53 mRNAs 主要与YTHDF2 相互作用。YTHDF2 敲低显着上调 PER1和TP53 mRNA和蛋白质水平。此外,我们观察到 PER1 和 TP53 被组蛋白乳酸化诱导剂 (Nala) 下调并被组蛋白乳酸化抑制剂(2-DG 和草酸盐)上调。然后我们研究了 YTHDF2 缺陷细胞中 PER1和TP53 mRNA 稳定性的改变。结果,YTHDF2 沉默显着增加了 PER1 和 TP53 的 mRNA 稳定性。此外,通过探索 GEPIA 数据库,我们观察到 PER1 的更高表达水平预示着更好的预后。与对照样本相比,我们还观察到眼部黑色素瘤组织样本中的 PER1 和 TP53 水平显着降低。接下来,我们检查了是否可以通过沉默 PER1 和 TP53 来损害 YTHDF2 敲低效应。结果,沉默 PER1 和 TP53 部分恢复了细胞增殖。在 YTHDF2 缺陷的眼部黑色素瘤细胞中。总之,这些数据表明异常的 YTHDF2-PER1/TP53 轴有助于眼部黑色素瘤的肿瘤进展。
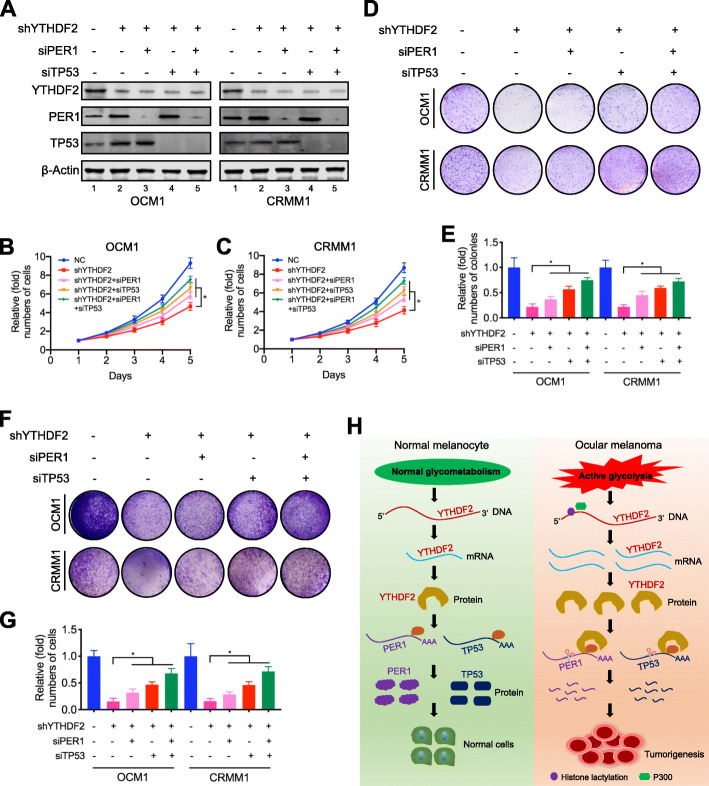
该研究最初揭示了组蛋白乳酸化通过激活m6A 阅读蛋白YTHDF2加速肿瘤发生,从而为治疗眼部黑色素瘤提供了新的组蛋白乳酸化靶点。还将组蛋白修饰与RNA修饰联系起来,这为表观遗传调控提供了新的理解。






