一个新证据——可变剪接调控精子发生
可变剪接(AS)在细胞分化和发育过程中受到严密调节。AS事件在睾丸中普遍存在,但剪接在精子发生中的调控仍不清楚。本文发现剪接体成分Bud31介导的AS事件在小鼠精子发生过程中起着至关重要的作用。Bud31介导的AS是精原干细胞(SSC)调节哺乳动物雄性生殖细胞的自我更新和分化所必须的。本实验采用构建生殖细胞特异性Bud31敲除小鼠,细胞培养,生精细胞的富集,RT-qPCR,免疫印迹,免疫组化,免疫荧光,HE染色,染色体弥散免疫荧光分析,SMART-seq,可变剪接和剪接效率分析,RIP-Seq,RNA pull-down,荧光素酶检测,微基因分析的实验方法。
技术路线:

主要实验结果:
1、生殖细胞特异性Bud31基因敲除导致雄性完全不育
剪接因子的表达水平在细胞分化发育过程中受到严格调控。为描述参与精子发生的剪接因子,作者使用公开RNA-seq数据集(E-MTAB-6798)进行分析,在小鼠精子发生的不同阶段的睾丸中鉴定到134个已知剪接因子。其中10个剪接因子在出生后才开始表达,这是精原细胞增殖开始的时候(图1A)。同时,使用E-MTAB-6798分析AS事件,发现AS事件在P3时显著增加,与P0相比,在P28时达到峰值(图1B)。剪接体组分Bud31是剪接体组装和催化活性所必需的,它的表达模式与其他剪接事件在时间上协调,所以选择它进行深入研究。此外,Bud31和未分化精原细胞的标记物Dazl的免疫荧光共染色显示,在P4时,Bud31存在于生精小管Dazl阳性细胞中,且主要定位于细胞核(图1C)。
为阐明Bud31在精子发生中的潜在作用,将VASA-Cre转基因小鼠与Bud31-floxed小鼠杂交,构建生殖细胞特异性Bud31敲除小鼠(Bud31- vKO)。对输精管生殖细胞标记物DAZL和Bud31进行免疫染色,证实Bud31- vKO小鼠生殖细胞P4时Bud31缺失(图1D)。此外,与同窝对照小鼠相比,Bud31-vKO小鼠的睾丸要小得多(图1E)。与这种表型一致,苏木精染色显示Bud31-vKO小鼠睾丸中的生殖细胞数量与同窝对照组相比显著减少(图1F)。支持细胞标记物Sox9和生殖细胞标记物Gcna的免疫荧光共染显示,在Bud31-vKO的睾丸中完全没有Gcna阳性细胞,但对照小鼠在P10时睾丸中存在Gcna(图1G)。这些结果表明Bud31是精子发生所必须的。
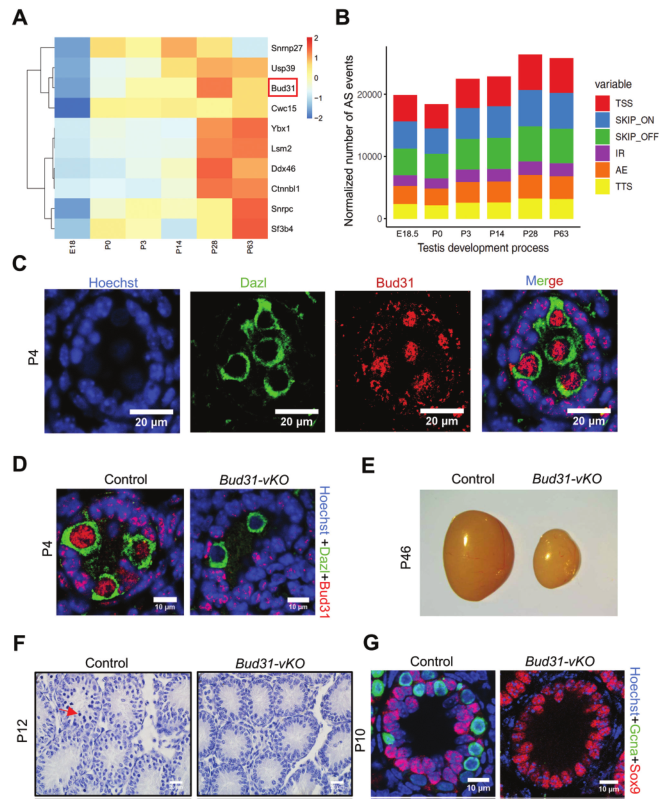
图1生殖细胞特异性Bud31基因敲除导致雄性完全不育
2、Bud31敲除导致SSC自我更新严重缺陷
为探究Bud31-vKO小鼠生殖细胞丢失的原因,进行SSC标志物Plzf的免疫组化,发现其在正常小鼠表达在Bud31-vKO小鼠丢失。为了研究Bud31-vKO小鼠SSC缺失的发生时间,在Bud31- vko和对照小鼠的P1、P2、P3、P4和P5的输精管中分别对Bud31和Plzf进行免疫染色。与对照组比较,Plzf阳性细胞显著丢失的第一个时间点是P4(图2A-B)。此外,对Bud31-vKO小鼠P5时期的生精小管进行SSC另一个标志物Lin28a免疫染色,结果显示共表达Lin28a和Plzf的细胞数量显著低于对照组(图2C)。用qPCR检测P4睾丸中SSC标记(Plzf、Lin28a、Gfrα1和Id4)的表达,与对照组相比,Bud31-vKO睾丸中这些标记的表达水平显著降低(图2D)。流式细胞仪分析显示,与对照组相比,Bud31-vKO睾丸P4时表达SSC表面标记物Thy1而不表达c-Kit的细胞数量从3.4%下降到2.26%(图2E)。证实SSC的数量早在P4时就减少了。对来自P4时期的Bud31-vKO和对照小鼠的Thy1+/c-Kit–分选的SSCs进行SMART-seq分析,对差异表达基因的GO和GSEA分析显示,PI3K-AKT-mTOR信号通路明显富集,这是正常SSC自我更新的重要通路(图2F-G)。免疫印迹验证了P4时期Bud31-vKO小鼠的Thy1+/c-Kit–SSCs中mTOR信号成分的水平降低(图2H)。这些结果提示Bud31参与新生小鼠SSC自我更新的调节。
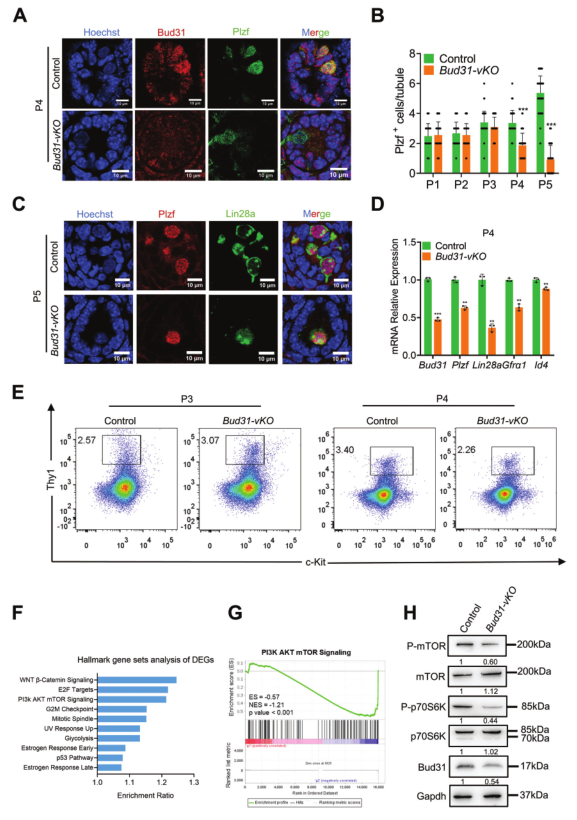
图2Bud31敲除导致SSC自我更新严重缺陷
3、Bud31缺失雄性小鼠生殖细胞无法进入减数分裂
为评估Bud31在雄性减数分裂中的潜在作用,将Stra8-GFPCre小鼠与Bud31flox/flox小鼠杂交获得生殖细胞特异性Bud31敲除雄性小鼠(Bud31- sKO)。木素染色显示Bud31-sKO小鼠的减数分裂细胞在P10和P12时期与同窝对照组相比大幅减少(图3A)。对P12小鼠输精管减数分裂标志物SYCP3和γH2AX进行免疫荧光染色,发现Bud31-sKO睾丸的SYCP3和γH2AX双阳性细胞与对照组相比显著减少(图3B)。重要的是,在Bud31-sKO的P12睾丸中没有观察到晚于具有瘦素前期样染色体的精母细胞,而此时在对照睾丸中已经很明显地发现了丰富的合子染色体(图3C)。这表明Bud31是生殖细胞进入减数分裂所必需的。
Stra8的表达是生殖细胞进入减数分裂所必需的,在P10小鼠的生精小管中对Stra8进行免疫荧光染色,发现与对照组相比,Bud31-sKO睾丸中的Stra8信号明显减弱(图3D)。qPCR检测显示,与对照组相比,P10期Bud31-sKO小鼠中Stra8及其已知下游转录激活靶点Hoxa1和Cyp26a1的水平显著下降(图3E)。qPCR和免疫印迹评估Stra8,与对照组相比,P4期Bud31-vKO睾丸的Stra8水平显著降低(图3F-G)。这些结果再次支持Bud31具有调节减数分裂起始的功能。
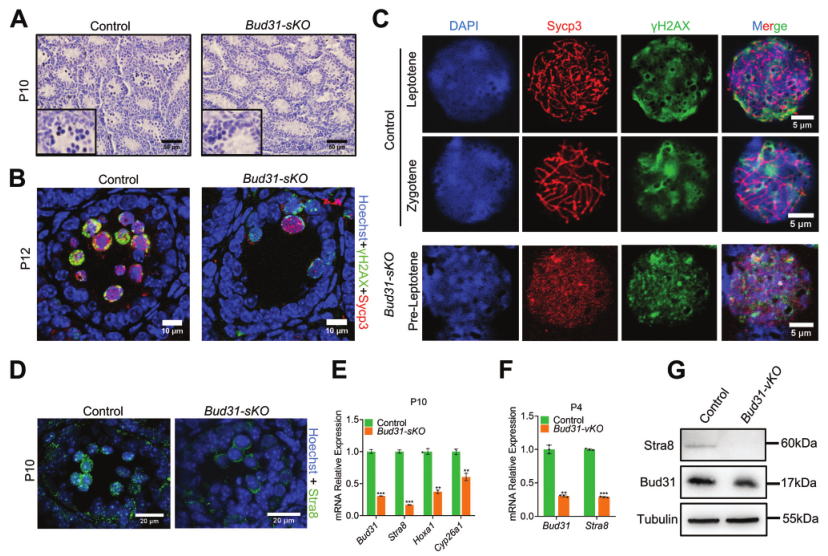
图3缺乏bud31的雄性生殖细胞无法进入减数分裂
4、Bud31在生精细胞中调控AS
为探索Bud31在精子发生中对AS的作用,使用rMATS对SMART-seq数据进行AS分析。Bud31缺失导致了总共1948个AS事件(图4A-B)。随后分析reads的映射分布,发现Bud31缺失显著降低了外显子reads的比例,增加了内含子和基因间reads的比例(图4C)。此外,利用SMART-seq数据计算剪接效率,发现敲除Bud31后,5 '剪接位点和3 '剪接位点的效率均显著降低(图4D),表明Bud31缺失后AS受损。
为确定Bud31在精子发生中的全基因组结合位点和靶点,利用P14野生型小鼠的生精细胞进行RIP-seq,RIP峰值分布分析显示,Bud31主要定位于pre- mRNA的内含子区域(图4E)。进一步分析了reads强度,发现Bud31在剪接位点周围的exon-intron区域高度富集(图4F)。此外,使用HOMER算法来识别Bud31识别的RNAmotif,发现最丰富的元件是UUUAAAA和GAGGCAGG(图4G),这对识别潜在的结合位点很有用。
为在生精细胞中识别Bud31调控的AS候选靶点,将来自RIP-seq数据中的Bud31结合基因(3258个基因)与来自SMART-seq数据集的AS相关基因(1591个基因)进行了比较,并鉴定出392个交集基因(图4H)。对392个基因进行通路富集分析,发现包括减数分裂细胞周期和细胞分裂在内的通路高度富集(图4I)。以上结果表明Bud31在生精细胞中调控AS。

图4 Bud31在生精细胞中调控AS
5、Bud31缺失导致Cdk2第一个内含子的保留增加
为确定导致Bud31cKO小鼠表型的靶点,在Bud31缺失时检测了392个基因和701个下调基因(图4J)。发现12个基因,包括Cdk2,Ccdc62和Lbr都是差异剪接和下调的(图4K)。作者关注Cdk2,它对小鼠的生存能力并不重要,但其缺失已被证明会导致男性不育[29]。SMART-seq分析显示,Bud31的中断导致Cdk2前mRNA的第一个内含子的保留(图5A,上),RIP-seq数据支持Bud31结合Cdk2的内含子1(图5A,下)。用半定量RT-PCR方法验证Bud31对Cdk2的影响,该方法在P10Bud31-sKO和同源对照小鼠的睾丸中使用了同源引物(图5B)。为获得进一步的证据,构建了跨越内含子1的小基因,并通过将小基因与Bud31siRNA结合转染GC-1细胞来进行剪接试验。Bud31的耗竭显著增加了Cdk2的内含子保留的转录物(图5C)。用qPCR分析了P10睾丸中长短异构体的比例,观察到Bud31缺失后Cdk2的长短异构体比例明显增加(图5D)。此外,为证实Bud31对Cdk2的影响,进行剪接报告试验。使用siRNAs对Bud31进行敲除,显著降低了由含Cdk2内含子1的报告片段编码的荧光素酶活性(图5E)。为获得Bud31与Cdk2直接结合的进一步证据,使用Bud31抗体在P14小鼠睾丸中进行RIP试验,如预期地,RIP-qPCR显示Bud31与Cdk2pre-mRNA的内含子1结合(图5F)。此外,RNA pull-down实验显示Bud31被生物素标记的Cdk2探针成功下拉(图5G)。
内含子保留可以在转录后水平上减少基因表达。因此,在P10小鼠睾丸中进行qPCR,发现与对照组相比,Bud31-sKO小鼠睾丸中的Cdk2表达明显下调(图5H)。还发现,在GC-1细胞中,由siRNA介导的对Bud31的敲除导致Cdk2水平明显降低(图5I)。免疫印迹法进一步证明,与对照组相比,Bud31-vKO小鼠睾丸中这两种蛋白的异构体都明显减少(图5J)。这些发现表明,Bud31的缺失导致内含子1的保留,从而导致Cdk2的表达减少。总之,这些数据表明,Bud31介导的替代剪接参与精子发生的调节。
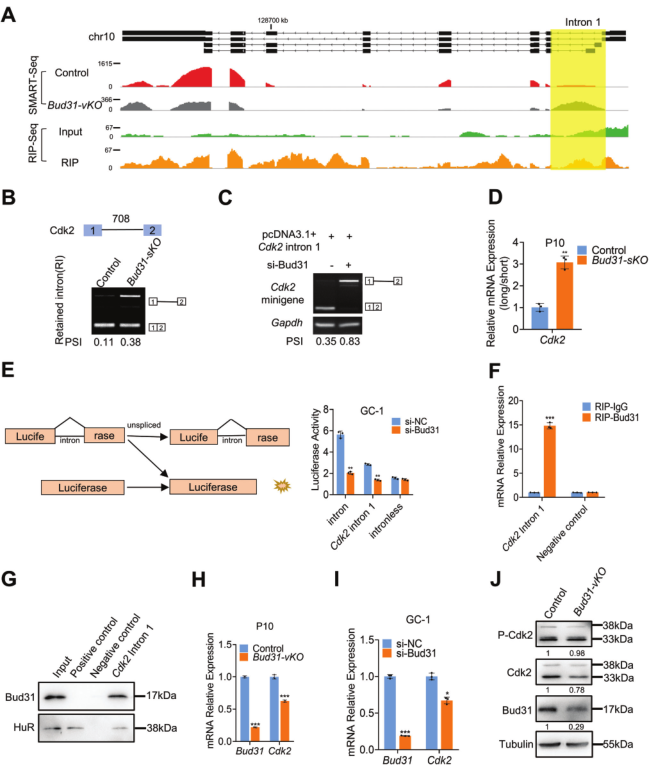
图5Bud31缺失导致Cdk2第一个内含子的保留增加
参考文献:
Qin, J., Huang, T., Wang, Z. et al. Bud31-mediated alternative splicing is required for spermatogonial stem cell self-renewal and differentiation. Cell Death Differ 30, 184–194 (2023). https://doi.org/10.1038/s41418-022-01057-1






