间充质基质细胞相关迁移体:造血来源细胞化学引诱剂的新来源
间充质基质细胞(Mesenchymal stromal cells, MSCs)是一种特殊的多能细胞,通过各种途径调节适应性免疫反应和促进造血。分离后,根据其在塑料培养皿上的黏附和增殖,呈现为具有分化为成骨细胞、软骨细胞和脂肪细胞能力的异种群体。因此在再生医学中具有巨大的治疗应用潜力。近年来一种新的细胞间通讯机制被描述,这种机制是基于大的石榴形结构,包裹着许多小泡,称为迁移体。这些独特的结构发育在迁移细胞后方的回缩纤维上,形成了迁移体网络。间充质干细胞是否利用这些特殊的细胞器在骨髓微环境的细胞组分之间交换信息尚未可知。
技术路线:

主要研究结果:
1. 间充质干细胞通过两种不同的细胞机制产生迁移体网络
作者研究了癌细胞和基质细胞之间的相互作用,发现黏附在塑料上的原代人MSCs在纤维连接蛋白(5µg/cm2)包被的玻璃玻片上生长24小时后,会沿收缩纤维网络产生一种新型的细胞突起,称为迁移体(图1A)。通过荧光素标记的WGA染色观察到的这些结构出现在分支点或沿着收缩纤维,以及在末端(图1A、B)。从结构上看,它们的外观大小不一(图1A,黑色箭头和白色箭头)。随着时间的推移,当回缩纤维被降解时,作者还观察到明显的无细胞和脱落的迁移体(图1C)。定量分析显示,无论培养时间是24到72小时,大约25-40%的MSCs都有迁移体(图1D)。然而,在此期间,每个细胞的迁移体数量减少,而游离的、脱离的迁移体数量增加(图1D、E)。扫描电子显微镜可以在高分辨率下观察到或小或大的与收缩纤维相关的和游离的迁移体(图1F-H)。延时视频显微镜显示了迁移体的动态成熟,即沿着收缩纤维从早期(小的三角形)到完全形成(大的圆形)迁移体(图1I、J)。这些活细胞图像强调了迁移体形成的两种主要机制。它们在非迁移细胞(图1I)或迁移后的MSC(图1J)的膜回缩形成的回缩纤维上发育。在这两种情况下,沿回缩纤维的迁移体可以形成一个“迁移体网络”,作为迁移细胞背后或围绕非迁移细胞的轨迹(图1K)。
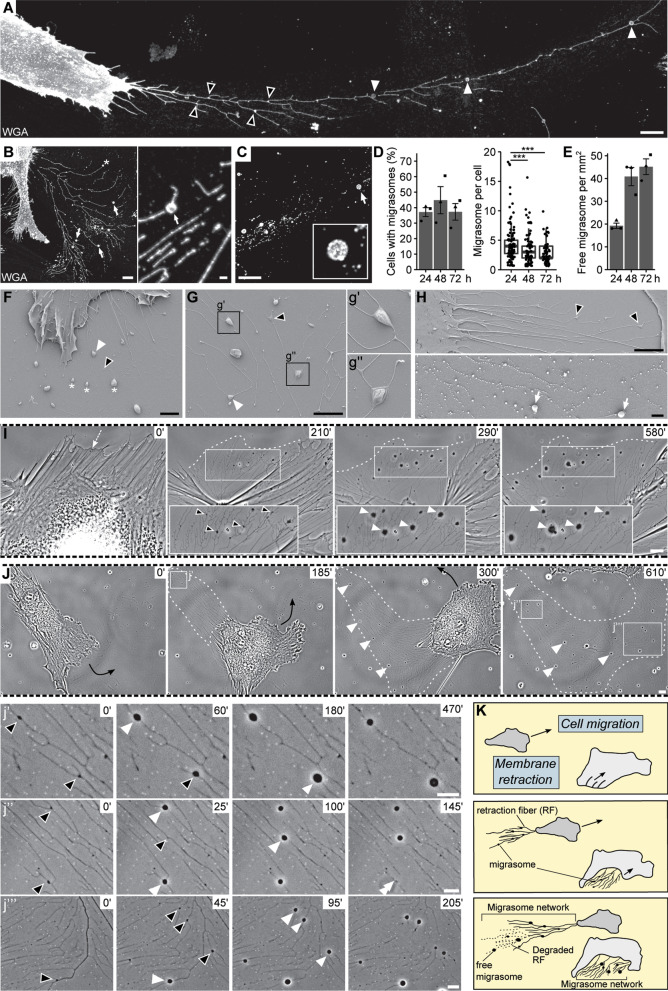
图1 原代人间充质基质细胞产生迁移体网络
然后,作者评估了不同基质对MSCs产生迁移体的潜力。为此,在固定和标记前,作者将MSCs在涂有纤连蛋白(1或5µg/cm2)、IV型胶原(10µg/cm2)、层粘连蛋白(5µg/cm2)或PLL(5µg/cm2)的玻璃玻片上培养24小时(图2)。当在纤维连接蛋白和层粘连蛋白-411和-511上培养时,约50%的MSCs携带有或没有迁移体的回缩纤维(图2A)。当使用玻璃等未涂覆表面时,这一数字显著下降至30%。在ⅳ型胶原、laminin-111/EHS和-521上,含有或不含有迁移体的回缩纤维的MSCs数量减少。对于ⅳ型胶原,以及层粘连蛋白-411/-511,作者观察到含有迁移体的回缩纤维多于不含迁移体的回缩纤维,这与其他衬底或未涂层表面形成对比,后者约50%的回缩纤维带有迁移体。有趣的是,当使用PLL时,沿回缩纤维的迁移体的存在大大增加(图2A)。此外,对每个细胞的迁移体数量进行的定量分析表明,与所有其他底物相比,它们在PLL上的存在显著增加(图2B),这表明强烈的附着是它们形成的先决条件。
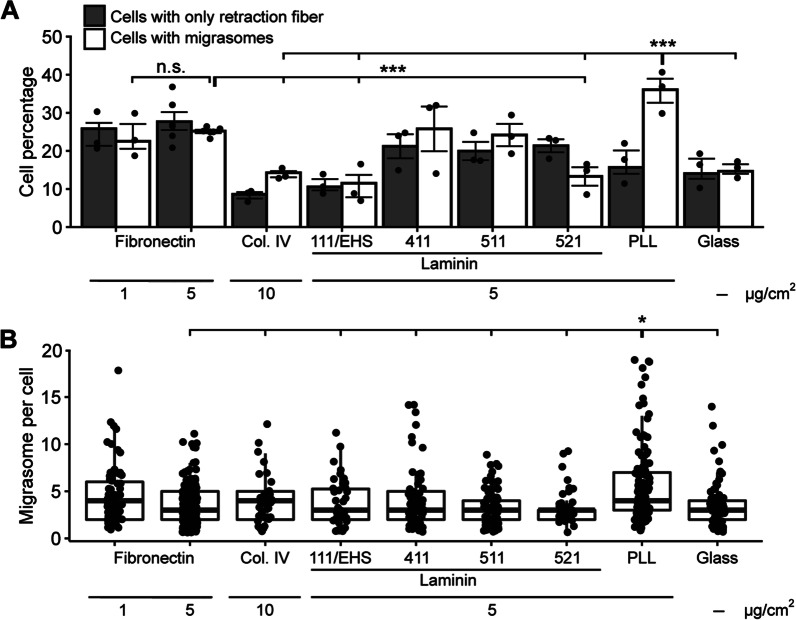
图2 基质底物对迁移体形成的影响
2. 间充质干细胞相关迁移体含有F-肌动蛋白和微管蛋白
为了获得迁移体组成的信息,包括细胞骨架的组织和动力学,作者使用SiR-Actin(一种细胞通透性荧光剂,可特异性标记F-actin)对MSCs进行染色,并对α-微管蛋白进行免疫染色。用WGA对细胞进行复染,以突出细胞的整体结构。CLSM分析显示,肌动蛋白存在于收缩纤维和与其相关的迁移体中,而α-微管蛋白仅限于迁移体(图3A)。注意F-actin在回缩纤维中的分布并不均匀,提示它是动态定位的。迁移体的3D渲染显示了f -肌动蛋白和α-微管蛋白(图3B)。对未成熟和成熟的迁移体的分析表明,α-微管蛋白出现在迁移体形成的后期阶段(图3C)。荧光素标记的鬼笔环肽也可以检测到收缩纤维和PFA固定的MSCs的迁移体中的F-actin,而不是SiR-Actin(图3D)。由于f -肌动蛋白沿回缩纤维的异质性分布,作者通过TIRF显微镜观察到活细胞中f -肌动蛋白的动态变化,突出了肌动蛋白沿回缩纤维和迁移体的运输(图3E)。
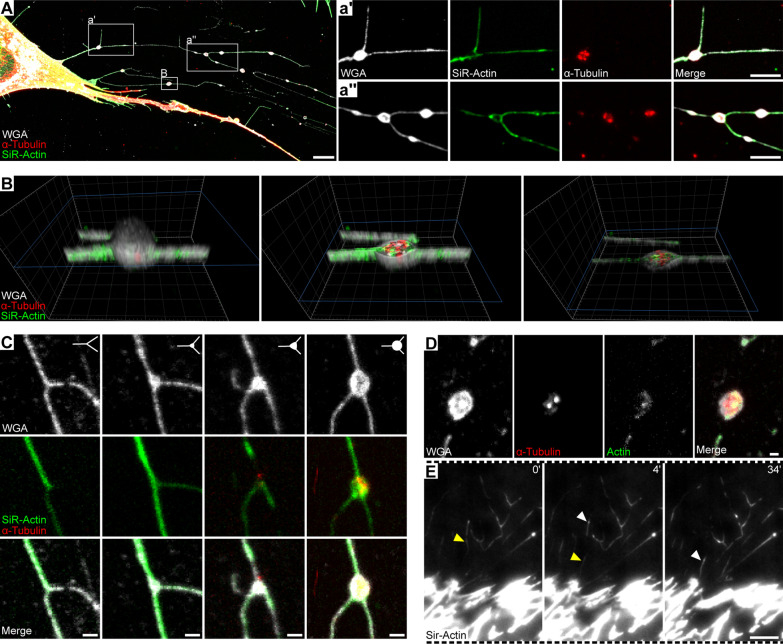
图3 F-肌动蛋白与回缩纤维和迁移体有关,微管蛋白仅限于迁移体
3. 间充质干细胞相关迁移体含有晚期内体/多泡体,但没有线粒体
由于迁移体和回缩纤维在迁移细胞背后或非迁移细胞周围形成了一个广泛的网络,确定某些间充质干细胞表面标志物是否在这个细胞网络中表达是很有意义的。作者通过免疫标记检测了CD44、CD73、CD90、CD105和CD166的存在。在纤维连接蛋白包被的玻璃玻片上培养的MSCs中检测到上述5种标志物。除CD166外,所有这些分子均在回缩纤维和迁移体中被发现(图4A)。CD44沿回缩纤维均匀出现,而CD90和CD105呈点状染色(图4A)。CD73被认为是分离MSCs的一个有前景的标志物,它沿回缩纤维呈稀疏的点状存在(图4A)。CD166是一种跨膜黏附蛋白,参与同源性和异型性相互作用,调节造血干细胞龛和血管生成。这种蛋白选择性地集中在迁移体中,而在回缩纤维中几乎检测不到(图4A)。它出现在迁移体形成的早期阶段,即在其中的微管蛋白出现之前(图4B)。有趣的是,对成熟迁移体表面的CD166免疫标记进行的定量分析显示,相对于细胞表面,CD166在该位置选择性富集(图4C、D)。除了回缩纤维外,在迁移体中也检测到四跨膜蛋白CD9(CD166的相互作用伙伴,调节其黏附特性)(图4E)。在这些网络中检测到其他四种四跨膜蛋白(CD63、CD81、TSPAN2和TSPAN4)(图4E、F)。TSPAN4与CD166一样,对迁移体具有特异性(图4F)。CD63存在于迁移体的表面和内部(图4G)。CD63是LE/MVB中发现的腔内小泡的标志物,LE/MVB与质膜融合后以外泌体的形式释放。迁移体的3D渲染突出了内囊泡中CD63的存在(图4H)。为了证实LE/MVB在迁移体中的存在,作者使用针对小GTP酶Rab7的抗体标记间充质干细胞,或者使用编码Rab7-GFP融合蛋白的质粒瞬时转染它们。两种方法都显示了Rab7在迁移体中的存在(图4I、J)。CD63与Rab7-GFP的共标记显示了它们在迁移体中的存在(图4J、K),3D渲染显示了它们的亚迁移体定位(图4L)。有趣的是,当后者的结构在收缩纤维降解后与细胞分离时,它们仍然存在于迁移体中(图4K),这表明MSCs的一些细胞成分可能在它们不与细胞本身直接接触时发挥作用。
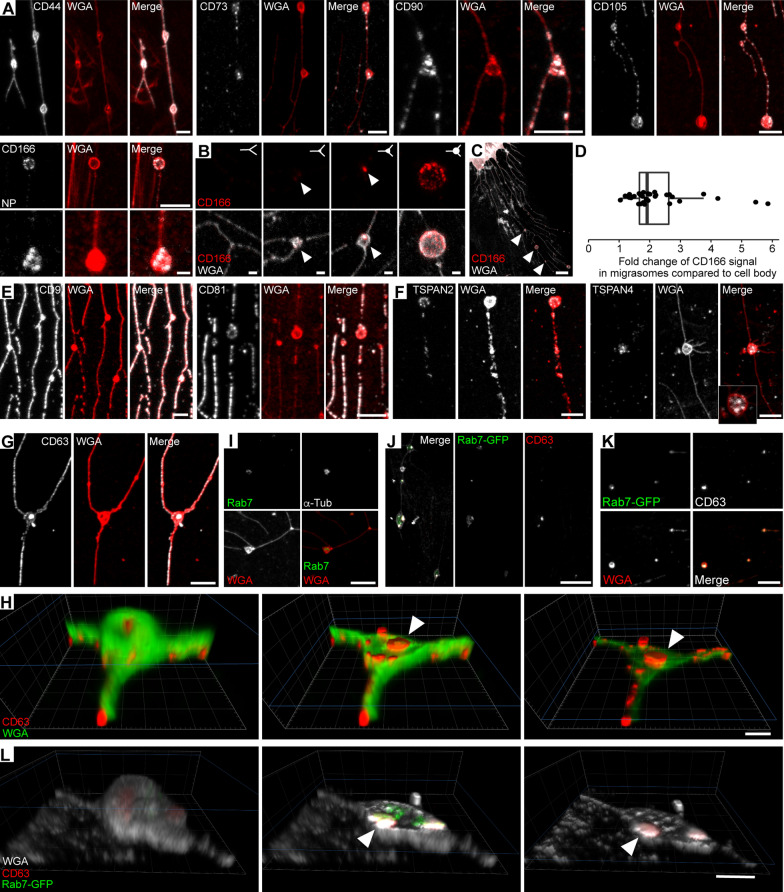
图4 MSC来源的迁移体表现出独特的细胞表面CD标志物谱并携带细胞内囊泡
4. MSC相关的迁移体含有信号分子
为了更好地理解间充质干细胞相关的迁移体的作用,特别是在细胞间信号传导的背景下,作者研究了是否存在趋化因子SDF-1。作者根据免疫染色和融合蛋白的表达再次使用了两种不同的方法(图5A、B)。SDF-1的免疫反应在迁移体中被检测到,并在沿回缩纤维的点状模式中被检测到(图5A),这表明SDF-1被主动转运到回缩纤维相关的迁移体中。类似地,SDF-1-GFP的异位表达显示其并入附着于回缩纤维的迁移体(图5B)。值得注意的是,只有一小部分迁移体含有SDF-1(即约占所有迁移体的13%;60个迁移体,n = 10个细胞)的免疫染色或异位表达结果表明,其在其中的积累是受调节的。SDF-1作为一种趋化因子,由MSCs分泌,在骨髓干细胞龛环境下,在HSPC归巢过程中发挥作用。通过相位对比显微镜观察发现,迁移体的相移发生了突然变化(图5C,插图c ',黑色→黄色星号),这可以解释为它们的膜完整性丧失,表明它们的货物被释放。后者可能解释了含有SDF-1的迁移体比例较低。除了释放它们的内容物,迁移体也被释放到条件培养基中(图5C,插入c ',红色星号)。
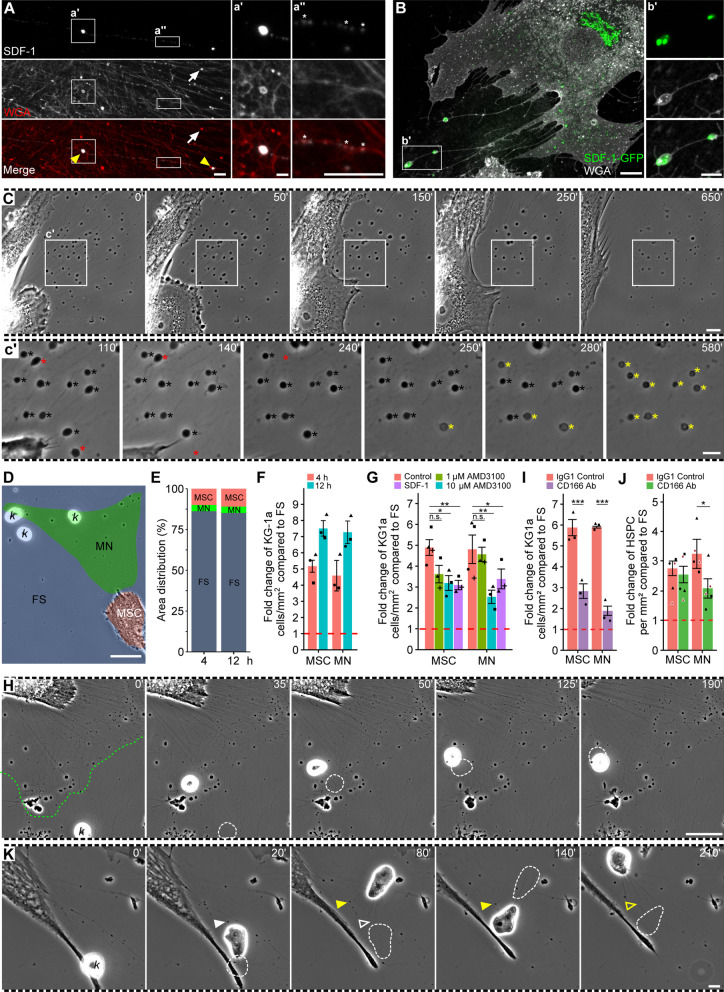
图5 MSC来源的迁移体可以作为化学引诱细胞器
5. 间充质干细胞相关迁移体吸引白血病 KG-1a 细胞和原代 CD34HSPC+
为了评估间充质干细胞相关的迁移体网络对造血来源细胞的影响,作者将生长在纤维连接蛋白包被的玻璃玻片上的间充质干细胞与白血病KG-1a细胞共培养4和12小时,然后评估与细胞和/或迁移体网络相关的癌细胞数量。首先,对细胞或迁移体覆盖的表面积进行的量化显示,它们占总表面积的25%以下,这在观察的时间点之间是一致的(图5D、E)。有趣的是,随着时间的推移,白血病细胞的分布显示出对MSCs和迁移体网络的强烈偏好(图5F)。因此,KG-1a细胞优先粘附于定居的间充质干细胞及其迁移体,而不是被纤维连接蛋白作为细胞外基质成分包裹的游离表面,这表明释放的因子如趋化因子SDF-1吸引了它们和/或粘附蛋白保留了它们。在共培养的细胞中加入CXCR4特异性抑制剂AMD3100。当使用10µM AMD3100时,与MSCs或迁移体网络相互作用的白血病细胞数量显著减少(图5G),表明CXCR4-SDF-1轴参与KG-1a细胞的选择性定位。通过在共培养基中添加重组SDF-1(100 ng/mL)进一步研究CXCR4-SDF-1轴的意义(图5G)。加入重组SDF-1显著减少了与MSCs和迁移体网络相关的白血病细胞数量(图5G),提示MSCs和迁移体产生的SDF-1梯度被减弱。间接地,这些实验表明癌细胞在间充质干细胞或迁移体上的积累不是一个随机事件。延时视频显微镜显示了KG-1a细胞向迁移体的定向迁移以及迁移体在迁移体中的滞留(图5H)。
接下来,作者研究了细胞黏附分子CD166在KG-1a细胞选择性滞留在间充质干细胞或迁移体网络中的作用。为此,作者将MSCs与抗CD166抗体(5µg/mL)或小鼠IgG对照抗体预孵育2小时,然后去除抗体并引入KG-1a细胞4小时。有趣的是,作者观察到与MSCs和迁移体网络相关的KG-1a细胞显著减少(图5I)。值得注意的是,抗CD166抗体对迁移体网络的影响似乎比对MSCs的影响更深刻,这表明迁移体上选择性的CD166浓度在其中的白血病细胞滞留起作用。
最后,如上所述评估CD166的影响。与白血病细胞相比,抗CD166抗体的添加并没有改变CD34 HSPC对MSC本身的偏好,但显著降低了对迁移体网络的偏好(图5J)。CD166在迁移体上的强表达和/或CD166相互作用伴侣的存在与否或造血细胞可能解释了MSC与其迁移体网络之间以及癌细胞和CD34 HSPC之间的这种差异影响。
6. 间充质干细胞相关的迁移体被迁移的白血病细胞选择性吸收,但不被CD34HSPC选择性吸收
通过研究造血起源的细胞是否以CXCR4-SDF-1-依赖性方式吸引到MSC相关的迁移体网络中,作者注意到迁移白血病细胞可以吸收迁移体。延时视频显微镜显示,迁移的KG-1a细胞在运动过程中可以吸收回缩纤维附着或无细胞迁移体(图5K)。在相同条件下,作者没有观察到原代CD34 HSPC摄取与MSC相关的迁移体。相反,被吸引的CD34 HSPC即使在接触迁移体后仍继续运动。
结论:
该研究描述了一种MSCs与造血来源细胞进行通信的新机制,需要进一步的研究来破译健康和转化骨髓微环境中迁移体的所有生物学方面。
参考文献:
Deniz IA, Karbanová J, Wobus M, et al. Mesenchymal stromal cell-associated migrasomes: a new source of chemoattractant for cells of hematopoietic origin. Cell Commun Signal. 2023 Feb 14;21(1):36.






