新亚群发高分——CD36+ CAFs的免疫功能
实验方法:CRISPR-Cas9敲低小鼠和模型构建,单细胞RNA测序和生物信息学分析,慢病毒包装,ELISA,ChIP,RT-qPCR,多重免疫荧光(mIF)染色,IHC实验,细胞共培养,脂肪酸或脂蛋白的摄取、脂质过氧化实验,核质分离实验,流式细胞术,迁移抑制因子(MIF)染色实验
肝细胞癌(HCC)是一种具有高度细胞异质性的免疫治疗耐药恶性肿瘤。细胞类型的多样性以及肿瘤细胞与非肿瘤细胞之间的相互作用仍有待阐明。人类和小鼠HCC肿瘤的单细胞RNA测序显示癌症相关成纤维细胞(CAF)的异质性。本研究进一步分析证实CD36+ CAFs通过分泌巨噬细胞迁移抑制因子为HCC提供免疫抑制微环境。
技术路线:

主要实验结果:
1、单细胞分析揭示人HCC肿瘤的复杂性
对7例原代HCC肿瘤组织和癌旁组织进行单细胞RNA测序(图1a)。对细胞进行过滤和归一化后进行主成分分析,使用已知的细胞markers细胞共分为9种类型,包括上皮和肿瘤细胞,B细胞,T细胞,NK细胞,髓源性抑制细胞(MDSCs),单核细胞或巨噬细胞,树突状细胞,成纤维细胞,内皮细胞(图1b和1c)。
2、人HCC中5种CAFs亚型的鉴定和分子特征
α-SMA的IHC染色显示,80%以上的HCC病例以成纤维细胞激活和积累引起的广泛肝纤维化为特征(图1d)。对本研究单细胞RNA测序中的CAFs进行进一步聚类,发现其分为5种亚型(图1e),它们都高表达经典成纤维细胞markers,然而,不同亚群表型出截然不同的转录组特征(图1f-g)。其中Subcluster 0 CAFs占CAF群体的约40%,并以MYH11、MUSTN1和MCAM等标志性微血管基因为特征(图1f-g)。因此,将其命名为血管CAFs(vCAFs,vCAFs-c0-MYH11)。GO和KEGG分析显示vCAFs显著富集至血管平滑肌收缩和对钙离子的反应,与它们的微血管特征一致(图1h-i)。Subcluster 2 CAFs表达低水平α-SMA和高水平ECM特征(图1f-g)。GO显示这个亚群与ECM和胶原纤维组织有关(图1h-i),因此,将其命名为matrix CAFs(mCAFs,mCAFs-c2-LUM)。此外,Subcluster 1 CAFs高表达脂质相关基因(图1f-g),且富集至ECM,胆固醇代谢,脂肪酸代谢等,提示其可能参与ECM和胆固醇代谢(图1h-i),因而命名为脂质处理mCAFs(lpmCAFs,lpmCAFs-c1-CD36)。类似的,根据其高表达基因特性和KEGG富集特征,将Subcluster 3 CAFs命名为脂质处理CAFs(lpCAFs,lpCAFs-c1-APOA1);Subcluster 4 CAFs命名为抗原呈递CAFs(apCAFs,apCAFs-c4-HLA-DRA)。为探索不同病因引起的CAF亚型的异质性,对7个非HBV相关的HCC肿瘤进行了scRNA-seq,发现与HBV-HCC相比,非HBV HCC中CD36+ CAFs和lpCAFs的比例显著降低(图1j-l)。最后,使用多重免疫荧光染色证实了人HCC样本中存在主要CAFs亚群(图1m)。
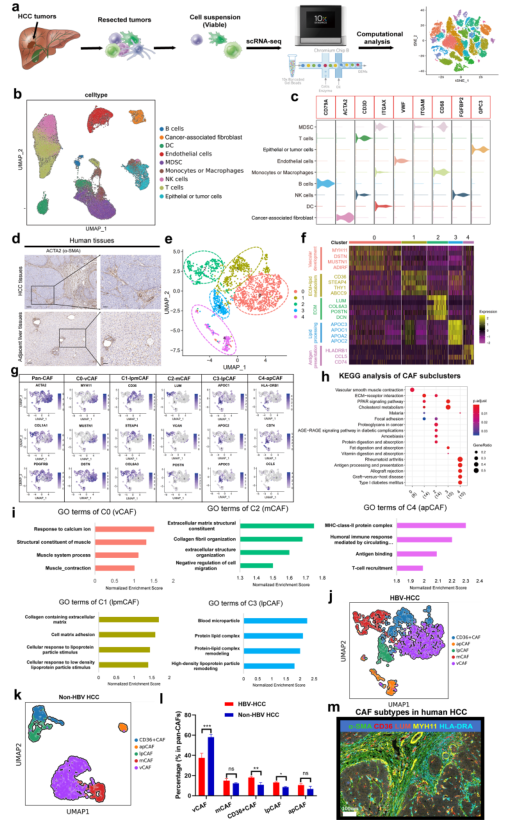
图1人类HBV相关HCC中不同的成纤维细胞亚群
3、小鼠HCC肿瘤中CAF亚型的单细胞分析概括了人类HCC中发现的亚型
在上述人的HCC样本证实存在5种CAFs,为进行更深入的CAF表征,将研究扩展到小鼠HCC模型。将px330-sg-p53和CMV-SB13联合CTNNB1-N90尾静脉注入6周龄C57BL/6J小鼠,建立CTNNB1N90;Trp53KO肝癌小鼠模型,以模拟肝癌遗传背景(图2a)。基于该模型,将7个肝癌小鼠肿瘤分离成单细胞,严格过滤后共获得63977个活细胞,分为10个簇(图2b)。随后,其中1746个CAFs聚为7个亚群(图2c),它们都高表达经典成纤维细胞markers,然而,不同亚群表型出截然不同的转录组特征(图2d-e)。有趣的是,在人样本鉴定到的5个CAFs亚群也都存在于这小鼠样本中(图2c)。CD36+ CAFs和lpCAFs富集了包括ROS和代谢在内的上调通路(图2f)。最后,使用Myh11、Lum、Acta2、Cd36和H2-Aa等特异性标记物进行mIF染色,以确认主要CAF簇也存在于小鼠HCC组织中(图2g)。
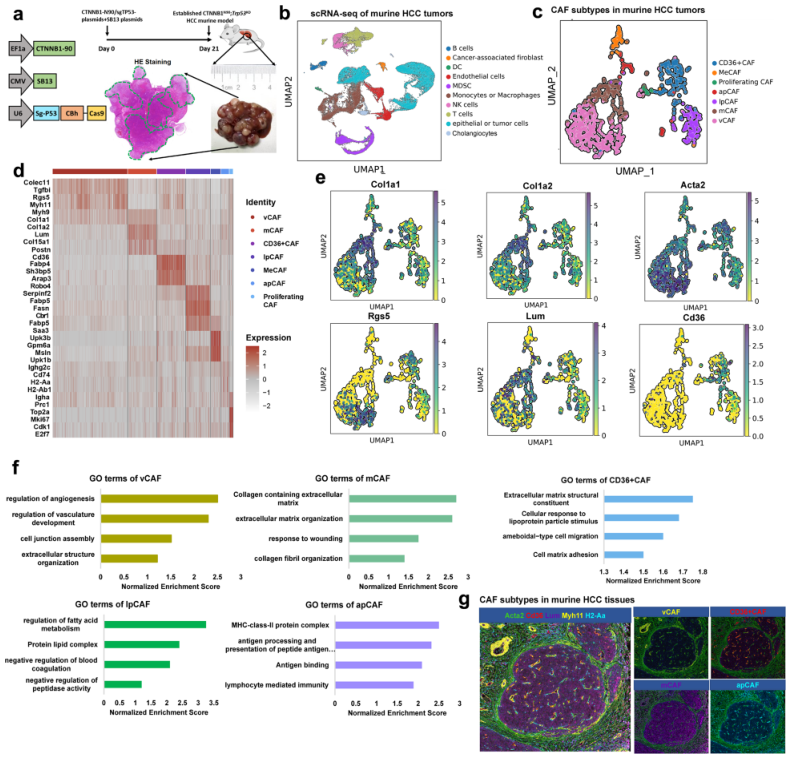
图2小鼠HCC组织中不同的成纤维细胞亚群
4、CAFs亚型特异性转录因子(TFs)和基因调控网络
接下来,确定TFs及其靶基因调控网络,以更好地理解CAF亚型如何在遗传上建立和维持。为此,应用SCENIC21软件确定了在一种CAF亚型中相对于其他亚型具有高度活性的TFs及其靶点。观察到vCAFs富集于MEF2C和FOS(图3a, b),而MEF2C和FOS先前被认为调节新生血管生成。此外,MEF2C的靶基因MYLK、ACTA2和MYH11在vCAFs中表达上调(图3d)。TWIST1和CREB3L1是mCAFs中最高表达TFs(图3a, c)。TWIST1是CAF转分化的关键因子。TWIST1靶基因大部分在mCAFs中上调(图3d)。lpmCAFs (CD36+ CAFs)显示CEBPD的高表达(图3a, c)。脂蛋白脂肪酶LPL靶基因在lpmCAFs中上调表达(图3d)。除了CEBPD,lpCAFs还高表达CEBPA和MAFB(图3a, c),它们是已知TF参与促进LDL代谢转录程序。apCAFs高表达IKZF1和RUNX3(图3a, c),它们与巨噬细胞极化和T细胞招募有关。为检测在这些小鼠CAF亚群中活跃的主调控因子,进行SCENIC分析,结果显示Mef2c和Foxf1是小鼠vCAFs中活跃的TF基因,与人类vCAFs相似(图3e,f)。
5、CD36+ CAFs与MDSCs呈正相关,在HCC肿瘤中与MDSCs接近
接下来探索异质性CAF与TME中其他细胞之间的特异性串扰机制。在所有已知的配体-受体对中,MIF信号通路以MIF配体及其CD74/CXCR4受体为主。有趣的是,lpmCAFs和lpCAFs高表达CD36(图1g),CD36是作用于MDSCs的MIF配体的最主要来源。因此,作者使用特定的表面标记在lpmCAFs (c1-mCAF-CD36)和lpCAFs中鉴定CD36,并发现它们都在脂肪生成通路中富集(图3g)。mIF实验表明,与癌旁组织相比,CD36+ CAFs在小鼠和人的肿瘤组织中特异性浸润(图3h, i)。随后研究了CD36+ CAFs与TME内效应T细胞MDSCs之间是否存在相关性。scRNA-seq数据显示CD36+ CAFs与MDSCs呈正相关,但和效应T细胞呈负相关(图3j),该结果被临床切片组织染色证实(图3k-l)。此外,对12例HCC肿瘤进行单细胞核测序,发现CD36+ CAFs的数量与MDSCs的数量呈正相关(图3m)。mIF染色显示CD36+ CAFs比CD36- CAFs更接近MDSCs(图3n)。总之,这些结果表明CD36+ CAFs可能赋予HCC有效的免疫抑制作用。
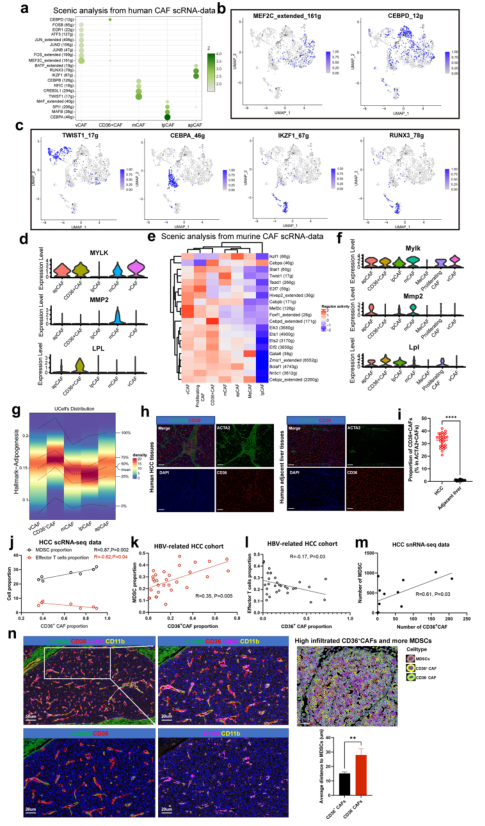
图3 CAFs的特异性TF以及CAFs和MDSCs之间的相互作用
6、CD36在CD36+ CAFs中通过脂质过氧化/p38/CEBPs轴介导OxLDL摄取促进MIF表达
利用图4a中的流式细胞术策略分离CD36+ CAFs,此外,其分离的CAFs细胞类型比例和小鼠即人样本中的分布类似(图4b-c)。随后测试不同类型CAFs产生MIF的水平。结果显示CD36+ CAFs产生的MIF水平显著高于其它类型(图4d,e)。基于这些结果,作者将重点放在CD36+ CAFs的这个亚簇上进行进一步研究。WB和ELISA证实当在CD36+ CAFs细胞中沉默CD36(CD36kd CAFs)后MIF的表达和分泌显著减少(图4f)。此外,与前文单细胞测序结果的信号通路分析类似,作者发现CD36+ CAFs中脂质过氧化相关基因的表达显著高于CD36kd CAFs(图4h)。使用荧光偶联OxLDL和流式细胞术,发现CD36+ CAFs比CD36kd CAFs有更高的OxLDL摄取率(图4i, j)。CD36+ CAFs的脂质过氧化也显著高于CD36kd CAFs(图4k)。接下来确定OxLDL是否会增加CD36+ CAFs中的脂质过氧化,结果显示OxLDL以剂量依赖的方式增强CD36+ CAFs的脂质过氧化作用,而LDL则没有(图4l)。此外,通过检测CD36+ CAFs中p38的磷酸化来检测OxLDL是否可以激活p38,结果发现OxLDL诱导CD36+ CAFs的p38磷酸化,但在CD36kd CAFs中程度较低,并且添加Toco或SSO降低了OxLDL诱导的p38磷酸化(图4m),并且p38磷酸化在CD36+ CAFs中的富集显著高于CD36敲除或阴性CAFs细胞(图4n)。这些表明OxLDL通过CD36和脂质过氧化促进p38激活。在OxLDL存在时,p38抑制部分挽救了MIF的分泌(图4o),表明OxLDL部分通过p38激活促进MIF的分泌。

图4CD36在CD36+ CAF中通过脂质过氧化/p38/CEBPs轴介导OxLDL摄取促进MIF表达
7、CD36+ CAF来源的MIF通过激活IL-6/ STAT3增强MDSCs促进免疫抑制性TME和肿瘤干性的能力
为确定来自肿瘤细胞或CD36+ CAFs的MIF是否介导CD33+ MDSC扩增的调节,从人HBV相关或小鼠HCC肿瘤中分离出人或鼠CD36+ CAFs。采用CD36+ CAFs条件培养基(CD36+ CAFs-CM)、CD36 - CAFs、CD36kd CAFs-CM、CD36+ CAFs +MIF抑制(ISO-1)或CD74阻断处理MDSC前体细胞,检测CD33+ MDSC比例(图5a, b)。CD36+ CAFs-CM,MIF可增加CD33+ MDSCs的数量;与CD36kd CAFs-CM类似,CD36+ CAFs +ISO-1和CD36+ CAFs +CD74阻断表现出良好的抑制效应在CD33+ MDSC扩增时(图5c)。表明MIF分泌是CD36+ CAFs调节MDSC扩张的关键中介。
在免疫正常小鼠的原位肝癌模型中,发现注射从小鼠肝癌肿瘤中分离的CD36+ CAFs显著促进肝癌肿瘤细胞在小鼠肝脏中的生长或转移,而这种促进作用被特异性敲低CD36,抑制MIF或去除Gr-1+ MDSCs所抑制(图5d, e)。此外,注射CD36+ CAFs显著增加Treg的浸润,但减少肿瘤中效应CD8+ T细胞,这种作用同样被特异性敲低CD36,抑制MIF或去除Gr-1+ MDSCs所抑制(图5f, g)。
为研究CD36+CAFs是否能通过iNOS信号调节MDSCs以增强其免疫抑制能力,从原代CD36+CAFs、CD33+MDSCs中收集CM,或分别从CD36+CAFs、CD36kd CAFs、CD36+ CAFs +CD74的CM预处理的CD33+MDSCs的培养物中收集CM,评估iNOS的水平。结果显示CD36+CAFs-MDSC-CM,而不是CD36kd CAF-MDSC-CM或来自CD74或MDSC阻断的细胞的CM,极大地促进了MDSCs的iNOS的分泌(图5h)。此外,共培养实验显示,与MDSC-WT组相比,CD36+ CAFs+MDSC组的CD69+、IFNG+CD8+T细胞的比例明显下调,但Tregs和PD1+CD8+T细胞的比例上调,而CD36+ CAFs+MDSC+ISO-1或CD74阻断引起的影响轻微(图5i, j)。表明CD36+ CAFs发挥免疫抑制作用是以CD36依赖的方式通过MIF/CD74/iNOS轴。
最后,为探索CD36+CAF衍生的MIF影响MDSCs的分子机制,对MDSC-MIF组和MDSC组进行转录组测序。结果显示,NF-κB信号通路被排在首位,其被报道可调节MDSCs的细胞因子分泌,在用CD36+CAF衍生的MIF预处理的MDSCs中被激活(图5k, l)。此外,CD36+CAF处理的MDSCs中p65磷酸化显著增加(图5m),iNOS和IL-6的分泌也显著增加(图5n)。这些表明CD36+CAF促进MDSCs是通过IL-6介导的。
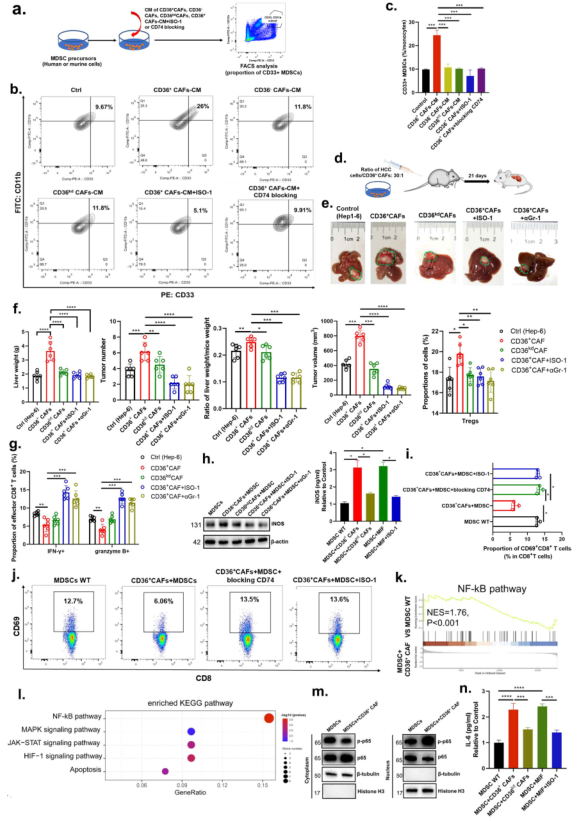
图5 CD36+CAF来源的MIF通过激活IL-6/ STAT3增强MDSCs促进免疫抑制性TME和肿瘤干性的能力
8、在小鼠模型中靶向CD36协同免疫治疗
为进一步研究CD36+和MIF+CAFs是否在HCC启动中发挥作用,建立Cd36(Acta2Cre;Cd36fl/fl)和MIF(Acta2Cre;Miffl/fl)条件性敲除的6周龄小鼠,确定Cd36或MIF在体内被敲除时,HCC肿瘤负担和MDSCs的比例明显减少(图6a-d),这表明CD36+CAFs参与HCC的启动。所以作者猜想CD36+CAFs可能与HCC患者的免疫治疗有关。因此,首先调查了离体的HCC组织中的CD36+CAFs,这些患者接受了新辅助抗PD-1治疗。结果显示,抗PD-1反应组的CD36和α-SMA共表达低于无反应组,表明低数量的CD36+CAFs可以预测更好的HCC免疫治疗反应(图6e,f)。然后,我们在C57/BJ6 CTNNB1N90;Trp53KO HCC模型和作者建立的抗PD1耐药HCC中探索了单药(CD36抑制剂或抗PD-1疗法)和联合治疗策略(CD36抑制和抗PD-1疗法)的疗效。发现,联合治疗在这些HCC小鼠模型中表现出明显的抗肿瘤疗效(图6g-k),并改变了抗肿瘤免疫的免疫格局,Tregs和MDSCs的比例下降,IFN-γ+和颗粒酶B+CD8+T细胞的比例增加(图6l-m)。因此,肿瘤中低数量的CD36+CAFs可能预示着HCC有更好的免疫治疗反应,用SSO靶向CD36可以用来协同提高免疫治疗的效果。
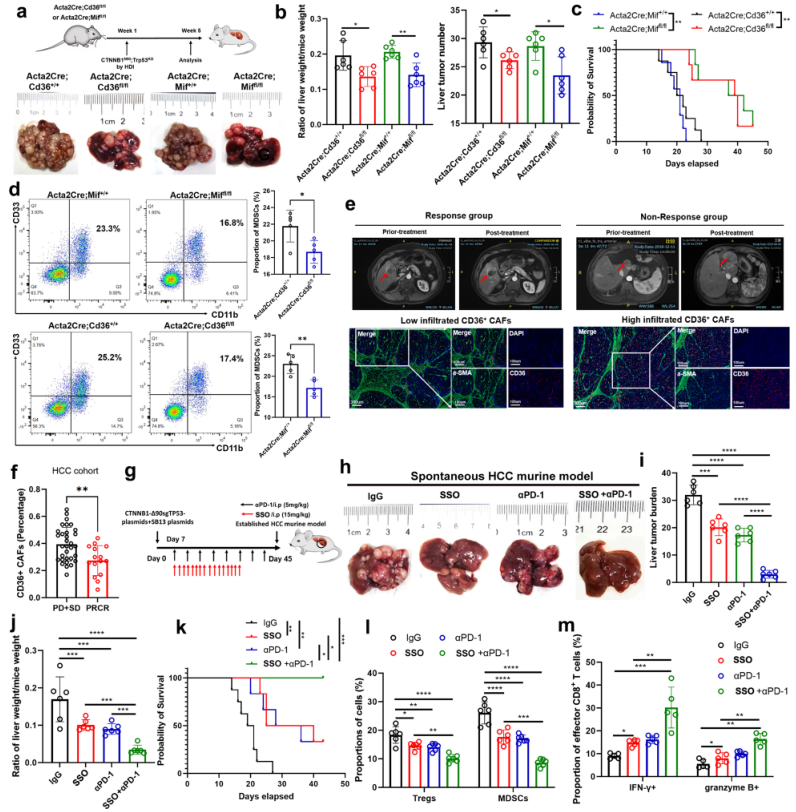
图6CD36+ CAFs预测肝癌免疫治疗的疗效和靶向MIF与肝癌小鼠免疫治疗的协同作用
参考文献:
Zhu, GQ., Tang, Z., Huang, R. et al. CD36+ cancer-associated fibroblasts provide immunosuppressive microenvironment for hepatocellular carcinoma via secretion of macrophage migration inhibitory factor. Cell Discov 9, 25 (2023). https://doi.org/10.1038/s41421-023-00529-z






