CYP1B1在结直肠癌中抑制铁死亡并诱导抗PD-1耐药
实验方法:CCK8、C11-BODIPY试验、WB、泛素化试验、qPCR、动物模型构建、免疫组化。
免疫检查点阻断(ICB)是一种很有前途的治疗结直肠癌(CRC)的策略。然而,大多数结直肠癌患者对ICB治疗反应不佳。越来越多的证据表明,铁死亡在免疫治疗中起着关键作用。诱导肿瘤铁死亡可提高ICB的疗效。CYP1B1是一种参与花生四烯酸代谢的代谢酶。然而,CYP1B1在铁死亡中的作用尚不清楚。在本研究中,我们证明CYP1B1来源的20-HETE激活蛋白激酶C途径,增加FBXO10的表达,进而促进ACSL4的泛素化和降解,最终诱导肿瘤细胞对铁死亡的抵抗。此外,在小鼠模型中,抑制CYP1B1使肿瘤细胞对抗PD-1抗体敏感。此外,CYP1B1表达与ACSL4表达呈负相关,高表达提示CRC预后较差。综上所述,我们的工作确定CYP1B1是增强CRC抗PD-1治疗的潜在生物标志物。
技术路线
结果
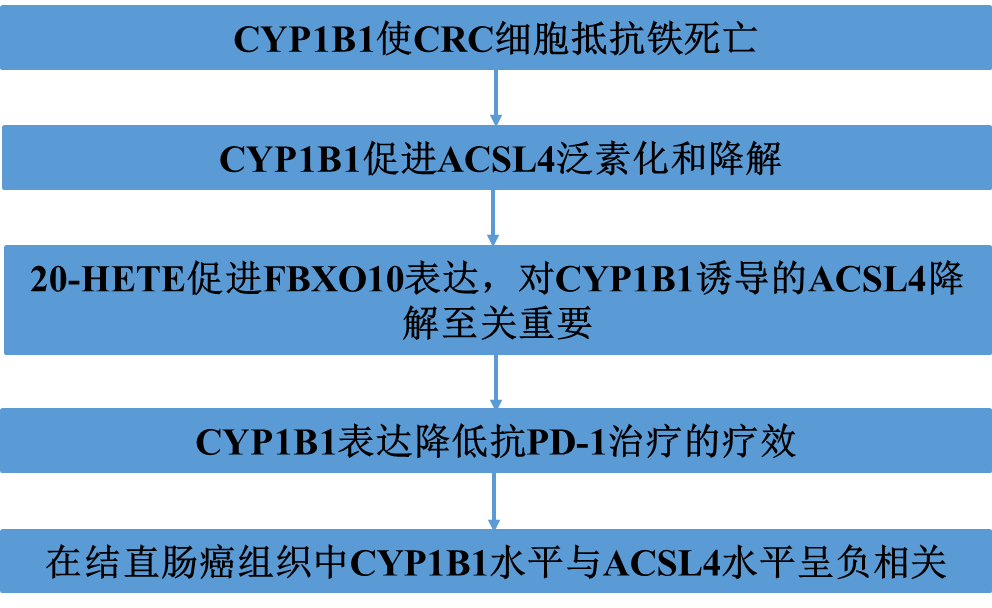
1)CYP1B1使CRC细胞抵抗铁死亡
为了测试CYP1B1是否参与铁死亡,我们在RKO、HCT116和HT29细胞系中产生了CYP1B1过表达或敲低的细胞(图1A、B),并测试了这些细胞对RSL3的药物敏感性。正如预期的那样,CYP1B1异位表达的细胞对RSL3具有抗性(图1C)。相反,CYP1B1敲低导致细胞对RSL3更敏感(图1D)。同时,我们用BODIPY-C11氧化法测量了RKO细胞的膜脂过氧化氢水平。过表达CYP1B1的RKO细胞表现出脂质过氧化降低(图1E, F)。相反,CYP1B1敲低细胞的膜脂过氧化水平显著升高(图1G, H)。这些结果表明,CYP1B1表达减轻了脂质过氧化,保护细胞免受铁死亡,并有助于铁死亡抵抗。
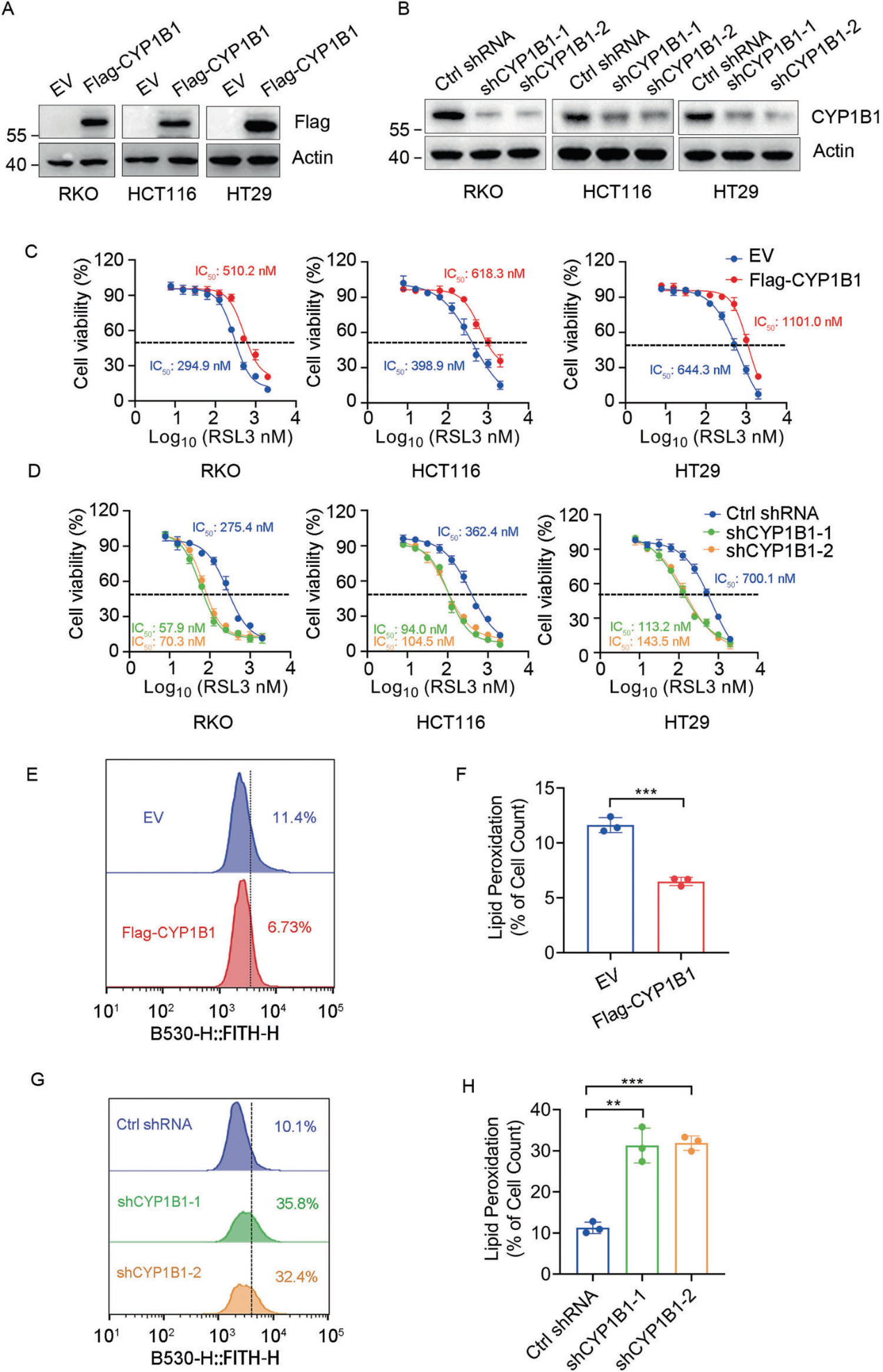
2)CYP1B1促进ACSL4泛素化和降解
接下来,我们探讨了CYP1B1在铁死亡抗性中的机制作用。Western blot分析显示,CYP1B1过表达降低了ACSL4蛋白水平(图2A),而CYP1B1敲低则增加了RKO、HCT116和HT29细胞中ACSL4蛋白水平(图2B)。接下来,我们研究CYP1B1抑制铁死亡是否是ACSL4下调的结果。我们用空载体(EV)或ACSL4质粒转染CYP1B1过表达的RKO细胞(图2C),并进行CCK8检测。结果显示,外源性表达ACSL4逆转了细胞对RSL3的抗性(图2D),表明CYP1B1以ACSL4依赖的方式抑制铁死亡。随后,我们检测了ACSL4 mRNA的变化。有趣的是,我们未能检测到CYP1B1过表达或敲低的细胞中ACSL4 mRNA水平的变化(图2E, F)。这些结果表明CYP1B1在翻译后水平调控ACSL4蛋白。为了检测CYP1B1是否影响ACSL4蛋白的稳定性,在指定的时间点用环己亚胺(CHX)处理EV或CYP1B1过表达的RKO细胞以抑制蛋白质合成。Western blot结果显示,CYP1B1过表达降低了ACSL4的半衰期(图2G)。基于这些结果,我们认为CYP1B1通过提高ACSL4的泛素化水平来降低ACSL4蛋白的稳定性。接下来,我们分析了CYP1B1对ACSL4泛素化的影响。正如预期的那样,我们发现CYP1B1过表达增加了多泛素链连接的ACSL4(图2H),而CYP1B1敲低则降低了ACSL4的多泛素化水平(图2I)。这些结果表明,CYP1B1通过增加ACSL4的泛素化来促进ACSL4的降解。

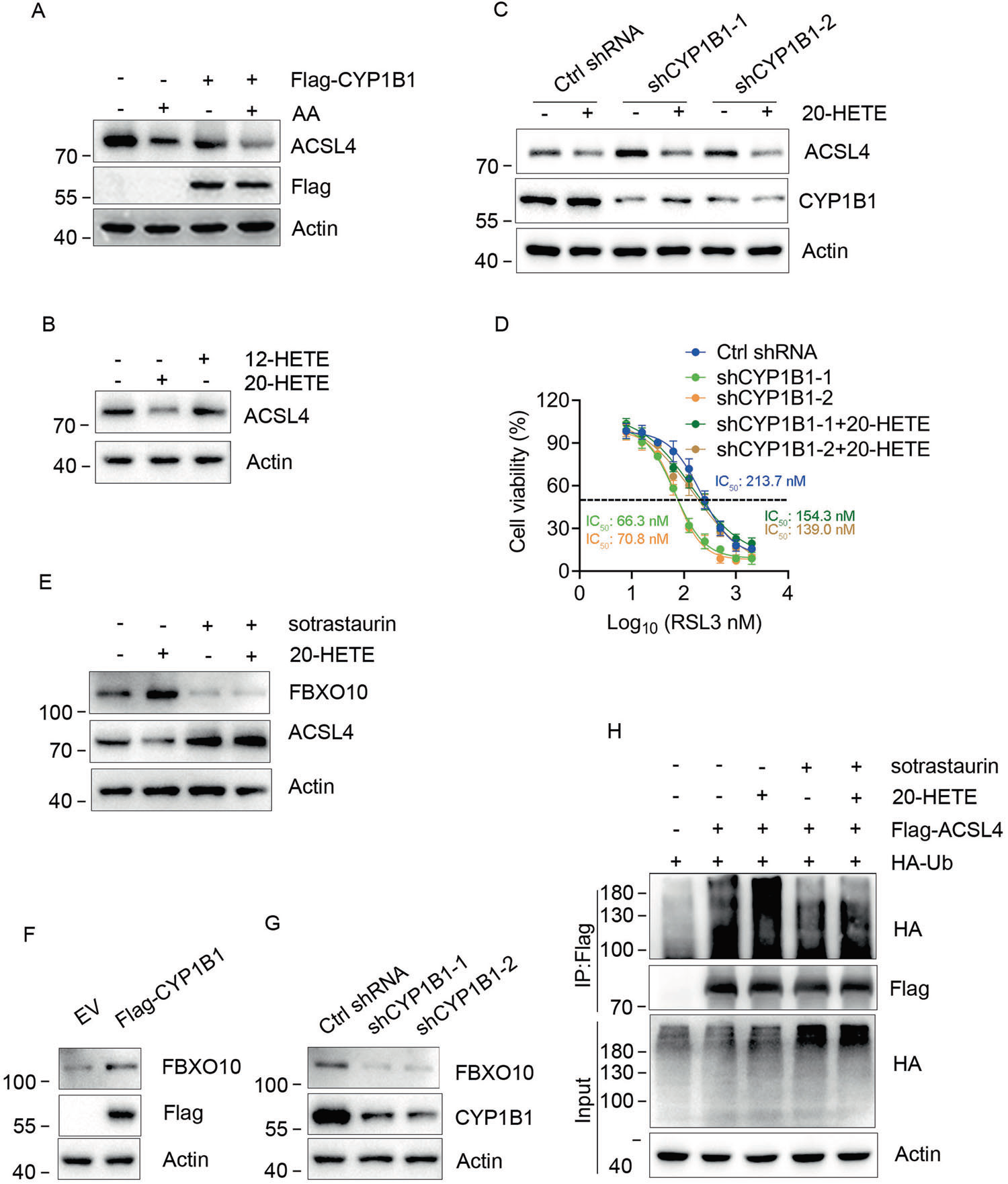
3)20-HETE促进FBXO10表达,对CYP1B1诱导的ACSL4降解至关重要
ACSL4催化AA生成花生四烯酰基辅酶A,从而促进铁死亡。外源性AA可增强RSL3诱导的铁死亡。同时,CYP1B1将AA代谢为羟基二十碳四烯酸(HETEs)。因此,我们质疑CYP1B1是否通过下调细胞内AA来降低ACSL4蛋白水平。用EV或Flag-CYP1B1质粒转染RKO细胞,并用10 μM AA处理24 h。Western blot结果显示,在CYP1B1过表达的细胞中,AA并没有恢复ACSL4的表达,ACSL4的表达出现降低(图3A)。根据这一结果,我们推测CYP1B1可能通过AA的代谢物降解ACSL4,从而保护细胞免受铁死亡。在人体内,CYP1B1产生的AA代谢产物主要是12-HETE和20HETE,因此,我们接下来测试了CYP1B1诱导的ACSL4下调是由于12-HETE还是20-HETE。10 μM 12-HETE或20-HETE作用RKO细胞24 h,western blot检测ACSL4蛋白水平。结果显示,20-HETE降低了ACSL4蛋白水平,而12-HETE没有降低ACSL4蛋白水平(图3B)。为了确定CYP1B1敲低引起的ACSL4蛋白水平升高是否由于20-HETE,我们用10 μM 20-HETE处理CYP1B1敲低的RKO细胞24小时,检测ACSL4蛋白水平。如图3C所示,20-HETE降低了ACSL4蛋白水平,逆转了CYP1B1敲低诱导的ACSL4蛋白升高。此外,20HETE而非12-HETE降低了CYP1B1敲低的RKO细胞对RSL3的敏感性(图3D)。综上所述,这些数据表明CYP1B1下调ACSL4蛋白,并通过20-HETE促进铁死亡耐受。另外,已知20-HETE可激活PKC信号通路,触发下游信号和靶基因的转录。我们的目的是确定20-HETE是否促进了FBXO10的表达,FBXO10是ACSL4的E3泛素连接酶。我们发现20-HETE增加了FBXO10的表达,这种增加被sotrastaurin(一种PKC抑制剂)消除,而ACSL4呈现相反的趋势(图3E)。此外,外源性CYP1B1表达增加了FBXO10蛋白水平,而CYP1B1敲低则降低了FBXO10的表达(图3F, G)。接下来,我们研究了ACSL4的多聚泛素化水平是否也受到20-HETE和PKC抑制剂的调节。如图3H所示,20-HETE增加了多泛素链连接的ACSL4,而单用sotrastaurin或联用20-HETE处理的细胞ACSL4多泛素化水平降低。综上所述,这些数据表明,AA的代谢物20-HETE通过激活PKC信号通路和诱导E3泛素连接酶FBXO10的表达来增强ACSL4的降解。
4)CYP1B1表达降低抗PD-1治疗的疗效
铁死亡在癌症免疫治疗中发挥重要作用,因此我们旨在确定CYP1B1是否会破坏抗PD-1治疗的有效性。我们使用慢病毒感染的方法敲低MC38细胞中的CYP1B1,并用western blot分析蛋白表达(图4A)。我们将稳定表达ctrl shRNA或CYP1B1 shRNA的MC38细胞皮下注射到C57BL/6J小鼠的右侧,并根据治疗方案给这些小鼠注射抗mPD-1抗体或同型对照IgG(图4B)。抗mPD-1治疗显著抑制了CYP1B1敲低小鼠的肿瘤生长(图4C, D)。当CYP1B1敲低的小鼠接受抗PD-1治疗时,IHC显示4-HNE(一种脂质过氧化标志物)的表达增加(图4E, F)。这些数据表明,CYP1B1缺乏增强了铁死亡,并使肿瘤细胞对抗PD-1治疗敏感。

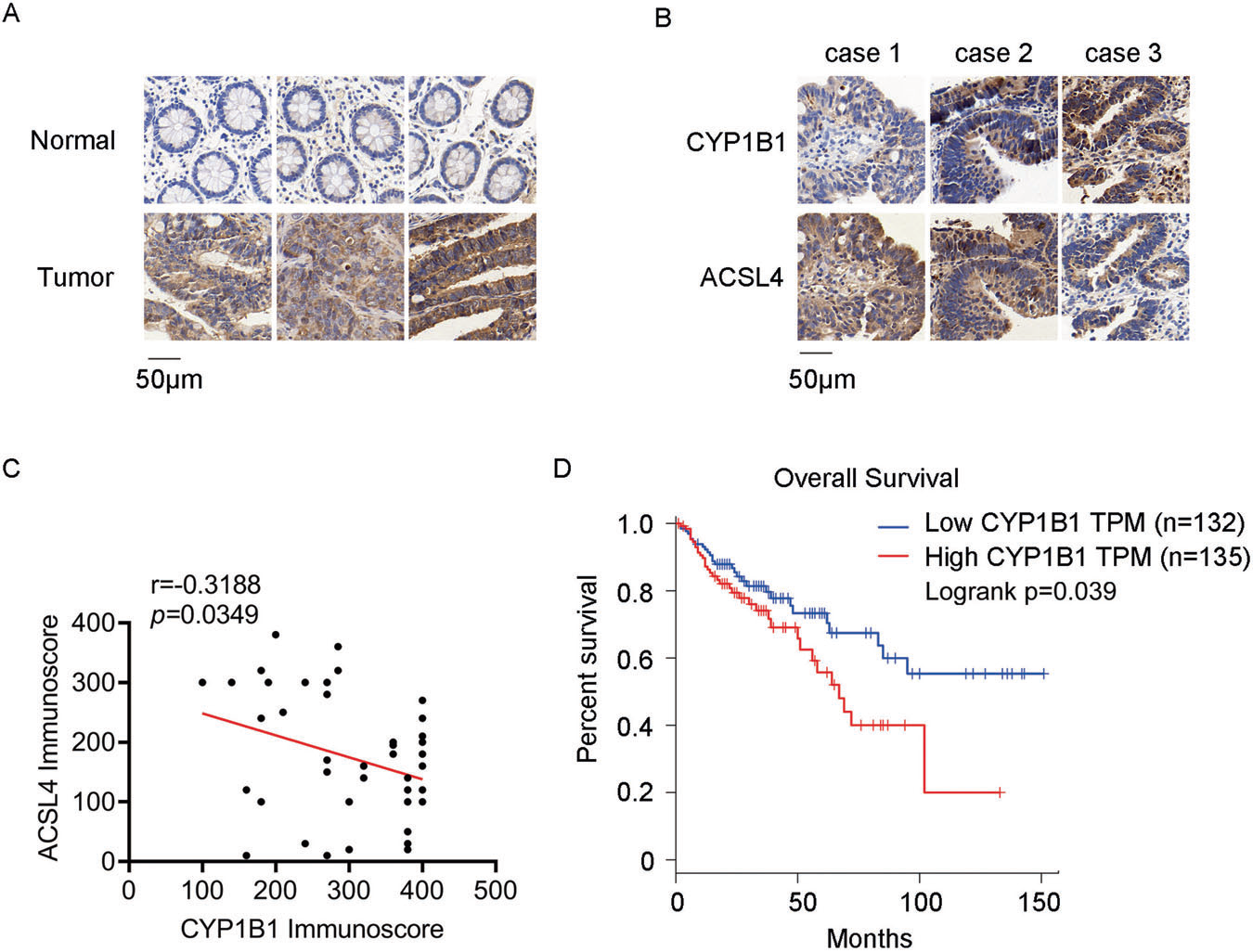
5)在结直肠癌组织中CYP1B1水平与ACSL4水平呈负相关
为了评估CYP1B1和ACSL4在结直肠癌肿瘤中的临床相关性,我们首先比较了CYP1B1和ACSL4在结直肠癌癌组织和邻近正常组织中的表达。免疫组化染色显示,CYP1B1在结直肠癌癌组织中高表达(图5A)。接下来,我们确定了CRC肿瘤组织中CYP1B1与ACSL4的相关性。免疫组化分析显示ACSL4蛋白水平与CYP1B1蛋白水平呈负相关(图5B, C)。此外,我们使用GEPIA数据库分析了CYP1B1的预后价值,发现CYP1B1水平的高表达与结肠腺癌(COAD)患者较差的总生存率显著相关(图5D)。这些结果表明,CYP1B1可能是一种潜在的生物标志物,并可能为结直肠癌患者提供新的治疗靶点。
结论:我们证明CYP1B1是铁死亡的重要调节因子,并影响抗PD-1治疗的敏感性。在机制上,CYP1B1通过增加ACSL4泛素化并促进其降解来诱导肿瘤细胞对铁死亡的抵抗。我们的研究结果对临床工作具有重要意义,表明CYP1B1可能作为一个有希望的治疗靶点来增强CRC的抗PD-1治疗。
参考文献:Chen C, Yang Y, Guo Y, He J, Chen Z, Qiu S, Zhang Y, Ding H, Pan J, Pan Y. CYP1B1 inhibits ferroptosis and induces anti-PD-1 resistance by degrading ACSL4 in colorectal cancer. Cell Death Dis. 2023 Apr 14;14(4):271. doi: 10.1038/s41419-023-05803-2.






