单细胞多组学分析确定了 调节淋巴管平滑肌瘤样细胞的存活的HOX-PBX基因网络
淋巴管平滑肌瘤样病(LAM)是一种罕见的、进展性的肺部疾病,主要影响女性。LAM细胞携带TSC1/TSC2突变,导致mTORC1过度活化和细胞无法受控地增殖。mTORC1抑制剂可以稳定肺功能,但持续疗效需要长期给药,而一些患者无法耐受或对治疗无响应。虽然 LAM 的遗传基础是已知的,但其发病机制仍然不清楚。作者整合了LAM肺部的单细胞RNA测序和单核ATAC-seq,构建了控制LAM细胞转录程序的基因调控网络。作者发现,子宫特异性HOX-PBX转录程序在肺部LAMCORE细胞中被激活,作为依赖于HOXD11-PBX1二聚化的细胞存活调节因子。因此,通过HXR9阻断HOXD11-PBX1二聚化可以抑制LAM细胞在体外和体内的存活。PBX1调节STAT1/3,增加抗凋亡基因的表达,促进LAM细胞在体外的存活。HOX-PBX基因网络为治疗LAM/TSC mTORC1过度活化癌症提供了有前途的靶点。
技术路线:

实验方法:细胞培养、RNA干扰、免疫印迹分析、实时荧光定量PCR、动物模型、细胞毒性实验、snATAC-seq分析、scRNA-seq、snATAC-seq和10x多组数据的生物信息学分析、TRN分析、共焦显微镜、免疫荧光染色。
1、单细胞基因表达和DNA可及性综合分析鉴定出LAM中具有子宫选择性的HOX家族转录因子的激活
该研究利用LAM患者肺部样本的单细胞RNA测序(scRNA-seq)鉴定了一种独特的细胞群体,称为LAMCORE,该群体可以与内源性肺细胞类型轻松区分,并且与子宫肌细胞具有最接近的转录组相似性。本研究利用10x Multiome、单核测序转座酶可接近染色质测序(snATAC-seq)和现有的10x scRNA-seq产生的单细胞染色质可及性和基因表达的配对检测,并对人类LAM组织中的单细胞基因表达和染色质可及性进行了整合分析。使用LungMAP CellRef对整合的LAM单细胞数据进行映射,鉴定出33种不同的细胞类型,包括先前鉴定的LAMCORE细胞群体(图1A)。作者发现LAMCORE细胞特异性的ATAC-seq峰值可及性区域在子宫选择性homeobox转录因子的模体中高度富集,包括PBX1、PBX3、HOXA9、HOXA10和HOXD11 (图1B)。
LAMCORE细胞中,HOXD11、PBX1、MITF和TEAD2被预测为具有富集表达的特征基因(图1C,粉色条),而MYH11、ACTA2、STAT1和STAT3在多种细胞类型中表达,其平均表达水平在LAMCORE细胞中增加(图1C,蓝色条)。在获取LAMCORE细胞的差异性可及峰集之后,使用Hypergeometric Optimization of Motif EnRichment(HOMER)将峰分配给最近或重叠的基因,从而实现染色质可及性与基因表达的关联。与LAMCORE细胞选择性峰相关的最近基因在肌肉结构发育和细胞外基质组织方面功能丰富(图1D)。
在最近的基因附近,宫颈TFs(PBX1、PITX2、ESR1和HAND2)、编码肌肉和胶原蛋白的基因(ACTA2、MYH11、COL1A2和COL4A1)以及参与凋亡的基因(CRYAB、PTGIS和PDE3A)在LAM中表达增加(图1C)。ATAC测序和RNA表达模式在所有细胞类型中高度一致(图1E)。作者分析了HOXA10和PBX1基因组区域的峰值到基因(P2G)连接(图1F),并在LAMCORE细胞的HOXA10和HOXA11启动子区域中发现了独特的可访问峰,与LAMCORE细胞中HOXA10和HOXA11 RNA的选择性表达一致(图1F)。PBX1被预测为LAMCORE细胞的标志性基因之一,其基因表达和染色质可访问峰在其他细胞类型中被检测到,并且PBX1在LAMCORE细胞中的选择性可能受到其与HOX蛋白的二聚化的影响(图1F)。因此,目前整合的scRNA-seq/snATAC-seq数据分析确定了子宫特异性转录编程(即homeobox转录因子家族)在LAMCORE细胞中的表达和活性增加,支持HOX-PBX信号通路激活的理论,在LAMCORE细胞的转录和表观遗传调控中发挥重要作用。

图1
2、LAM细胞中HOXs、PBX1和靶基因的表达显著。
为了验证单细胞研究的发现,作者使用逆转录定量聚合酶链式反应(RT-qPCR)测量了5例LAM患者和3例非LAM患者组织中PBX1基因表达水平(表 1)。作者的发现表明,LAM患者肺组织中PBX1 mRNA水平升高(图2A)。这证实了作者对公开可获得的PBX1基因表达数据进行分析的结果,这些数据来自激光捕获的LAM患者肺细胞(n=14,GSE12027)与女性癌症患者肺组织(n=38,GSE10072和GSE19804)(图2B)。
已经在肺LAM患者中鉴定出了子宫LAM病变。子宫组织是从一位散发性LAM患者进行子宫切除术时获取的。LAM子宫的组织病理学显示多个形态清晰、坚实的结节,具有由肌层形成的卷曲网状结构,从肌层表面凸出,与平滑肌瘤一致。免疫组化染色显示ACTA2呈阳性免疫反应。免疫荧光染色显示PBX1位于ACTA2阳性子宫平滑肌瘤细胞核中(图2D)。作者已经发表的单细胞RNA测序分析鉴定了三种主要的细胞类型:ACTA2+细胞、免疫细胞和内皮细胞。苏木精-伊红(H&E)染色显示ACTA2+群体具有明显的上皮细胞特征(图2E)。免疫荧光染色显示PBX1位于ACTA2阳性肾脏脂肪瘤细胞核中(图2E)。
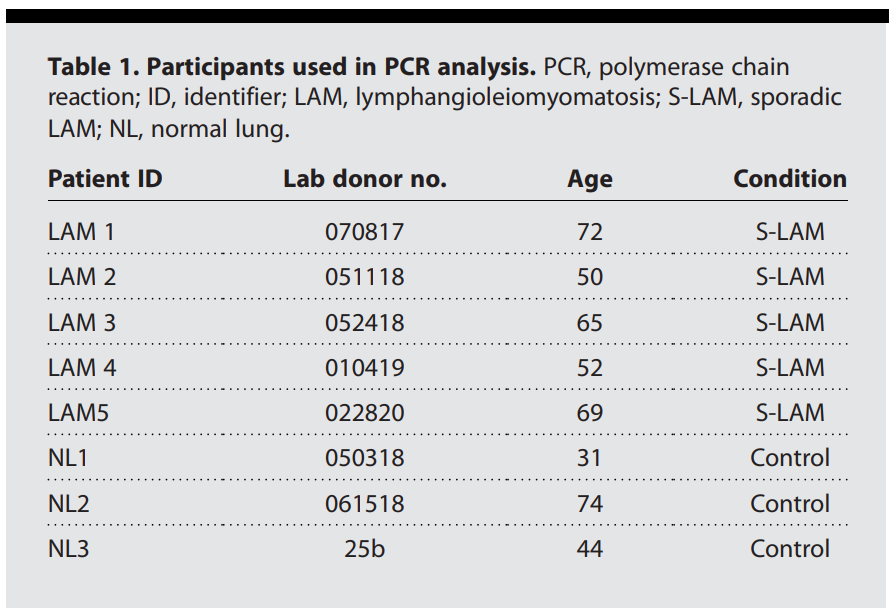
接下来,作者研究了鼠瘤性硬化2(Tsc2)基因缺失大鼠子宫平滑肌瘤来源的ELT3(Eker大鼠子宫平滑肌瘤)细胞的异种移植瘤模型中PBX1蛋白水平。在接种后6周,ELT3-V3(表达空载体)和ELT3-T3(表达TSC2)细胞均形成皮下肿瘤。与Tsc2阳性的ELT3-T3细胞相比,Tsc2缺失的ELT3-V3肿瘤细胞中PBX1阳性细胞核的百分比增加(图2F和G)。最后,在肺转移小鼠模型中,与安慰剂治疗相比,PBX1在雌激素诱导的转移性肺病变中的积累更为突出(图2H)。与单细胞多组学发现一致,作者的数据证明了LAM组织和TSC2缺陷小鼠肿瘤模型中PBX1表达和PBX1蛋白水平的增加。
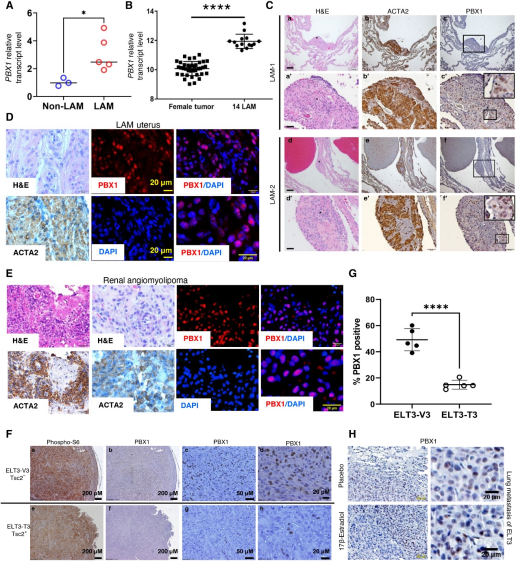
图2
3、PBX1 ChIP-seq 和 LAM 肺部 scRNA-seq 数据的综合分析,鉴定 HOX和STAT作为PBX1的靶点
PBX1是一种先锋因子,能够打开染色质以招募雌激素受体α到乳腺癌细胞中。PBX(PBX1到PBX4)和HOX(HOX1到HOX11)是一类包含homeobox结构域的转录因子,它们可以形成功能性二聚体,在不同类型的癌症中促进增殖、抑制细胞凋亡、诱导血管生成并推动转移。作者应用乳腺癌PBX1染色质免疫沉淀测序(ChIP-seq)数据集(GSE28008)和LAM肺单细胞RNA测序(scRNA-seq)数据集进行整合分析,以在LAMCORE细胞中鉴定潜在的PBX1靶点。具有正向PBX1结合峰和在LAMCORE细胞中选择性表达的基因包括HOXD11、PITX2、ESR1和NR2F2 (图3A)。
STAT3被预测为PBX1的转录靶点。虽然STAT3在LAM和对照组肺细胞中均表达,但其总体表达量在LAM组与对照组肺中存在显著差异(图1C)。具有正向PBX1结合位点和在LAMCORE细胞中选择性表达的基因在与LAM病理机制相关的通路中发生功能富集,包括LAMCORE细胞中雌激素、ERK/丝裂原活化蛋白激酶(MAPK)和mTOR信号通路的激活(图3B),这支持PBX1参与调控导致LAM发生的基因和通路的概念。雌激素处理增加了ESR1和PGR的转录水平,但并未影响621-101细胞中PBX1的表达(图3C),这表明TSC2缺陷细胞中PBX1表达没有负反馈调控。
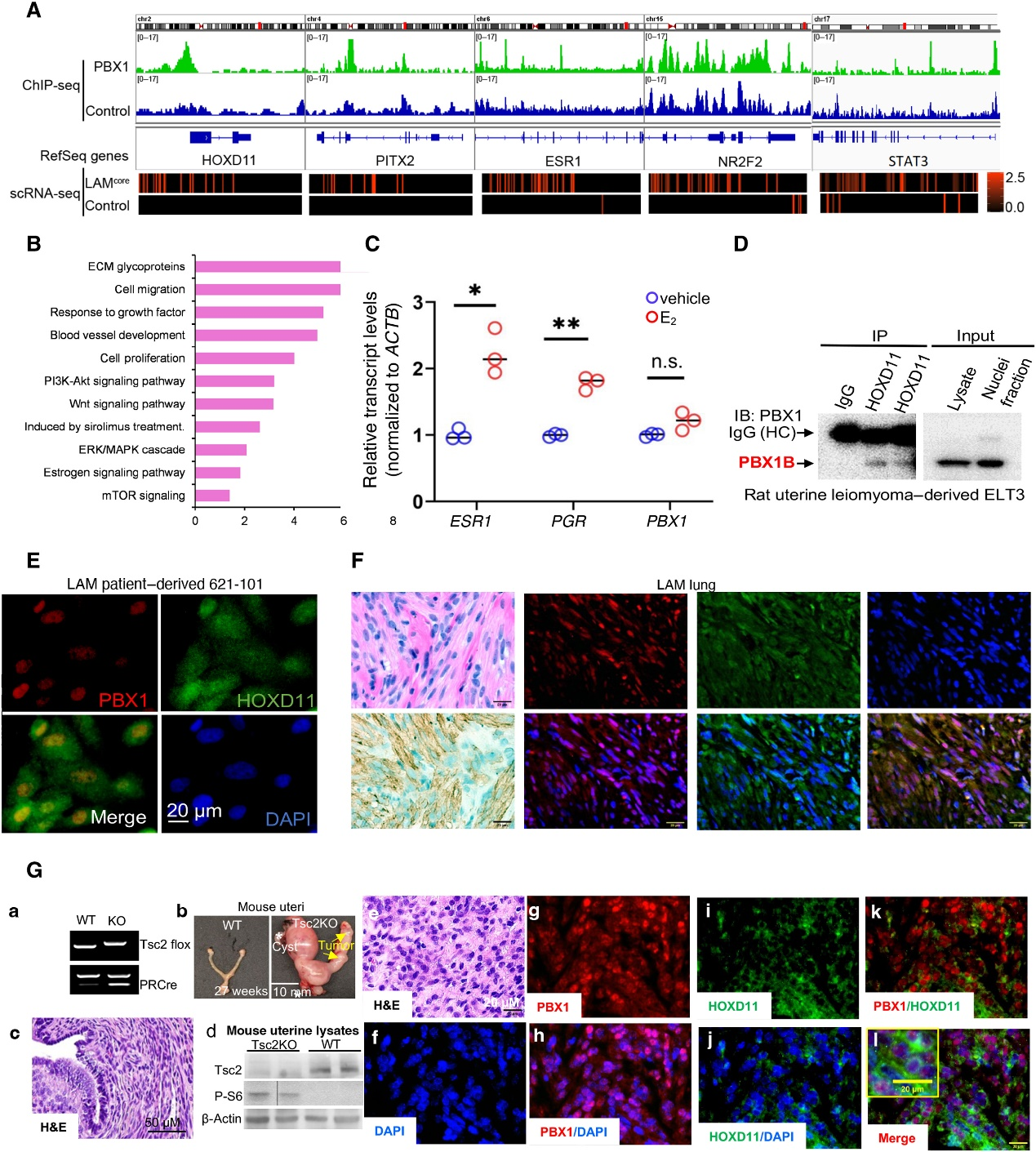
图3
4、PBX1在TSC2缺陷细胞中与HOXD11相互作用。
为了确定LAM特异性的HOX/PBX相互作用,作者使用两种独立的anti-HOXD11抗体进行免疫共沉淀实验,检测来自大鼠子宫平滑肌瘤衍生的ELT3细胞中HOXD11免疫复合物中的PBX1蛋白(图3D)。共聚焦显微镜显示,在TSC2缺陷细胞的细胞核中,PBX1和HOXD11免疫染色共定位(图3E)。免疫荧光染色显示,在LAM患者的平滑肌肌动蛋白(ACTA2)阳性肺细胞核中,PBX1和HOXD11共定位(图3F)。
作者构建了一个子宫特异性Tsc2敲除的基因小鼠模型(图3G,a),并在27周龄时在PRCre;Tsc2f/f(Tsc2KO)小鼠中识别出子宫增大、囊肿形成和子宫肿瘤的增生(图3G,b)。组织病理学显示Tsc2KO小鼠的子宫内膜和肌层细胞(图3G,c)。免疫印迹分析表明,与野生型(WT)小鼠相比,Tsc2KO小鼠子宫组织中Tsc2蛋白的丧失和S6(Ser235/236)磷酸化的增加,这表明mTORC1的激活(图3G,d)。免疫荧光染色显示,在LAM的PRCre;Tsc2f/f小鼠模型的子宫肌层肿瘤细胞中,PBX1在细胞核中明显表达,而HOXD11在细胞质周围的区域丰富表达(图3G,e)。
综上所述,作者的研究结果通过综合基因组分析表明了在TSC2缺陷细胞中PBX1和HOXD11之间的相互作用。
5、HOXD11和PBX1是LAMCORE细胞中活跃的转录调控网络
为揭示决定LAM特异性细胞命运的基因组和表观遗传调控回路,作者利用成对的基因表达和染色质可及性数据(PECA)构建了LAMCORE细胞转录调控网络(TRNs)。PECA是一种统计模型,可以基于基因表达和染色质可及性数据来计算目标基因表达的概率推断出特定情境下的TRN。为确保TRN是LAMCORE特异性的,作者要求转录因子(TFs)在LAMCORE细胞中高度表达,并且目标基因与对照间充质细胞相比要么是LAMCORE标志基因,要么是在LAMCORE中诱导的基因。作者确定了在LAMCORETRN中与最多相互作用的TFs节点(网络的前1%),包括激素受体PGR(孕激素受体)、雄激素受体和Homeobox转录因子(HOXA10、HOXA11、HOXD11、PBX1和PBX3)(图4A)。
考虑到作者发现PBX1与HOXD11在人类和啮齿动物的TSC2缺陷细胞中结合(图3),作者接下来专注于以PBX1-HOXD11为中心的TRN,通过提取直接连接到PBX1和HOXD11的基因节点,包括共同的上游调节因子、共同的辅因子和共同的靶基因(图4B)。共享的PBX1-HOXD11靶基因在功能上富集于“肌肉增殖/发育”、“细胞命运承诺”、“伤口愈合”、“激素反应”、“Wnt信号通路”、“凋亡信号通路”、“重点支持”和“磷脂酰肌醇3-激酶(PI3K)-Akt-mTOR信号通路”(图4C)。作者的TRN分析确定了LAMCORE细胞中,以PBX1-HOXD11为中心的TRN上游和下游的精确调控回路,并提供了功能验证和鉴定PBX1-HOXD11调控LAM病理机制的分子和细胞机制的理论蓝图。
因为STAT家族转录因子(STAT1和STAT3)是LAMCORE细胞特异染色质可及性区域中高度富集的模体(图1,C和D),并且预测它们是PBX1的直接转录靶标(图3A),因此作者构建了PBX1/3和STAT1/3共同网络以确定共享的靶标(图4D)。由于转录因子家族通常共享转录因子结合位点和motif,作者将PBX1和PBX3组合为PBX家族,将STAT1和STAT3组合为STAT家族。 "程序性细胞死亡的调节"是PBX / STAT共同靶标基因中最丰富的功能。其中大多数基因与"细胞死亡的负调节"相关(图4E)。
网络分析表明,PBX和STAT转录因子家族协同作用,抑制LAM细胞凋亡并促进LAM细胞生存。免疫组化证实PBX1,HOXA11和HOXD11蛋白存在于LAM肺结节中的ACTA2阳性细胞中(图2C和4F)。磷酸化STAT1(磷酸化STAT1)和磷酸化STAT3定位于LAM肺结节中的细胞核中(图4G)。 RT-PCR验证了LAM中几个PBX-STAT共同靶标基因在细胞死亡的负调节中的表达增加,包括CRYAB和HAND2(图4,H和I)。与单细胞分析和网络预测一致,作者证明了LAM结节中PBX1、HOXA11、HOXD11、磷酸化STAT1/3蛋白水平增加,并且预测的PBX-STAT基因靶点(CRYAB和HAND2)表达增加,从而抑制凋亡。
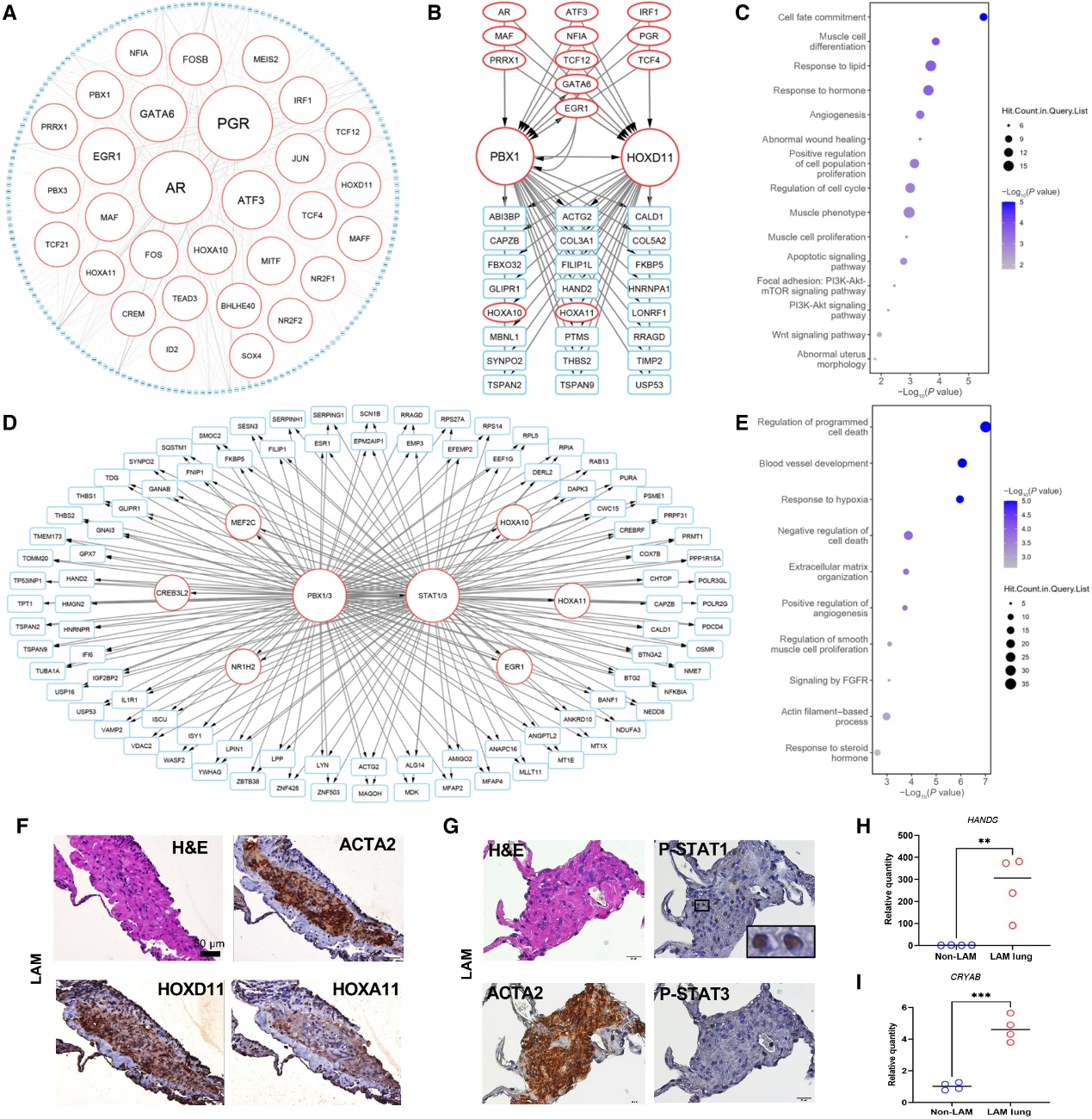
图4
6、抑制PBX1会减弱LAM源细胞中STAT1/3的磷酸化
利用慢病毒短发夹RNA(shRNA)在621-101细胞中降低PBX1的表达。结果显示PBX1敲除可将磷酸化Ser727-STAT1水平降低45%和88%,将磷酸化Ser727-STAT3水平降低80%和75%(图5,A和B)。细胞周期蛋白D1的蛋白水平,即STAT3的转录靶标,不受PBX1减少的影响(图5A),表明PBX1在LAM衍生细胞中不控制cyclin D1依赖的增殖信号。
此外,PBX1敲除减少了LAM衍生细胞中PBX1和ESR1的转录水平(图5C)。这些结果表明,在TSC2缺失的LAM细胞中,STAT1、STAT3和雌激素受体α(ESR1)的增加表达依赖于PBX1。

图5
7、在体外抑制STAT1可促使TSC2缺陷 LAM细胞死亡
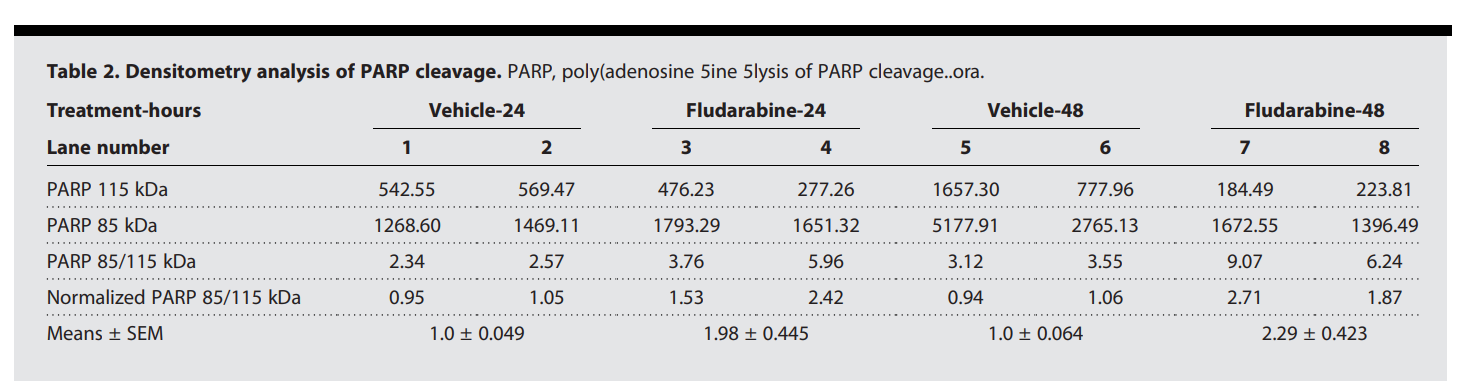
LAM患者来源的细胞用氟达拉滨(NSC 118218,FaraA,Fludarabine)处理,该处理可使 STAT1 mRNA 和蛋白质降解。24和 48小时后,Fludarabine处理显著提高了TSC2缺陷621-101细胞中 ESR1 的转录水平(图5D)。与 TSC2-expressing 621-103 细胞(GI50 = 852.2 μM)相比,Fludarabine 处理显著降低了 TSC2缺陷 621-101 细胞的存活率(生长抑制剂浓度50%(GI50)= 56.1 μM),这一结果在72小时内出现(图5E和F)。然后,作者对621-101和 621-103 细胞分别使用逐渐增加的浓度的Fludarabine处理72小时。相位对比显微镜显示,55.6至500μM Fludarabine处理导致621-101细胞死亡明显增加,而621-103细胞不受影响(图5G)。使用水晶紫染色显示,与 621-103 细胞相比,Fludarabine处理的621-101细胞的染色减少(图5H和I)。与对照组相比,48小时的Fludarabine处理减少了磷酸化STAT1的水平,降低了PBX1的蛋白质水平(图5J)。去氧氟达拉滨处理后,TSC2缺陷621-101细胞中出现明显的PARP(聚腺苷酸二磷酸核糖聚合酶)裂解(图5J和K及表2),这表明TSC2缺陷细胞发生了凋亡。网络分析和功能研究共同证明,PBX1和STAT 家族转录因子协同作用抑制LAM细胞的凋亡并促进细胞存活,这种效应可被STAT信号抑制所逆转。
8、在活体实验中,抑制STAT1并未影响Tsc2敲除的大鼠子宫肌瘤来源细胞的肺部定植
为了评估抑制STAT1活化的潜在治疗效果,使用Fludarabine处理Tsc2缺陷 ERL4细胞16小时。与对照组相比,Fludarabine(100μM)没有改变Tsc2缺陷 ERL4细胞的荧光素酶活性(图6A)。免疫印迹分析显示,Fludarabine处理降低了STAT1和STAT3的磷酸化水平(图6B),这表明在体内抑制了STAT1。接下来,作者测试了Fludarabine对ERL4细胞在肺部殖民化的影响。将ERL4细胞注入雌性NOD scid gamma(NSG)小鼠体内。在1小时内,所有小鼠胸部区域的生物荧光强度相似(基线),在细胞接种后6小时,所有小鼠的生物荧光强度略有增加。Fludarabine处理72小时不影响ERL4细胞在肺部的定植(图6,C至E)。总的来说,这些数据表明,在体内抑制STAT1活化不足以抑制Tsc2缺陷 ERL4细胞的生存和/或在肺部的定植。
9、抑制HOX-PBX1二聚体化促进TSC2缺陷细胞死亡
为了评估抑制HOX-PBX1二聚化在LAM中的潜在治疗效果,使用不断增加浓度的HXR9(Bio-Synthesis Inc.,Lewisville,TX,USA)来处理TSC2缺陷 621-101和ERL4细胞,这是一种可渗透细胞的合成肽,可以抑制HOX-PBX相互作用。 HXR9(50μM)杀死了TSC2缺陷 621-101细胞(图7A和B),表明阻止HOX-PBX1二聚化的细胞毒性作用。HXR9处理提高了TSC2缺陷621-101细胞中cleaved caspase-3和受体相互作用蛋白激酶1(RIPK1)的磷酸化水平,但在TSC2重新表达的621-103细胞中未观察到这种效应(图7C),这表明增强了细胞凋亡和坏死。接下来,作者测试了HXR9对ERL4细胞的肺转移的影响。HXR9预处理成功抑制了细胞接种后24和48小时的肺转移(图7D和E)。将表达荧光素的LAM衍生的621-101-luciferase(621L9)细胞转染两个独立PBX1-shRNA的女性C.B-Igh-1b /IcrTac-Prkdcscid(SCID)小鼠进行注射(图7F)。尽管在接种pLKO.1或PBX1-shRNA细胞的小鼠中,胸部区域的荧光强度在1小时内相似(基线),但是在接种PBX1-shRNA细胞的小鼠中,在接种后24和48小时,荧光强度明显降低(图7G和H)。

图6
总之,这些数据表明PBX1-HOX相互作用调节了TSC2缺陷 LAM患者衍生的细胞的存活和肺转移。
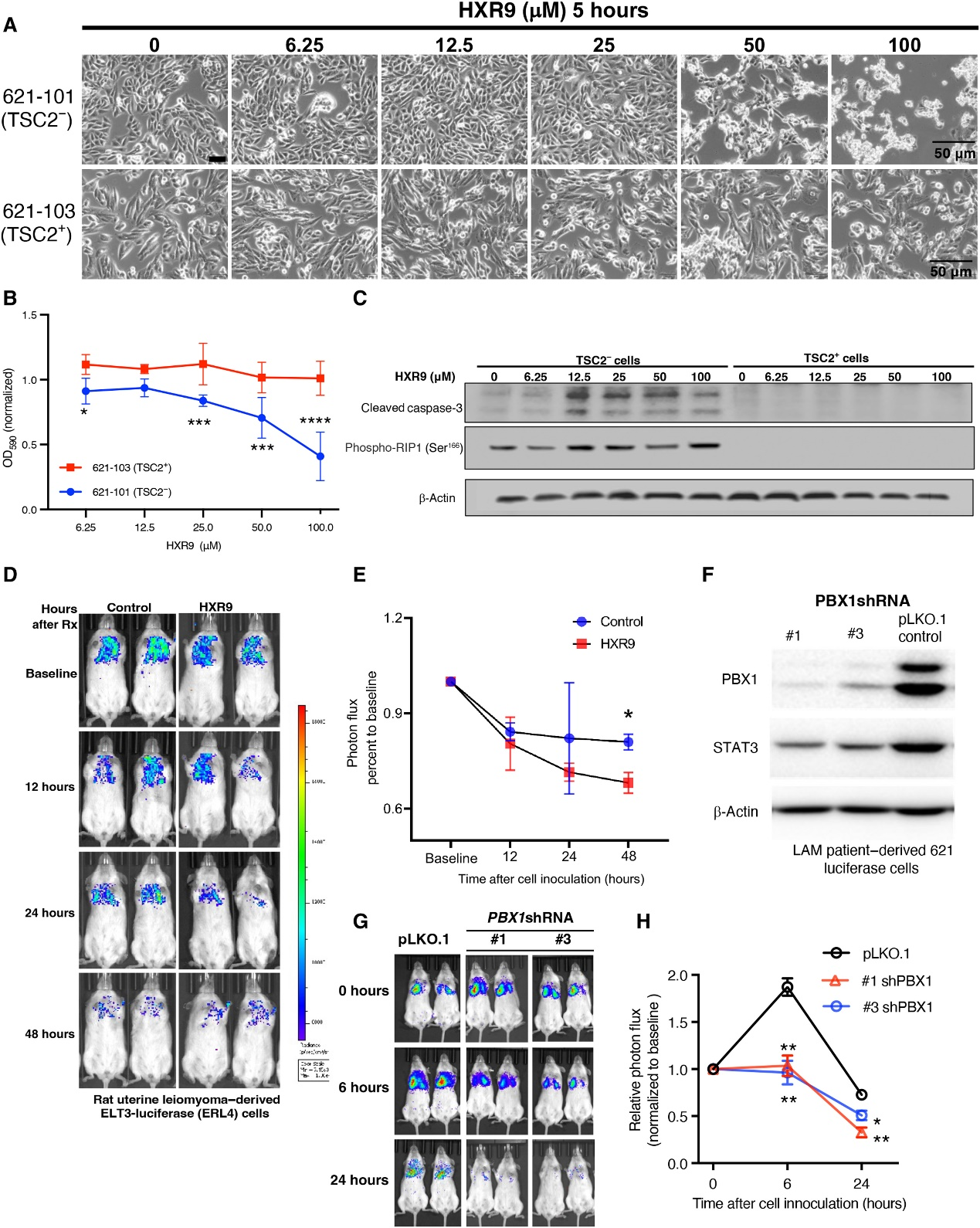
图7
参考文献:
Tasnim Olatoke et al. ,Single-cell multiomic analysis identifies a HOX-PBX gene network regulating the survival of lymphangioleiomyomatosis cells.Sci. Adv.9,eadf8549(2023).DOI:10.1126/sciadv.adf8549






