9分文章揭秘——去乙酰化串联泛素化促进鼻咽癌细胞增殖和转移
实验方法:质粒构建,细胞转染,Western blot,免疫沉淀(IP),实时荧光定量PCR,LC-MS/MS分析,细胞增殖,克隆形成,Transwell,划痕实验,免疫荧光,动物实验,免疫组化
乙酰化修饰在肿瘤的增殖和转移中起着重要作用。磷脂酰磷组氨酸无机焦磷酸盐磷酸酶(LHPP)在某些肿瘤中下调,具有抑制肿瘤的作用。然而,LHPP在鼻咽癌(NPC)中的表达调控及其功能尚不清楚。在本研究中,作者发现LHPP在鼻咽癌中下调,并且LHPP的过表达抑制了鼻咽癌细胞的增殖和侵袭。在机制上,HDAC4在K6处使LHPP去乙酰化,并通过TRIM21介导的k48连锁泛素化促进LHPP的降解。证实HDAC4在鼻咽癌细胞中高表达,并通过LHPP促进鼻咽癌细胞的增殖和侵袭。进一步研究发现,LHPP可以抑制酪氨酸激酶TYK2的磷酸化,从而抑制STAT1的活性。在体内,敲除HDAC4或靶向HDAC4的小分子抑制剂Tasquinimod可通过上调LHPP显著抑制NPC的增殖和转移。综上所述,作者的研究结果表明HDAC4/LHPP信号轴通过上调TYK2-STAT1磷酸化激活促进鼻咽癌的增殖和转移。本研究将为鼻咽癌转移提供新的证据和干预靶点。
技术路线:

主要研究结果:
1、LHPP在NPC中去乙酰化且低表达
为研究NPC中去乙酰化直接调控的抑癌蛋白,用广谱HDACi(组蛋白去乙酰化酶抑制剂)LBH589处理NPC HK1细胞,用高效液相色谱串联质谱(LC-MS/MS)分析数据(图1A)。聚类热图分析表明,LBH589处理后,23个蛋白的乙酰化水平显著上调(fold change > 3 , p < 0.05)(图1B)。其中,LHPP是乙酰化水平上调最明显的3个分子之一,也是3个分子中唯一的修饰酶。为证实LHPP在NPC细胞中受乙酰化直接调控,分别用LBH589和另一种广谱HDACi Belinostat(PXD101)处理HK1和5-8F细胞,并用泛乙酰化抗体(Acetylation-lysine)进行IP实验。与内源性结果一致,数据显示HDACi显著提高LHPP的乙酰化水平(图1C)。进一步,用Flag- LHPP转染HK1和5-8F细胞,并用HDACi处理,用Flag或乙酰化赖氨酸抗体进行IP实验,分别检测外源LHPP的乙酰化。与内源性结果一致,数据显示在HDACi处理后LHPP的乙酰化水平明显上调(图1D-E)。为进一步分析LHPP的乙酰化水平是否影响蛋白表达,进行了western blot分析,结果显示HDACi处理显著增加NPC细胞中LHPP的蛋白表达(图1F)。同时,与人正常鼻咽细胞NP69相比,LHPP在鼻咽癌细胞中的表达明显下调(图1G)。对临床NPC样本进行IHC分析发现,与癌旁组织相比,LHPP在肿瘤组织中低表达(图1H)。综上所述,LHPP在NPC中低表达,可能是由去乙酰化修饰引起的。
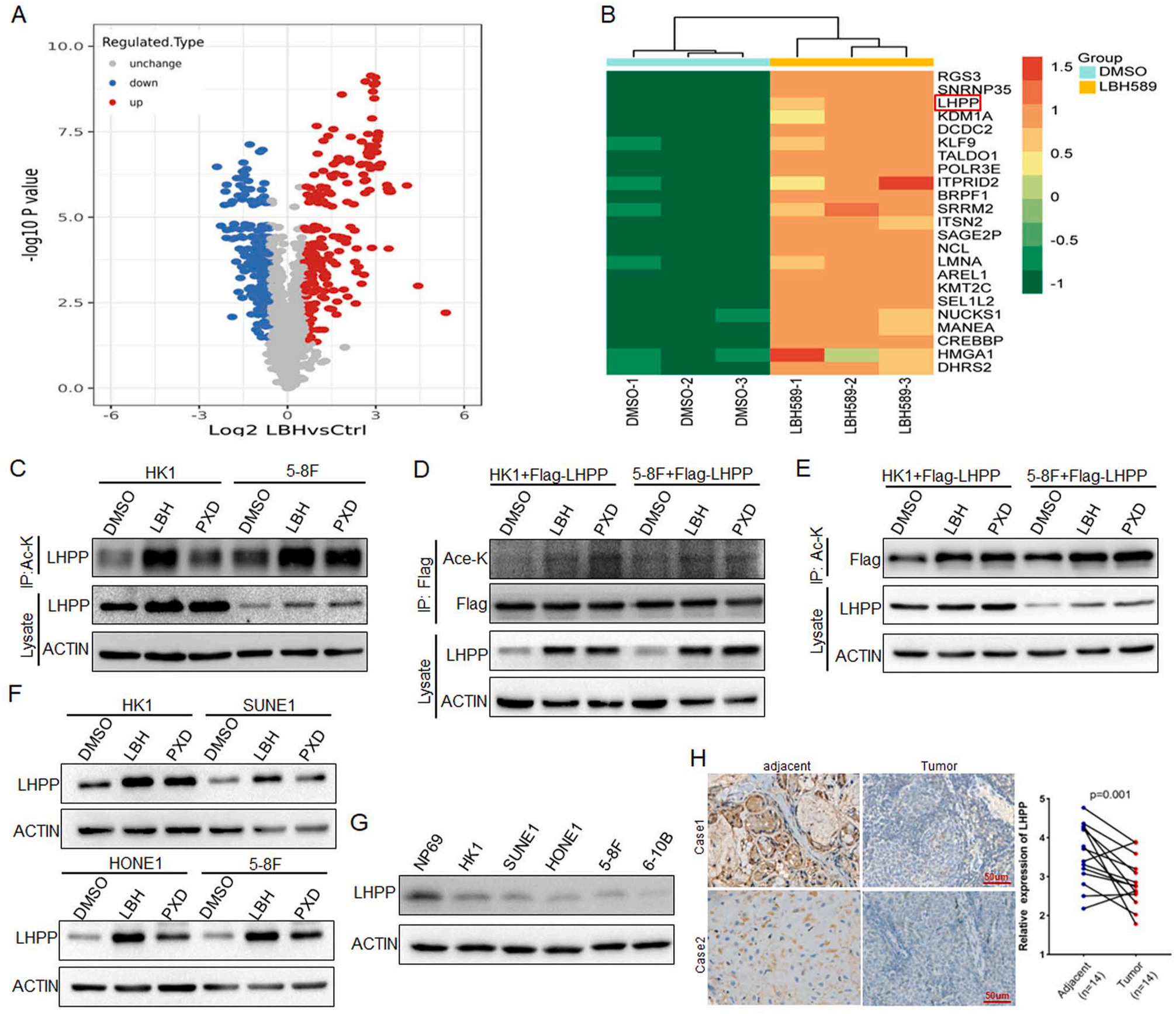 图1 LHPP在NPC中去乙酰化且低表达
图1 LHPP在NPC中去乙酰化且低表达
2、过表达LHPP可抑制鼻咽癌细胞的增殖和侵袭
为研究LHPP在鼻咽癌细胞中的生物学功能,将pcDNA3.1-LHPP质粒转染NPC细胞HK1、5-8F和HONE1。CCK8实验表明,与对照组相比,LHPP过表达降低了NPC细胞活力(p < 0.001)(图2A)。克隆形成实验结果显示,与对照组相比,LHPP过表达细胞形成的克隆数明显降低(p < 0.01)(图2B)。划痕实验证实LHPP过表达细胞的迁移能力降低(p < 0.01)(图2C)。Transwell实验结果显示,过表达LHPP细胞的侵袭能力也明显受到抑制(p < 0.01)(图2D)。因此,LHPP抑制NPC细胞的增殖和侵袭。
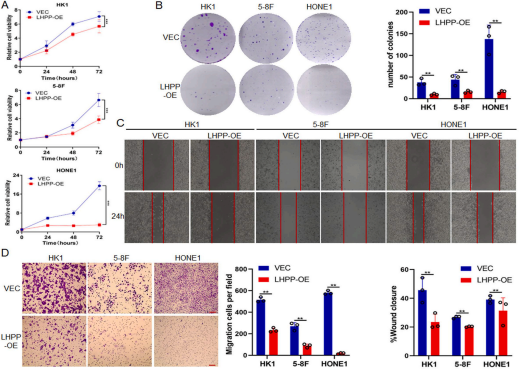
图2过表达LHPP可抑制鼻咽癌细胞的增殖和侵袭
3、HDAC4介导LHPP去乙酰化
为鉴定介导LHPP去乙酰化的调控酶,分别用曲古抑菌素A(TSA,HDAC家族去乙酰化酶抑制剂)和烟酰胺(NAM,SIRT家族去乙酰化酶抑制剂)处理HK1和5-8F细胞。结果发现,TSA处理后LHPP蛋白增加,而NAM处理后LHPP蛋白变化不明显(图3A)。使用两种选择性去乙酰化酶抑制剂LMK-235(主要针对HDAC4/5)和MS-275(靶向HDAC1/3/2)处理NPC细胞后,结果显示LMK-235可明显上调LHPP蛋白表达(图3B)。在293T细胞中转染Flag-LHPP和His-HDAC4/5质粒,IP实验结果显示LHPP可以与HDAC4相互作用,但不能与HDAC5相互作用(图3C)。HK1和5-8F细胞的内源性IP实验也证实了LHPP与HDAC4的相互作用(图3D)。与此结果一致,免疫荧光实验证明LHPP和HDAC4主要共定位于NPC细胞的细胞质中(图3E)。此外,IP实验结果显示过表达HDAC4可以显著降低LHPP的乙酰化水平(图3F),western blot结果显示下调HDAC4后LHPP表达上调,过表达HDAC4后LHPP表达下调(图3G)。这些结果表明,在NPC细胞中,HDAC4负调控LHPP的表达。此外,在作者的前期实验中,用LBH589处理NPC HK1细胞后,通过LC-MS/MS鉴定了LHPP的K6乙酰化(图3H)。将Flag-LHPP、K6R(模拟去乙酰化)和K6Q(模拟乙酰化)质粒转入293T细胞后,IP实验结果显示K6R突变显著降低LHPP乙酰化,而K6Q突变不影响LHPP乙酰化(图3I)。这些结果表明HDAC4通过K6去乙酰化抑制LHPP的表达。
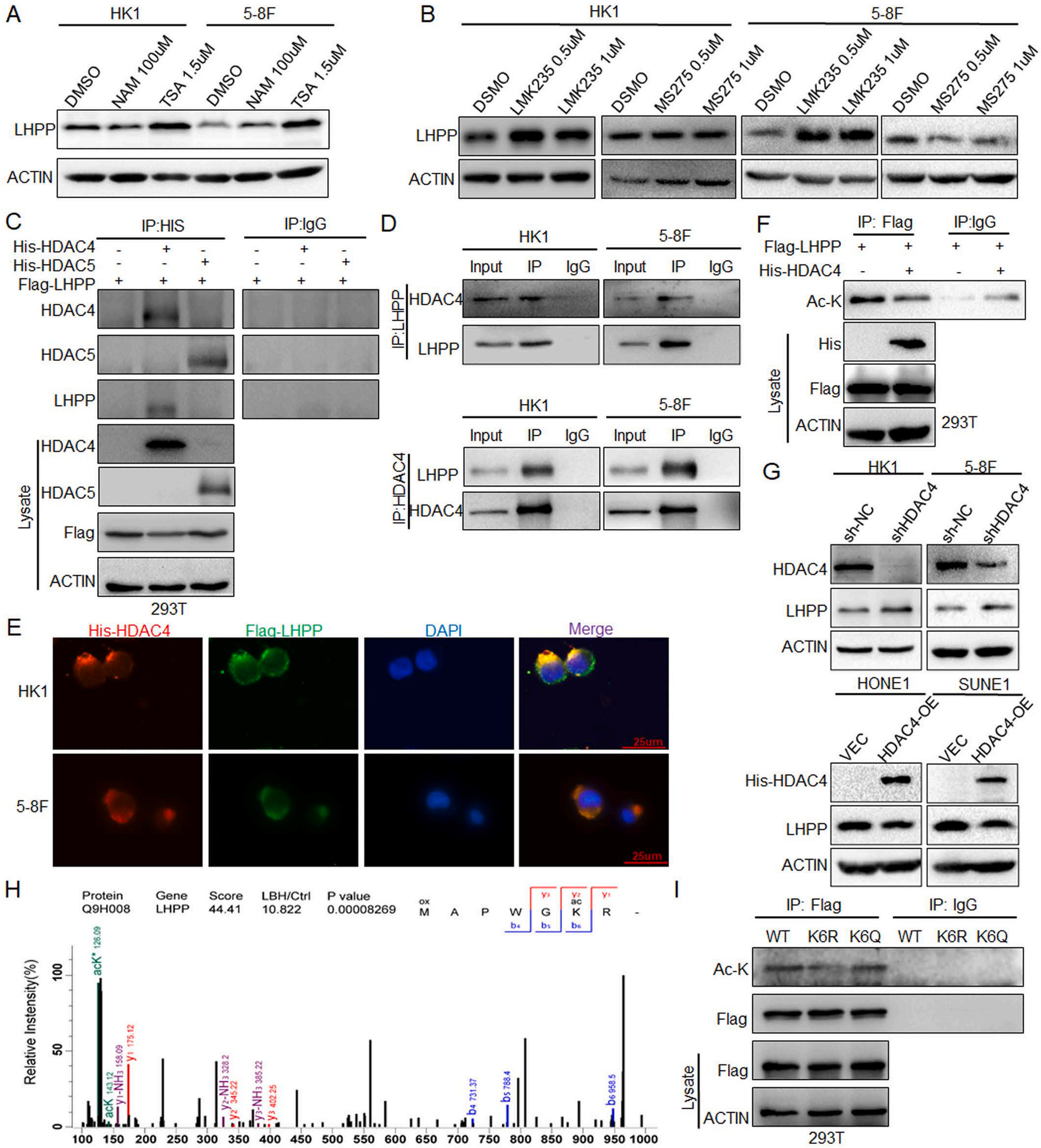 图3 HDAC4调控LHPP的去乙酰化
图3 HDAC4调控LHPP的去乙酰化
4、LHPP的去乙酰化促进TRIM21介导的k48相关泛素化降解
为探究去乙酰化抑制LHPP表达的机制,在HK1和5-8F细胞中敲低HDAC4后,qPCR结果显示LHPP mRNA无明显变化,提示HDAC4对LHPP的抑制主要通过翻译后修饰调控。随后,建立HDAC4敲低稳定细胞株HK1-shHDAC4和5-8F-shHDAC4。Western blot结果显示,在蛋白合成抑制剂环己酰亚胺(CHX)处理下,HDAC4敲低能够抑制LHPP的降解(图4A)。进一步利用Flag LHPP质粒构建LHPP过表达稳转细胞株5-8F-LHPP-OE。IP实验结果显示,敲低HDAC4后,LHPP的泛素化水平明显降低(图4B)。在293T细胞中转染HA-Ub和Flag-LHPP、K6R和K6Q质粒后,结果显示K6R导致泛素化增加,表明LHPP的泛素化依赖于其K6去乙酰化(图4C)。不同类型的泛素连接赋予泛素化不同的功能。K48连接的泛素化主要参与蛋白酶体途径降解,K63连接的泛素化主要参与蛋白稳定性和信号转导。为明确LHPP的泛素连接类型,内源性IP实验结果显示LHPP的泛素化主要是K48连接,而K63连接的泛素化没有观察到(图4D)。与此一致,Flag-LHPP以及HA-Ub、HA-K48和HA-K48R质粒转染293T细胞,IP实验结果验证LHPP的K48位泛素化(图4E)。为阐明调控LHPP的E3连接酶,将Flag-LHPP质粒转入5-8F细胞中,进行IP和质谱分析,鉴定与LHPP相互作用的蛋白。结果表明TRIM21可能是作用于LHPP的主要E3连接酶(图4F)。IP实验表明TRIM21确实与LHPP存在相互作用(图4G)。免疫荧光实验也显示LHPP与TRIM21的共定位主要存在于NPC细胞的细胞质中(图4H)。在293T细胞中转染His-TRIM21、Flag-LHPP和HA-Ub质粒后,结果显示TRIM21过表达增加LHPP泛素化(图4I)。在转染si TRIM21的5-8F-LHPP-OE细胞中进行IP实验,结果显示敲低TRIM21后,LHPP的K48位泛素化水平降低(图4J)。这些结果表明TRIM21促进NPC细胞中LHPP的蛋白酶体依赖性降解。为确定LHPP乙酰化在TRIM21介导的泛素化中的作用,进行IP实验表明K6R增强LHPP与TRIM21的相互作用(图4K)。上述结果说明,LHPP的去乙酰化促进TRIM21介导的K48连接的泛素化和降解,从而降低LHPP的稳定性和表达。
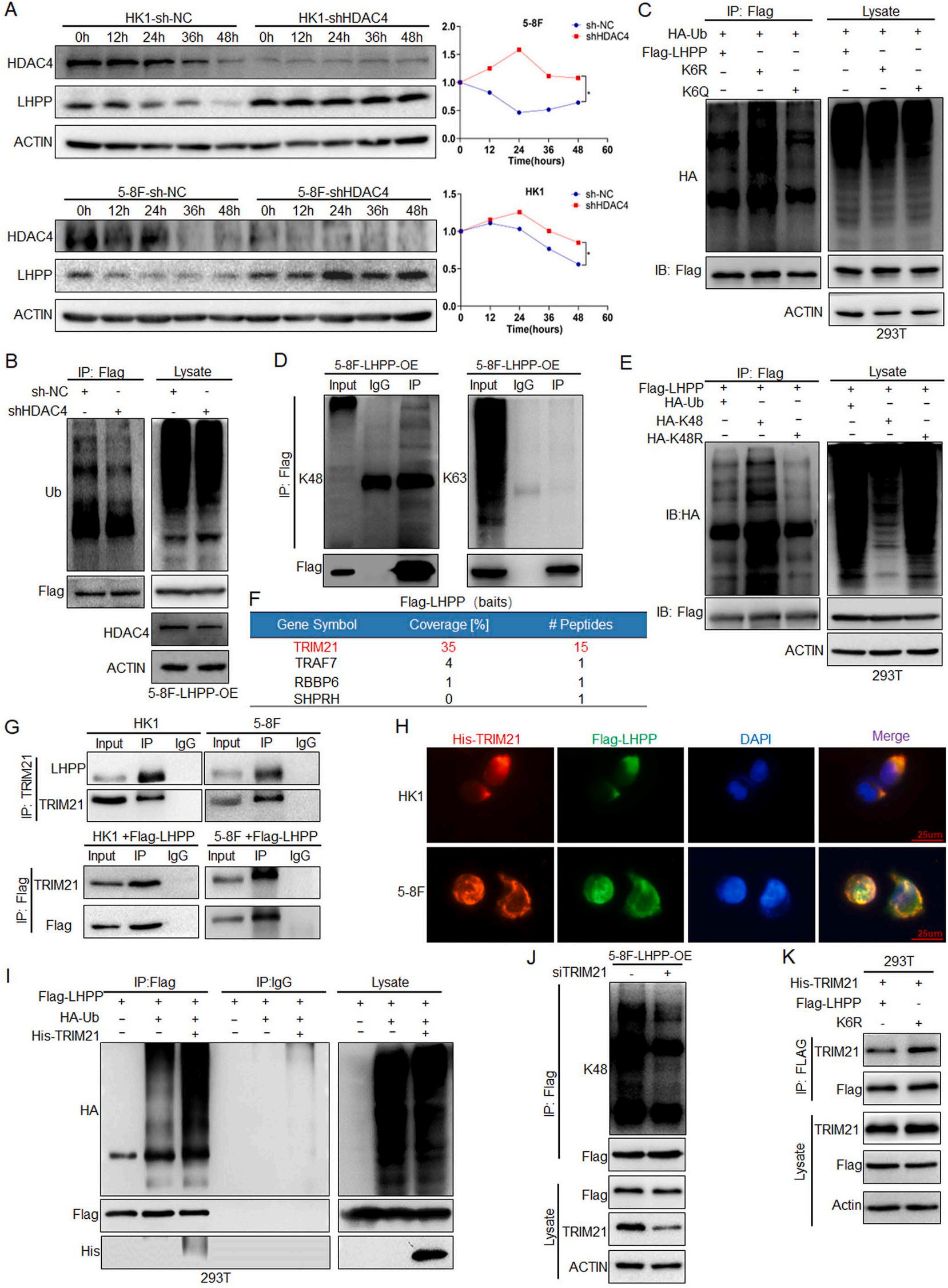
图4 LHPP的去乙酰化促进TRIM21介导的k48相关泛素化降解
5、HDAC4通过LHPP促进NPC细胞增殖和侵袭
为阐明HDAC4是否通过LHPP影响NPC细胞的增殖和侵袭,建立了HDAC4和LHPP双敲低的稳定NPC细胞系。CCK8和克隆形成实验结果表明,敲低HDAC4后细胞增殖能力下降,而双敲低HDAC4和LHPP可逆转shHDAC4处理介导的NPC细胞增殖抑制(图5A-B)。划痕和transwell实验结果也显示HDAC4敲低后细胞迁移和侵袭能力受到抑制,双敲低HDAC4和LHPP可以挽救HDAC4敲低介导的抑制(图5C-D)。这些结果表明HDAC4通过抑制LHPP促进NPC细胞的增殖和侵袭。
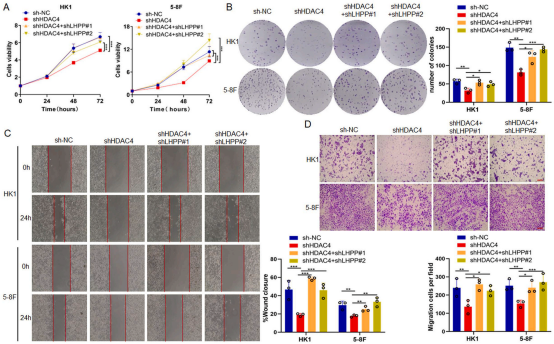
图5 HDAC4通过LHPP促进NPC细胞增殖和侵袭
6、LHPP抑制NPC中酪氨酸激酶TYK2的磷酸化
为探究在NPC细胞中LHPP直接调控的下游激酶,在5-8F细胞中过表达LHPP后,进行IP和质谱分析。鉴定到3个激酶HK2、Tyrosine kinase 2(TYK2)和MAP4K4,未发现AKT和GSK-3β(图6A)。结果提示LHPP可能存在其他直接靶向的激酶。在LHPP过表达的5-8F-LHPP-OE细胞中,Western blot结果显示TYK2的磷酸化水平明显降低,而HK2的磷酸化水平无明显变化(图6B)。进一步的实验在5-8F细胞中转染Flag-LHPP,结果显示LHPP可以与P-TYK2相互作用(图6C)。免疫荧光数据也证实P-TYK2和LHPP主要共定位于NPC细胞的细胞质和细胞核中(图6D)。在HK1、HONE1和5-8F细胞中过表达LHPP后,Western blot检测结果显示STAT1磷酸化水平明显降低,TYK2磷酸化激活水平下调,而STAT3磷酸化水平无明显变化(图6E)。35例人临床鼻咽癌样本的IHC分析结果显示,LHPP与HDAC4、P-TYK2和P-STAT1呈显著负相关,而HDAC4与P-TYK2和P-STAT1呈显著正相关。这些结果表明,LHPP通过抑制TYK2的磷酸化激活来降低STAT1的磷酸化。
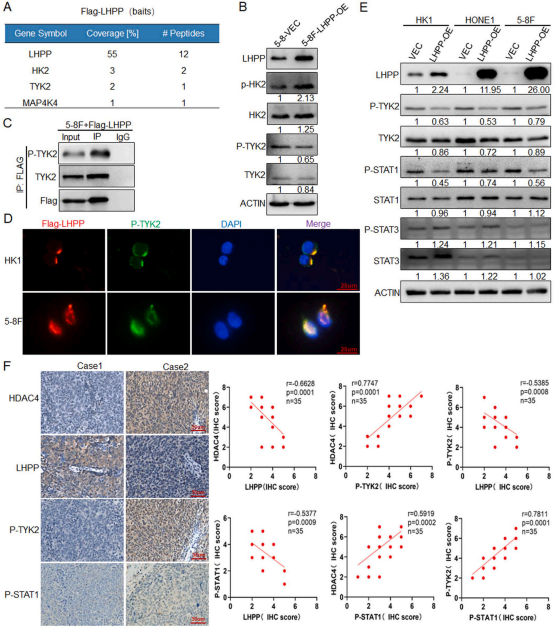
图6 LHPP抑制鼻咽癌酪氨酸激酶TYK2的磷酸化
7、HDAC4在体内通过抑制LHPP的表达促进NPC细胞增殖和转移
为评估LHPP在体内对NPC生长的影响,作者使用5-8F-LHPP-OE细胞建立异种移植瘤模型。结果显示,与对照组相比,LHPP过表达显著抑制了皮下移植瘤的生长(图7A-C)。IHC染色分析表明LHPP的过表达抑制P-TYK2和PSTAT1的表达,增殖标志物Ki67的表达降低(图7D)。此外,肿瘤转移模型结果显示,与对照组相比,5-8F-sh HDAC4组和Tasquinimod处理组均显著减少了肺部转移灶的数量(图7E-F)。转移灶中HDAC4、LHPP和P-TYK2的IHC染色显示,sh HDAC4组HDAC4和P-TYK2表达明显降低,LHPP水平升高(图7G)。以上结果说明,抑制HDAC4可以增加LHPP的表达,从而抑制TYK2/STAT1信号,抑制鼻咽癌的生长和转移。
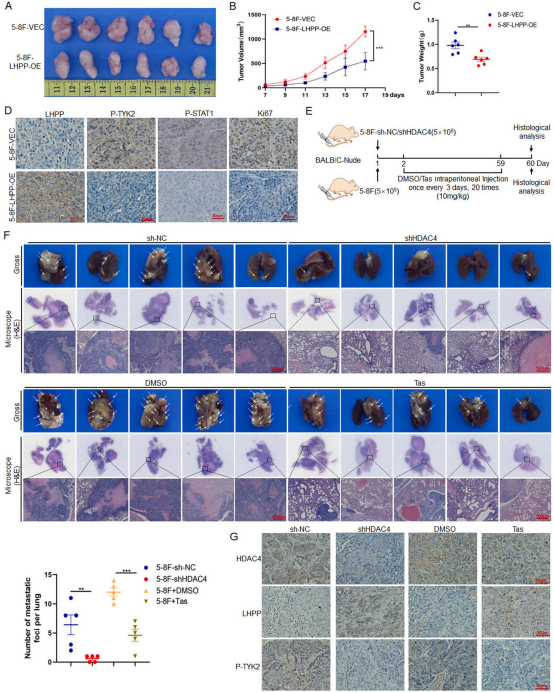
图7 HDAC4在体内通过抑制LHPP的表达促进鼻咽癌的增殖和转移
 图8 LHPP在鼻咽癌细胞中的调控机制及功能模型
图8 LHPP在鼻咽癌细胞中的调控机制及功能模型
结论
总之,作者的工作首次揭示了在NPC中,HDAC4在K6去乙酰化LHPP,通过增强TRIM21介导的K48位泛素化促进LHPP的降解,从而失去对TYK2磷酸化激活的抑制作用,上调STAT1磷酸化,进一步促进NPC的增殖和转移(图8)。本研究为靶向NPC转移提供了新的实验证据和干预靶点。
参考文献
Sun X, Zhang K, Peng X, Zhou P, Qu C, Yang L, Shen L. HDAC4 mediated LHPP deacetylation enhances its destabilization and promotes the proliferation and metastasis of nasopharyngeal carcinoma. Cancer Lett. 2023 Apr 5;562:216158. doi: 10.1016/j.canlet.2023.216158. Epub ahead of print. PMID: 37023940.






