在上皮性卵巢癌模型中,ODF2L作为WEE1抑制的合成致死伴侣
实验方法:抗体和小分子抑制剂,合成致死性RNAi筛选,细胞活力测定和菌落形成试验,细胞同步和G1/S释放,CDK1激酶活性测定,EdU掺入试验,蛋白过表达的质粒构建,BRET化验
WEE1已成为上皮性卵巢癌(EOC)的一个有吸引力的靶点,但EOC细胞如何改变其对WEE1抑制的敏感性尚不清楚。本文通过细胞周期机制相关基因RNAi筛选,发现靶向精子尾部外致密纤维2样(ODF2L)是EOC细胞中具有WEE1激酶抑制作用的合成致死伴侣。在体外和体内异种移植的EOC细胞系中,敲低ODF2L可使细胞对WEE1抑制剂AZD1775敏感。机制上,ODF2L丢失后对WEE1抑制的敏感性增加伴随着DNA损伤的累积。ODF2L将WEE1的功能冗余激酶PKMYT1募集到CDK1-cyclin B复合物上,从而在WEE1被抑制时限制了CDK1的活性。临床上,ODF2L的上调与患者来源的EOC细胞中CDK1活性、DNA损伤水平和对WEE1抑制的敏感性相关。此外,在EOC患者来源的异种移植模型中,ODF2L水平预测了对WEE1抑制的反应。在ID8卵巢癌同基因小鼠模型中,包装ODF2L siRNA和AZD1775的肿瘤靶向脂质纳米颗粒联合治疗可协同抑制肿瘤生长。这些数据表明,对于表达低水平ODF2L的EOC细胞,WEE1抑制是一种很有前景的精确治疗策略。
技术路线:

结果:
(1) EOC细胞中ODF2L的表达与对WEE1抑制的敏感性相关
为深入了解影响EOC细胞对WEE1抑制敏感性的机制,我们使用从TRC慢病毒shRNA文库中筛选的定制慢病毒shRNA文库进行了细胞周期机制相关基因RNAi筛选,并针对由1,295个shRNA构建物代表的263个人类细胞周期相关基因。初步筛选涉及将A2780转化为含有针对263个单个基因的shRNA的慢病毒池,并用亚致死剂量的AZD1775处理它们。从使用A2780细胞的初级筛选中,从263个基因中选择前30个基因进行二级验证筛选(图1A)。ODF2L在初级筛选中被确定为第三个最有效的靶点,并在次级筛选中作为先导靶点出现,因为它使卵巢癌类型的癌细胞对WEE1抑制敏感(图1B)。ODF2L的表达与卵巢癌对AZD1775的耐药性呈正相关(图1C)。为了进一步证实ODF2L参与了EOC对WEE1抑制的应答,我们建立了体内AZD1775耐药模型,模拟化疗耐药的临床发展过程(图1D)。用A2780细胞接种裸鼠SC。在AZD1775的作用下,A2780异种移植物在最初15天内生长缓慢。然而,肿瘤的生长最终在晚期明显增加。在终点处死小鼠进行肿瘤切除,AZD1775处理组与对照组之间肿瘤体积无显著差异(图1D)。相比之下,AZD1775处理后的肿瘤细胞中AZD1775 IC50比未经处理的肿瘤细胞增加了约4.5倍(图1E),表明在体内成功诱导了对WEE1诱导的抗性。在这个体内模型中,AZD1775处理组的肿瘤细胞中ODF2L的表达显著增加,通过RT-qPCR和免疫印迹验证了这一点(图1F)。在来自配对亲本细胞系的4个AZD1775抗性卵巢细胞系中,ODF2L的表达一致且显著增加(图1G)。此外,在RNAi筛选中鉴定的30个基因中,有19个在具有WEE1抑制的特定亲本细胞系中具有亚致死功能(图1B),并且它们在配对抗性细胞系中的表达特异性增加。综上所述,ODF2L表达与卵巢癌对WEE1抑制的敏感性呈负相关。
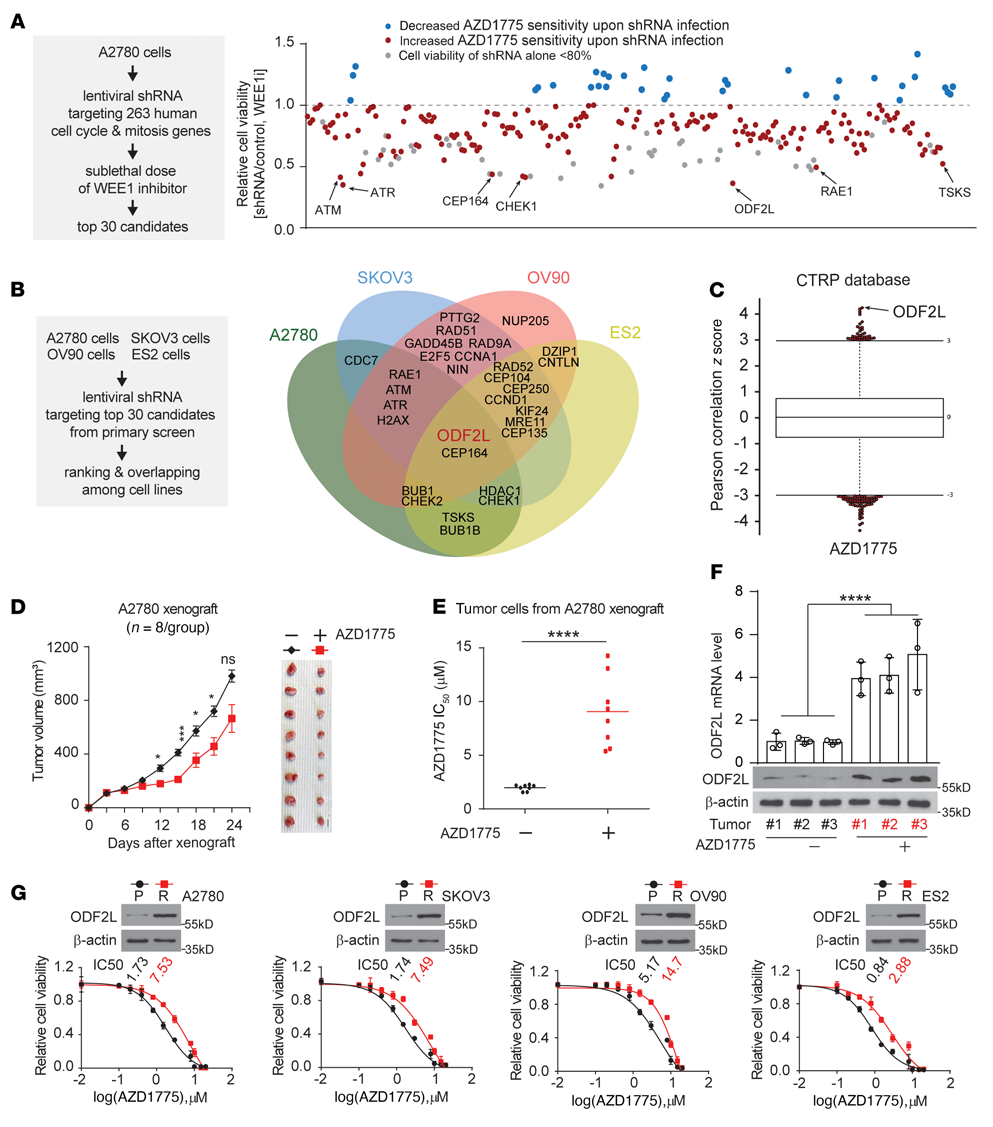
图1:EOC细胞中ODF2L的表达与对WEE1抑制的敏感性相关
(2) ODF2L在EOC细胞中作为WEE1的合成致死伴侣
为了研究ODF2L在EOC细胞对WEE1抑制反应中的作用,我们在4个EOC细胞系中使用2个不同的shRNA克隆靶向下调ODF2L(图2A)。虽然单独敲除ODF2L不会显著降低细胞活力或集落形成潜力,但在亚致死剂量AZD1775处理后,ODF2L的缺失导致细胞活力和集落形成显著降低(图2A, B)。此外,使用FACS, ODF2L敲除显著加重了亚致死剂量AZD1775处理的EOC细胞的凋亡细胞死亡。进一步证实了ODF2L在EOC细胞中作为WEE1的合成致死伴侣的作用(图2C)。此外,在异种移植小鼠模型中,还观察到ODF2L缺失后对AZD1775处理的致敏性。在AZD1775处理的小鼠中,ODF2L敲低导致肿瘤生长和肿瘤大小显著降低(图2D, E)。这些数据表明,ODF2L表达显著影响EOC细胞对WEE1抑制的反应。
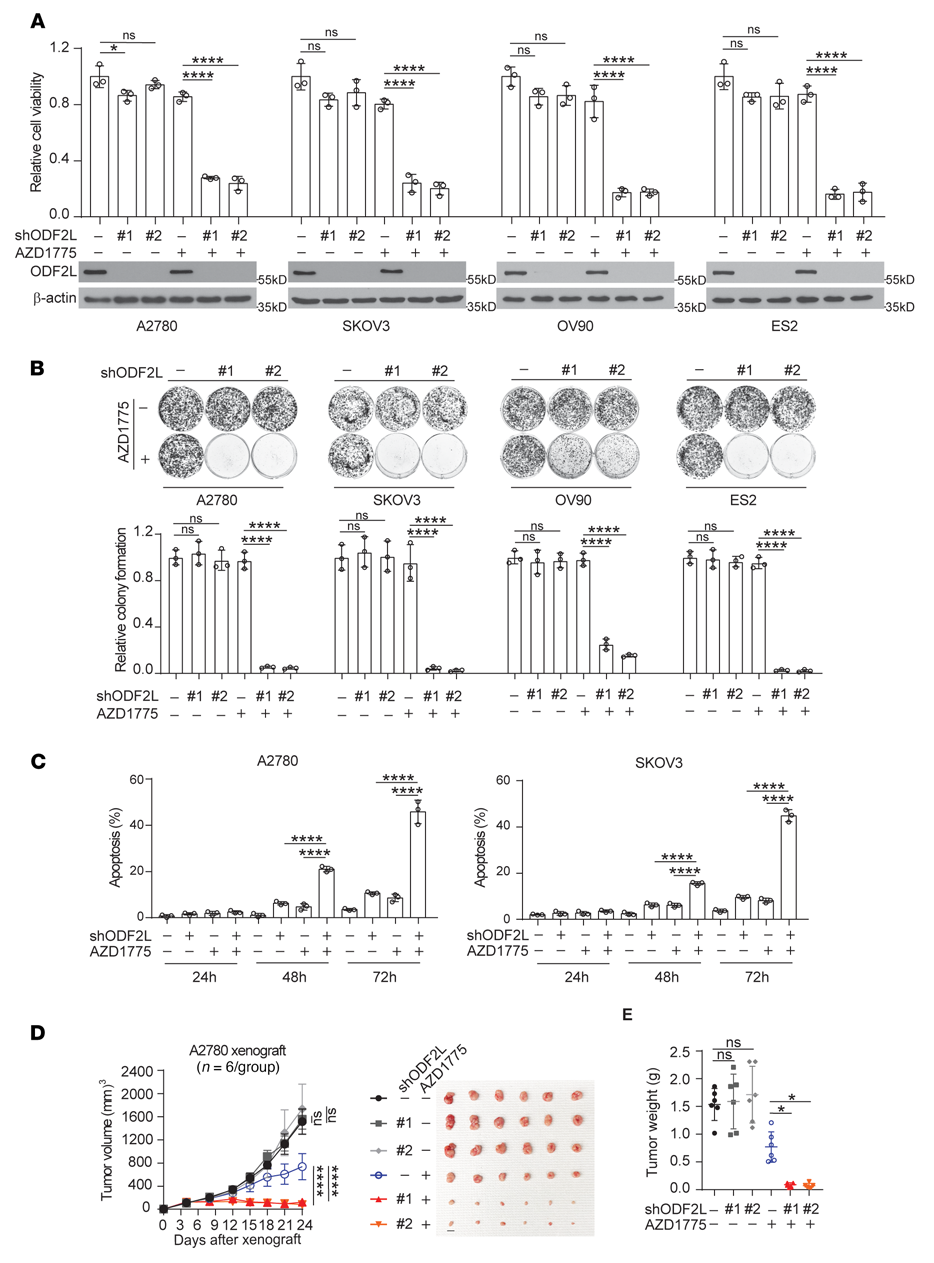
图2:ODF2L在EOC细胞中作为WEE1的合成致死伴侣
(3) ODF2L缺失加重了WEE1抑制引起的EOC细胞DNA损伤
WEE1抑制可通过CDK1的异位激活促进有丝分裂进入并增加基因组的不稳定性。组成型活性CDK1 T14A/Y15F突变体的单等位基因表达可诱导小鼠胚胎成纤维细胞(MEFs)的复制应激和细胞死亡,并显著增加γ-H2AX水平、染色体断裂和DNA损伤反应(DDR)激活。为深入了解ODF2L使细胞对AZD1775敏感的机制,我们使用DSB标记物γH2AX来监测DNA损伤水平。如图3A所示,在A2780和SKOV3细胞中,通过免疫荧光染色检测,AZD1775处理后,ODF2L敲低显著增加了γ-H2AX+细胞的百分比。与γ-H2AX一致,与对照细胞相比,在AZD1775处理下,ODF2L敲低的细胞中,彗星尾部的DNA数量(图3B)和ATM、CHK2和RPA32/RPA2的磷酸化水平(图3C)显著增加。为了测试DNA损伤的增加是否是ODF2L敲除细胞中存在WEE1抑制的细胞周期调节的综合缺陷的结果,我们使用基于click化学的EdU测定法结合DNA含量染色Hoechst 33342来监测细胞周期分布。如图3D所示,AZD1775处理下,ODF2L敲低细胞中DNA含量介于1C和2C之间但EdU-(1C<DNA含量<2C/EdU-)的细胞群百分比显著增加,这也可以通过在ODF2L敲低细胞中强制表达耐shRNA的ODF2L来挽救(补充图未展示)。这些数据进一步支持了ODF2L缺失和WEE1抑制的结合导致非计划进入有丝分裂,导致有丝分裂中DNA含量不完全的细胞数量显著增加,这是一种有害的DNA损伤形式。与此结果一致的是,通过流式细胞术细胞分选后的免疫印迹检测,DNA含量在1C和2C之间但EdU-(1C<DNA含量<2C/EdU-)的细胞群表达了大量的γ-H2AX(图3E)。以上结果表明,ODF2L敲低可促进EOC细胞周期失调,进一步加重WEE1抑制诱导的DNA损伤。
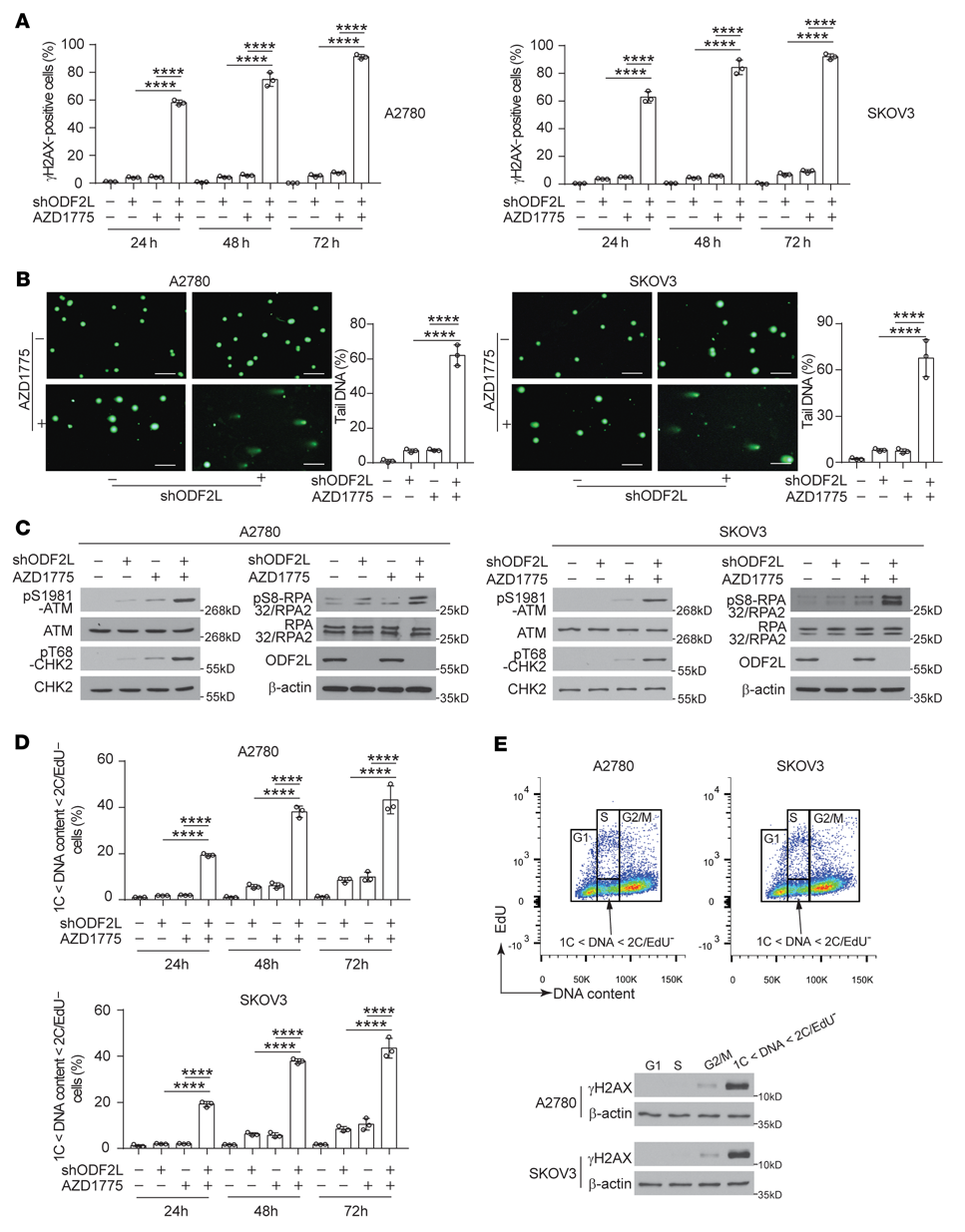
图3:ODF2L缺失加重了WEE1抑制引起的EOC细胞DNA损伤
(4) ODF2L抑制AZD1775诱导的CDK1活性
我们探讨了ODF2L在EOC细胞中促进细胞周期失调并进一步加剧WEE1抑制诱导的DNA损伤的机制。考虑到WEE1的主要下游靶点是CDK1-cyclin B1复合物,我们首先通过监测体外CDK1活性的变化来检测当WEE1被抑制时,ODF2L是否恢复了CDK1的失活。首先,在G1-S释放后,用AZD1775处理ODF2L敲低或过表达的细胞和指定的对照细胞4小时。然后提取细胞裂解液并与重组CDK1底物GST-PP1Cα孵育。然后我们通过Western blotting定量pT320 GST-PP1Cα的总水平以监测CDK1活性。ODF2L敲低和WEE1抑制的结合增强了CDK1的活性(图4A),延长了CDK1的激活状态(补充图未展示)。Tyr15和Thr14的磷酸化是控制CDK1活性的关键,这使CDK1-cyclin B1复合物在细胞接近有丝分裂前受到抑制。WEE1特异性磷酸化CDK1的Tyr15,而PKMYT1在Tyr15和Thr14上具有双重活性。我们观察到ODF2L的缺失影响Tyr15和Thr14的磷酸化,尤其是CDK1中Thr14磷酸化的强烈衰减,与PKMYT1的功能惊人地相似(图4B)。为了确定ODF2L是否在CDK1 Thr14磷酸化中起重要作用,我们产生了表达CDK1 T14A-、CDK1 Y15F-或CDK1 WT-的EOC细胞,去除内源性CDK1,并监测AZD1775处理下这些EOC细胞中CDK1活性的变化。ODF2L缺失显著增加了CDK1 WT细胞的CDK1活性,但在CDK1 T14A细胞中没有(图4C)。相反,当ODF2L被敲低时,在CDK1 WT和CDK1 Y15F细胞中也同样观察到CDK1活性的增加(图4D),这表明ODF2L可能特异性地通过CDK1 Thr14磷酸化来抑制WEE1抑制下的CDK1活性。与WEE1抑制后的对照细胞相比,使用CDK1抑制剂Ro-3306治疗可以有效地挽救ODF2L敲除细胞的集落形成潜力(图4E),并减少凋亡细胞死亡(图4F)。综上所述,ODFL2可以促进CDK1 Thr14磷酸化,从而在WEE1抑制的情况下抑制EOC细胞中的CDK1活性。
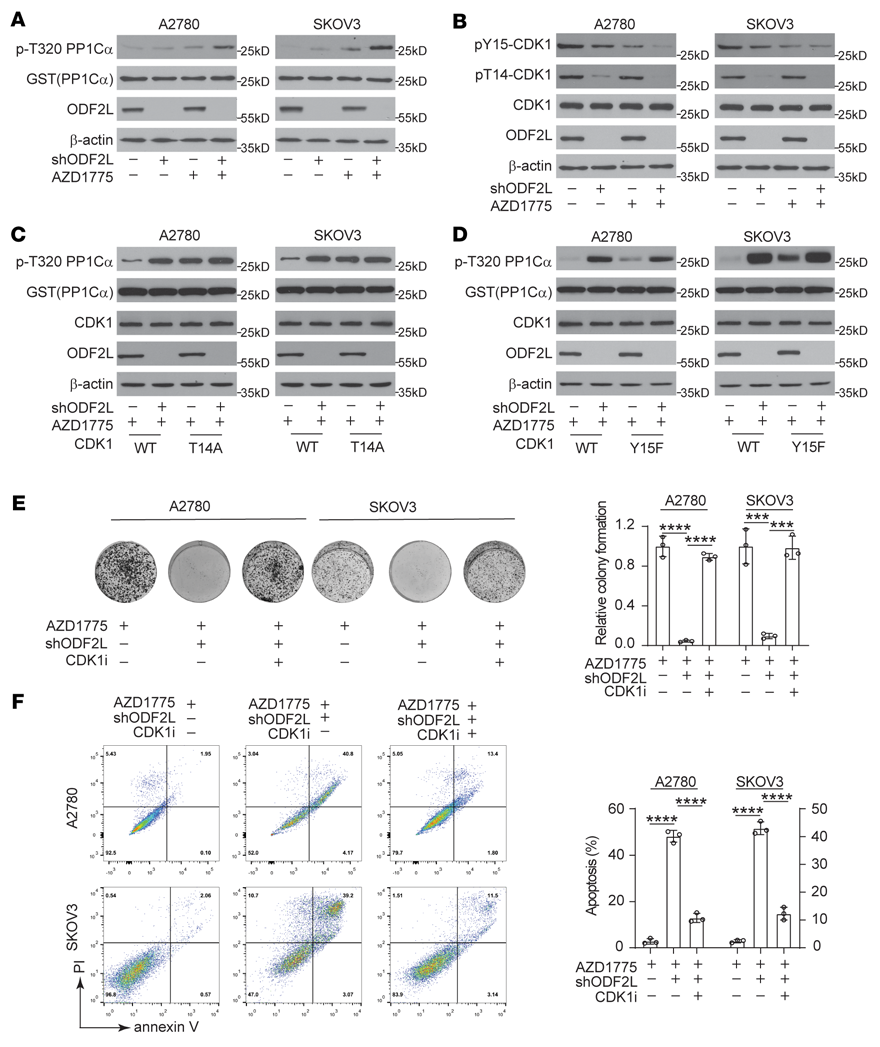
图4:ODF2L抑制AZD1775诱导的CDK1活性
(5) ODF2L允许PKMYT1招募到CDK1复合体
我们探讨了ODF2L如何在WEE1抑制的情况下促进EOC细胞中CDK1的磷酸化。与WEE1和PKMYT1水平与其底物CDK1水平之间的强相关性类似,ODF2L水平也与CDK1水平显著相关(图5A)。因此,ODF2L可能参与WEE1或PKMYT1复合物调控CDK1磷酸化。考虑到ODF2L在调节CDK1磷酸化Thr14 (p-Thr14)中的作用与PKMYT1重叠,我们首先测试了ODF2L是否与PKMYT1共同调节CDK1磷酸化。G1-S释放4小时后提取EOC细胞裂解液,用于对ODF2L或PKMYT1的免疫沉淀。ODF2L和PKMYT1之间有很强的相互作用(图5B)。ODF2L敲低在很大程度上减少了EOC细胞中CDK1免疫沉淀复合物中PKMYT1的存在(图5C);相比之下,PKMYT1敲低对EOC细胞CDK1免疫沉淀复合物中ODF2L的水平没有显著影响(图5D)。此外,在完整细胞的背景下,CDK1和PKMYT1之间的相互作用也被ODF2L的敲低所消除,这可以通过恢复ODF2L的表达来恢复,正如在共转染了Halo-PKMYT1和Nluc-CDK1的EOC细胞中进行的生物发光共振能量转移(BRET)实验所示(图5E)。在转染了表达有Flag标记的ODF2L的n端、中程和c端结构域的质粒的EOC细胞中,通过对Flag的免疫沉淀,我们证实了ODF2L的n端和c端结构域分别直接与PKMYT1和CDK1相互作用(图5F)。一致地,在EOC细胞中,PKMYT1的过表达或下调分别增加或降低对AZD1775的抗性,而ODF2L的下调则完全消除了这种作用(图5G, H),这表明ODF2L在介导PKMYT1恢复G2/M检查点方面发挥了关键作用。单独敲除ODF2L比敲除PKMYT1在致敏AZD1775方面更有效,这可能是因为残留的PKMYT1仍然可以被ODF2L募集和富集以灭活CDK1(图5H)。综上所述,ODF2L介导了PKMYT1与CDK1复合物的相互作用,因此当WEE1在EOC细胞中被抑制时,PKMYT1使CDK1和G2/M检查点恢复失活。
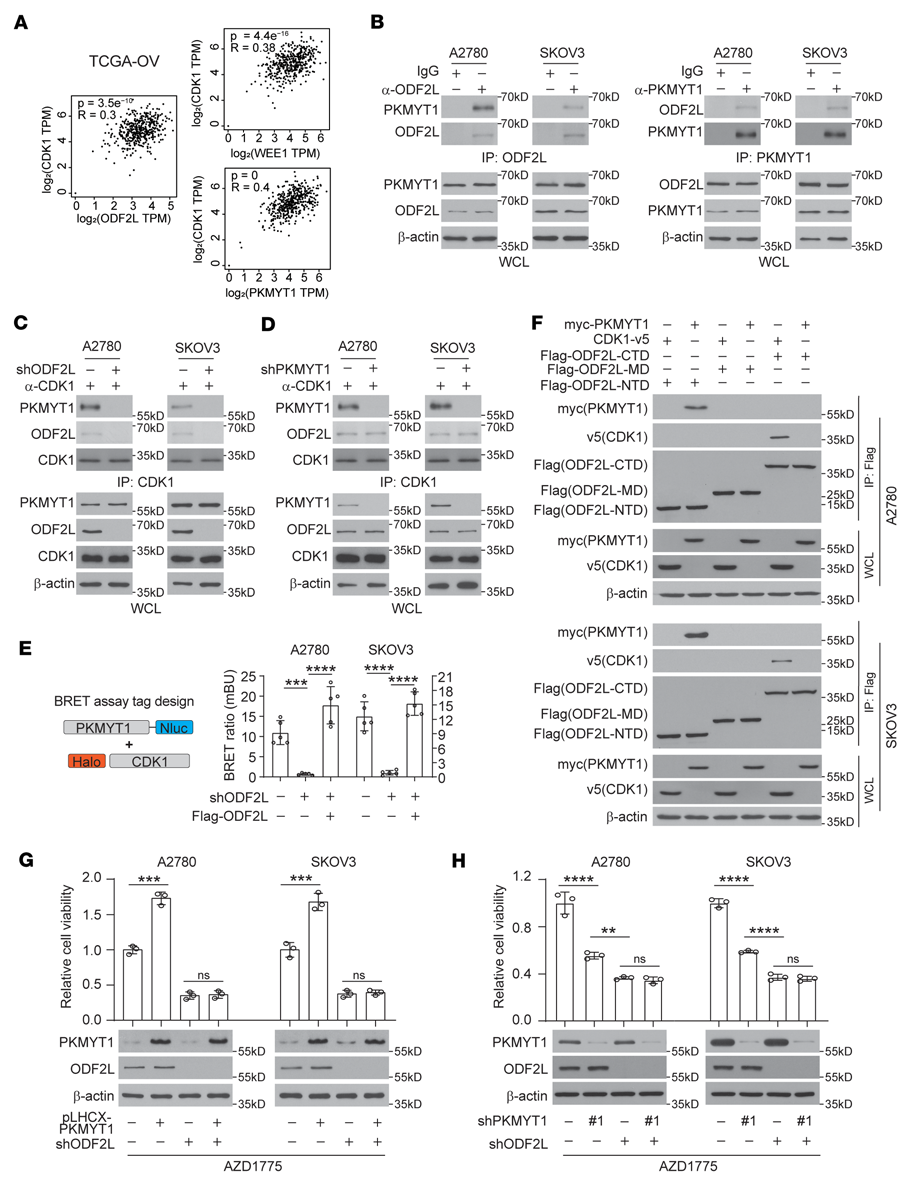
图5:ODF2L允许PKMYT1招募到CDK1复合体
(6) ODF2L表达水平与AZD1775在EOC中的敏感性有临床相关性
为了进一步验证ODF2L与WEE1抑制EOC应答之间的关系,我们在一组来自57例卵巢癌患者组织样本的AZD1775处理的原代EOC细胞中检测了ODF2L水平、CDK1活性和细胞活力的相关性。为了检测CDK1活性,分离的原代细胞在G1-S释放后用AZD1775处理4小时。然后提取细胞裂解液并与重组CDK1底物GST-PP1Cα孵育。然后用Western blotting检测细胞总裂解物中p-Thr320 GST-PP1Cα和ODF2L的总水平,并用ImageJ软件进行定量(图6A)。我们还监测了AZD1775处理后72小时的细胞活力(图6B)。在AZD1775处理的原代EOC细胞中,ODF2L表达水平与CDK1活性呈强负相关(图6C),与细胞活力呈显著正相关(图6D),表明ODF2L在EOC细胞对WEE1抑制的反应中起重要作用。此外,ODF2L表达水平也预测了患者源性异种移植(PDX)小鼠模型体内对AZD1775治疗的不同反应。AZD1775治疗在ODF2L低表达的患者癌组织中导致肿瘤生长明显延迟,而在ODF2L高表达的患者癌组织中则没有(图6E)。综上所述,这些结果有力地支持了ODF2L表达水平在临床上与AZD1775在EOC中的敏感性相关的观点。
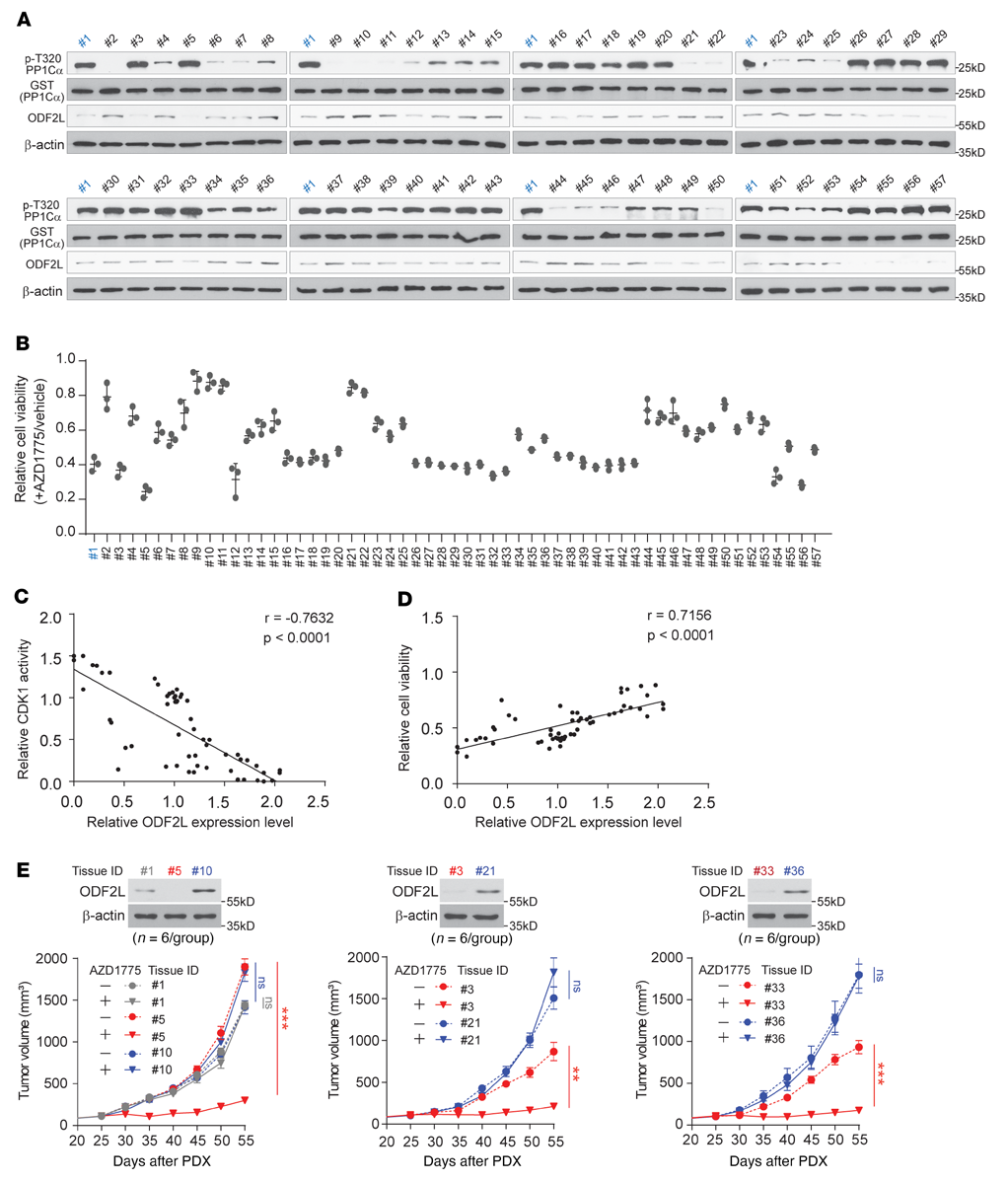
图6:ODF2L表达水平与AZD1775在EOC中的敏感性有临床相关性
(7) 在同基因小鼠模型中,使用RNAi治疗平台靶向ODF2L可使卵巢癌细胞对WEE1抑制剂治疗增敏
ODF2L是WEE1的合成致死伙伴,ODF2L的缺失使卵巢癌对WEE1抑制剂的反应增敏,这表明ODF2L可能是卵巢癌治疗的一个有希望的转化靶点。我们利用之前建立的卵巢癌ID8Luc同基因小鼠模型,评估了靶向ODF2L联合WEE1抑制剂的体内治疗潜力。ODF2L是一种没有市售抑制剂的支架蛋白;因此,我们使用靶向RNAi治疗性脂质纳米颗粒(LNP)平台ASSET(锚定继发性scFv靶向)在体内特异性地降低ID8癌细胞中的ODF2L。通过与识别大鼠IgG2a Fc区(ASSET)的脂质锚定单链抗体连接体结合,这些靶向LNPs被细胞靶向抗体包裹。由于卵巢ID8细胞特异性且高度表达EGFR,我们将负载ODF2L siRNA (siODF2L-loaded)或负载scramble siRNA (siScramble-loaded)的LNPs包被抗EGFR抗体,并将其靶向到ID8细胞(图7A)。腹腔转移性ID8-Luc肿瘤小鼠在肿瘤接种后7天腹腔注射与抗EGFR结合的siScramble-LNPs或siODF2L-LNPs (0.75 mg/kg),同时每天注射DMSO或AZD1775 (30 mg/kg)。采用活体生物发光成像(BLI)监测肿瘤生长情况。siODF2L-LNPs和AZD1775联合使用可显著抑制肿瘤生长潜力,而对照小鼠,单独使用siODF2L-LNPs或单独使用AZD1775均未观察到肿瘤生长的显着差异(图7B, C)。一致地,总生存率显著提高(图7D),腹膜出血性腹水减少,ODF2L丢失和AZD1775联合治疗组肿瘤结节数减少(图7E)。siODF2L-LNPs治疗成功地降低了ODF2L在ID8肿瘤中的表达,但在主要器官,包括心脏、肝脏、脾脏、肺和肝脏(图7F)中没有降低ODF2L的表达(图7F),导致肿瘤细胞中CDK1的大量激活(图7F)和DNA损伤加剧(图7G)。这些数据为ODF2L与WEE1抑制剂在卵巢癌治疗中作为有效的合成致死靶标伴侣提供了原理证明。

图7:在同基因小鼠模型中,使用RNAi治疗平台靶向ODF2L使卵巢癌细胞对WEE1抑制剂治疗增敏
结论:ODF2L是WEE1的合成致死伴侣,在恢复人类EOC细胞中AZD1775抗性G2/M细胞周期检查点信号通路中起关键作用。临床上,ODF2L可作为一种预测标志物,并作为一种有希望的治疗靶点,联合WEE1抑制剂治疗EOC患者。
参考文献:Li, J., Lu, J., Xu, M., Yang, S., Yu, T., Zheng, C., Huang, X., Pan, Y., Chen, Y., Long, J., Zhang, C., Huang, H., Dai, Q., Li, B., Wang, W., Yao, S., & Pan, C. (2023). ODF2L acts as a synthetic lethal partner with WEE1 inhibition in epithelial ovarian cancer models. The Journal of clinical investigation, 133(2), e161544. https://doi.org/10.1172/JCI161544.






