TGF-β信号通过circRNA CDR1as促进宫颈癌转移
实验方法:芯片测序,RNase R消化实验,RT-qPCR,Western blot,RNA 干扰,过表达,细胞迁移实验,伤痕愈合实验,荧光原位杂交、RNA pull-down,RIP以及建立宫颈癌体内模型。
宫颈癌的发病率和死亡率由于宫颈癌转移居高不下,转移的总体生存率仍然很低。因此,有效的预测性生物标志物对于缓解病情进展至关重要。在这里,作者首先通过TGF-β诱导宫颈癌细胞,发现CDR1as显著上调。接着通过CDR1as预测淋巴结转移和不良预后并且实验验证CDR1as能促进宫颈癌细胞的转移。为寻找与CDR1as相互作用的miRNA和蛋白,通过多种数据库进行生物信息学分析预测到IGF2BPs与CDR1as相互作用,并通过RIP和RNA pull-down实验验证,表明IGF2BP1可能是一个特定的潜在下游靶点。接着作者分析了CDR1as上调后不同mRNA和m6A水平的变化,结果表明TGF-β信号通过CDR1as和m6A在宫颈癌细胞中激活EMT。这些数据表明,TGF-β信号通过circRNA CDR1as促进宫颈癌转移。
技术路线:

主要实验结果:
1、TGF - β诱导宫颈癌细胞中CDR1as表达上调
EMT是肿瘤进展过程中早期的标志之一,其信号维持在很大程度上依赖于TGF- β的激活。用SRI-011381处理Siha细胞3天后,Siha细胞诱导EMT表型(图1A)。RNA测序显示6964个circRNA表达上调,6596个circRNA表达下调(图1B)。作者选择了50个变化最明显的环状RNA(circRNA)进行RT-PCR检测。结果显示,CDR1as的变化倍数最大(图1C)。因此,作者推测CDR1as参与TGF-β诱导的宫颈癌转移。
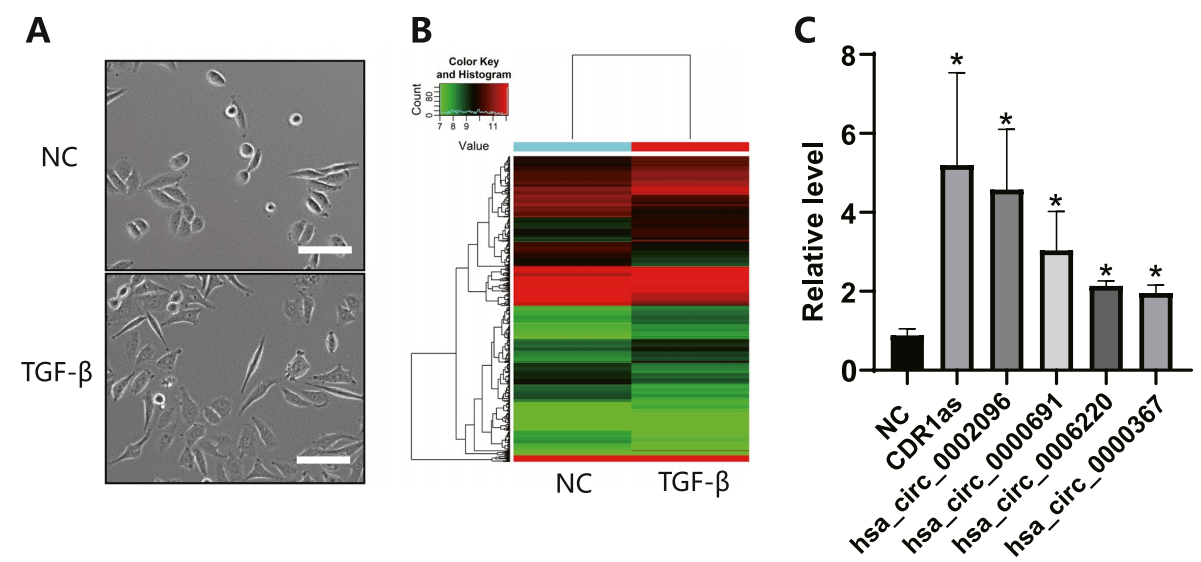
图1 TGF- β对宫颈癌细胞EMT的诱导作用
2、CDR1as与淋巴结转移不良预后相关
RNase R酶切实验显示,环状CDR1as只能在cDNA样品中扩增,而CDR1在gDNA和cDNA中均存在线型CDR1as(图2A);RNase R消化后,环状结构的稳定性明显高于线状结构(图2B)。Sanger测序结果显示,扩增的寡核苷酸序列与circbase数据库中的序列相似(图2C)。这些结果表明CDR1as是一种环状RNA。FISH和核浆萃取实验显示CDR1as主要在细胞质中表达(图2D-E),这表明CDR1as可能在转录后起作用。采用原位杂交技术评估CDR1as与临床参数的关系(图2F,表2),结果显示CDR1as在淋巴结转移中表达较高(图2G),与总生存期较短、预后较差相关(图2K-L),但CDR1as与肿瘤分级、分期、原发肿瘤体积无显著关系(图2H-J)。
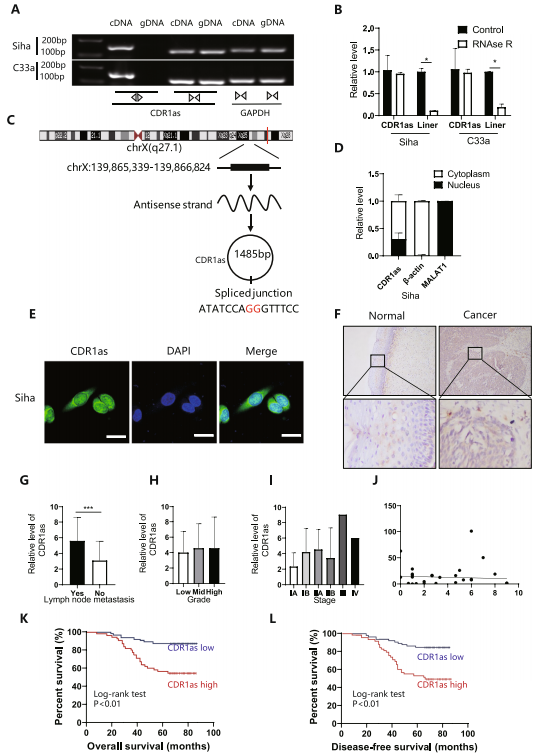
图2 CDR1as预测淋巴结转移和更差的总生存期
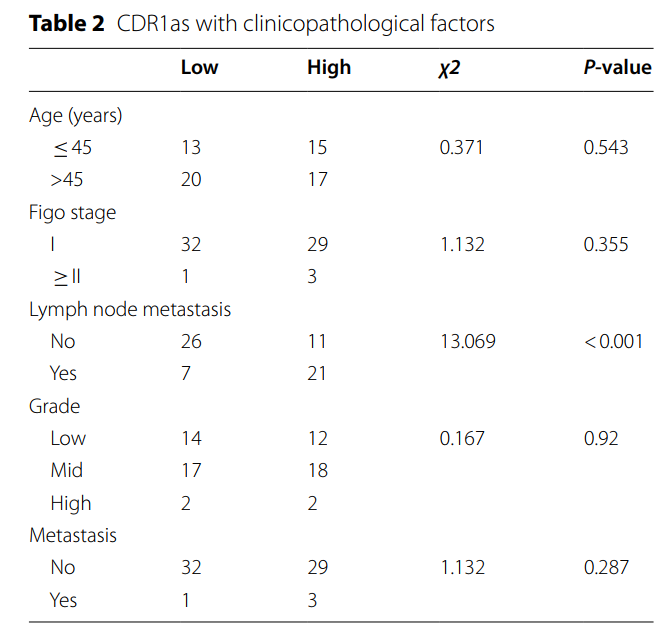
表2 CDR1as与临床病理因素
3、CDR1as促进宫颈癌细胞的转移
在三种癌细胞中过表达CDR1as后,qPCR结果显示,CDR1as成功转染到三种癌细胞中(图3A-C);细胞迁移实验结果显示,与对照组比较,癌细胞的侵袭率和转移率分别增加了1.86倍和2.07倍,表明宫颈癌的转移显著加快(图3D-G);细胞划痕实验结果显示,伤口愈合时间更短(图3H-I),这二者结果表明癌细胞的活性增强。作者还通过检测过表达CDR1as后细胞形态变化,以及RT-qPCR和Western blot检测E-CAD、N-CAD和SLUG等的表达情况(图3K-L)。这些结果表明CDR1as能促进宫颈癌的转移。
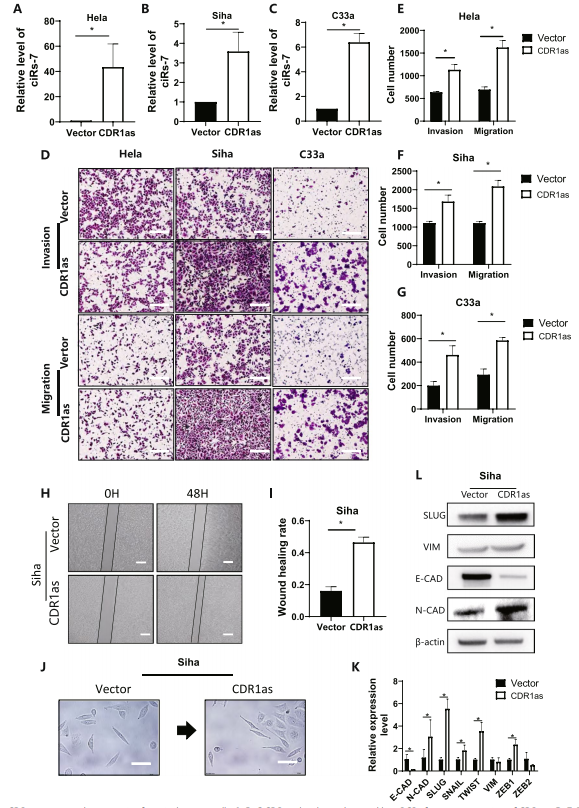
图3 CDR1as能促进宫颈癌细胞的转移
4、CDR1as通过与IGF2BP1结合促进宫颈癌细胞的EMT
CDR1as过表达后,细胞呈纺锤形形态,而转染载体的细胞上仍有明显的边缘,qPCR和Western blot结果显示,CDR1as的升高降低了E-cadherin的表达,增加了间充质标志物N-cadherin和Vimentin的表达(图3K-L),其中Slug的上调幅度最大。根据生物信息学分析,作者将几个数据库的搜索结果进行了重叠来鉴定CDR1as和miRNA之间的潜在结合,结果显示25个miRNA与CDR1as结合。其中,经生物信息学预测,miR-203能够调控Slug的表达。然而,CDR1as探针下拉实验没有发现Slug通路相关的miRNA(图4A),表明Slug的激活可能不受miRNA海绵的调节。除了竞争的内源性RNA (ceRNAs)外,有报道表明CDR1as能够影响蛋白质相互作用。例如CDR1as可以释放IGF2BP3的促转移功能。因此,作者进行了RNA-pull-down来鉴定可能与CDR1as结合的潜在蛋白质。实验结果显示在35kD-70kD之间有几个单独的条带(图4B)。通过生物信息学数据库检测到IGF2BPs与CDR1as相互作用。此外,在70 kD附近有条带,正好与IGF2BPs的分子量相吻合。作者进行了RIP和RNA pull-down实验,结果显示, CDR1as探针只能检测到IGF2BP1(图4C-D),表明IGF2BP1可能是一个特定的潜在下游靶点。为了探讨IGF2BP1是否影响过表达CDR1as细胞中的Slug表达,作者沉默了CDR1as过表达细胞中的IGF2BP1。结果表明,敲降IGF2BP1后Slug表达上调(图4E)。此外,RIP实验表明IGF2BP1优先结合Slug mRNA上的m6A修饰位点(图4F-H)。沉默IGF2BP1后也能通过CDR1as抑制肿瘤的转移和侵袭潜能(图4I)。综上所述,CDR1as与IGF2BP1特异性结合以稳定和提高Slug的表达。

图4 CDR1as通过与IGF2BP1结合促进宫颈癌细胞的EMT
5、TGF - β信号可能通过CDR1as和m6A在宫颈癌细胞中激活EMT
N6-甲基腺苷(m6A)几乎参与了RNA代谢的所有步骤,是转录修饰的重要组成部分。结合对CDR1as功能和机制的初步验证,作者分析了CDR1as上调后不同mRNA和m6A水平的变化。KEGG和GO分析表明,CDR1as显著激活了TGF-β信号(图5A)。此外,Western blot检测结果显示,过表达的CDR1as显著激活了p-smad2和p-smad3(图5B-C)。当用LY2109761处理过表达CDR1as的细胞后, EMT表型与过表达载体的相同,这表明CDR1as通过激活TGF-β信号传导促进EMT(图5D)。细胞迁移实验结果显示,与过表达的CDR1as细胞相比,用LY2109761处理过表达CDR1as的细胞组穿透细胞数量明显减少(图5E)。这些结果提示CDR1as激活TGF-β信号和EMT促进宫颈癌细胞转移。
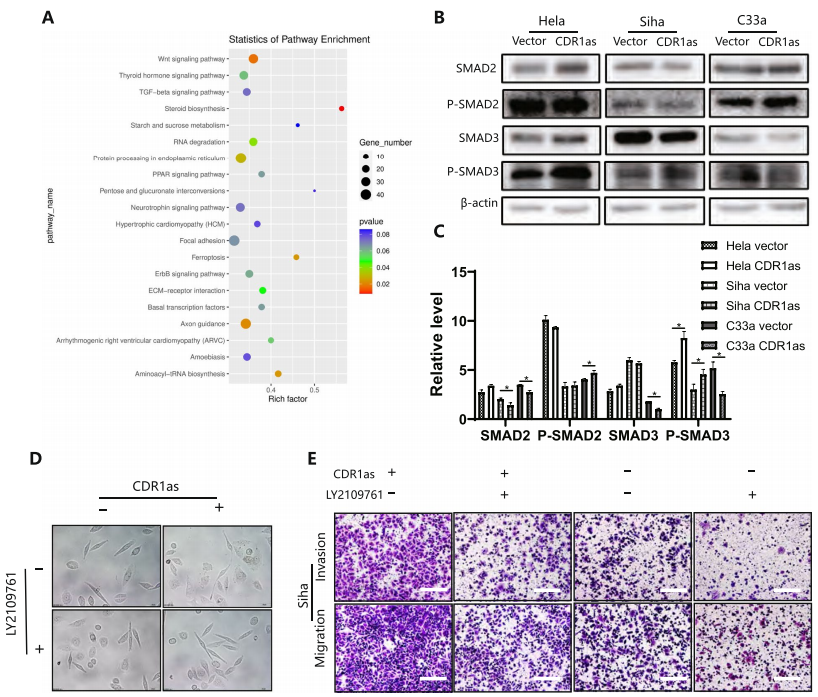
图5 TGF - β信号通过CDR1as和m6A在宫颈癌细胞中激活EMT
6、CDR1as在体内促进宫颈癌细胞的进展
作者进行了体内实验,通过将宫颈癌细胞注射到小鼠皮下组织和足垫来评估CDR1as在宫颈癌转移中的体内作用。注射6周后,原发肿瘤的生长情况与对照组和CDR1as组有差异。裸鼠前腹皮下注射时,与对照组相比,肿瘤体积增大(图6A-B), CDR1as过表达时,肿瘤体积增大,体重减轻(图6C-D)。足垫注射小鼠腹股沟,CDR1as组淋巴结明显肿胀(图6E)。最后,作者做了“TGF-β信号通过CDR1as促进宫颈癌转移”的通路图(图7)。

图6 CDR1as在体内促进宫颈癌细胞的进展
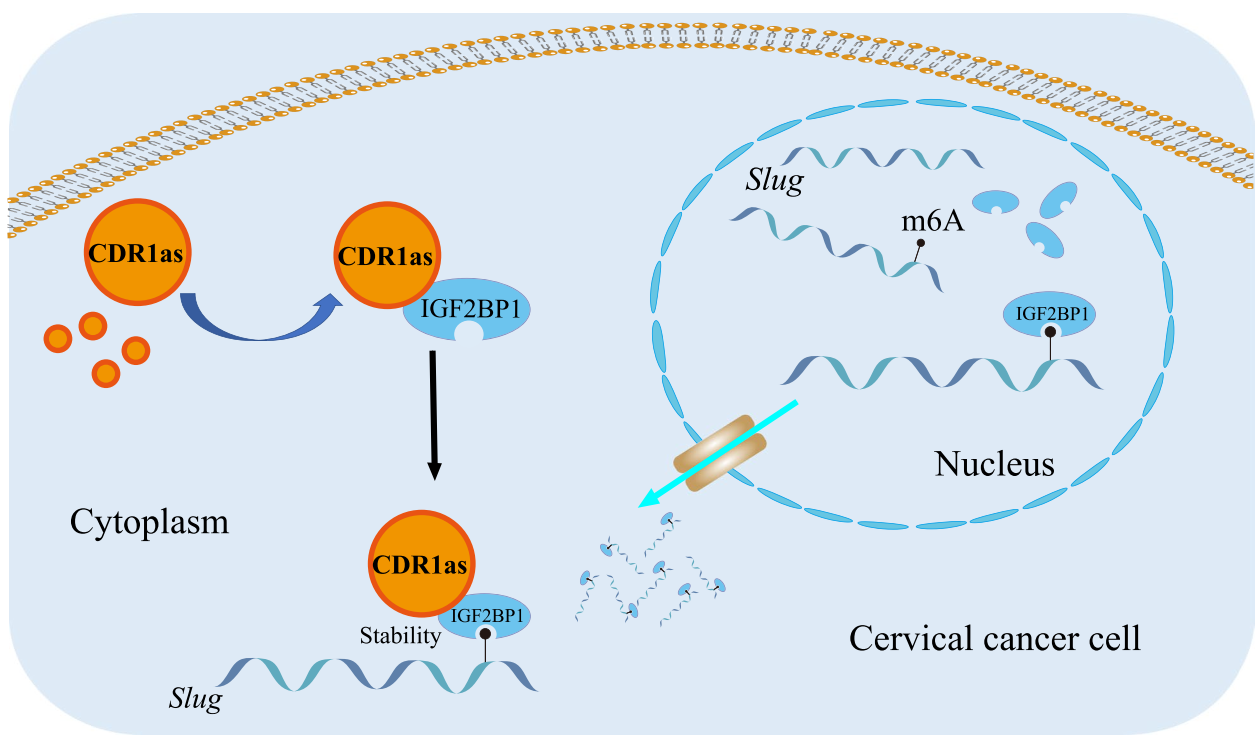
图7 “TGF-β信号通过CDR1as促进宫颈癌转移”信号通路
参考文献:
Zhong GL, Zhao Q, Chen ZL, Yao TT. TGF-β signaling promotes cervical cancer
metastasis via CDR1as. Molecular Cancer. 2023 March; 22(1):66. https://doi.org/10.1186/s12943-023-01743-9.






