除了滋养肌肤,胶原蛋白还能促进肝癌细胞的干细胞性
实验方法:HLF、Hep3B、SK-Hep1和HEK293 T细胞培养,Sphere Assay,克隆形成实验,流式细胞术分析,药物抵抗和IC50,质粒和慢病毒敲低小RNA,考马斯亮蓝染色,质谱,反转录PCR,RT-qPCR,免疫印迹,免疫共沉淀(co-IP),谷胱甘肽S转移酶(GST)pull-down,免疫荧光,共聚焦显微镜成像,荧光素酶报告基因实验,异种移植肿瘤形成,体内药物治疗,RNA-Seq
肿瘤干细胞(cancer stem cells,CSCs)是一小群具有干性和多向分化潜能的肿瘤细胞,导致肿瘤进展和治疗抵抗。然而,CSCs在肝细胞癌(HCC)中的具体作用机制尚不清楚。作者发现在晚期HCC组织中,胶原蛋白表达上调,与其受体DDR1的表达一致。因此,高胶原水平伴随DDR1高表达与HCC患者的不良预后相关。胶原诱导的DDR1活化增强了肝癌细胞在体外和体内的干性。机制上,DDR1与CD44相互作用,CD44作为共受体放大胶原诱导的DDR1信号,胶原- DDR1信号通过促进PP2AA募集到MST1来拮抗Hippo信号,导致YAP活化过度。DDR1和YAP联合抑制可协同抑制肝癌细胞的体外干性和体内成瘤性。基于T2加权图像的放射组学模型可以无创预测胶原表达。这些发现揭示了胶原- DDR1信号抑制Hippo信号的分子基础,并突出了CD44 / DDR1 / YAP轴在促进癌细胞干性中的作用,提示DDR1和YAP可能作为HCC新的预后生物标志物和治疗靶点。
技术路线:

主要研究结果:
1、高胶原蛋白I和DDR1水平预示HCC患者预后不良
为分析HCC肿瘤内胶原的类型,作者对HCC组织进行Picro-Sirius red染色。结果显示,Ⅰ型胶原占胶原的比例最高(图1A)。为探索Ⅰ型胶原在HCC中的临床意义,作者检测了123例具有相应临床病理特征的HCC组织芯片中Ⅰ型胶原的表达。与高分化HCC组织相比,Ⅰ型胶原在中分化HCC组织中高表达,在低分化组织中表达最高(图1B)。Kaplan-Meier分析显示,肿瘤中Ⅰ型胶原蛋白高表达的患者比Ⅰ型胶原蛋白低表达的患者具有更低的总生存率和更高的复发率(图1C)。Tumor sphere-forming assays显示胶原I促进HCC细胞干性的能力(图1D)。
为检测DDR1在HCC中的临床意义,作者分析了相同组织芯片和TCGA数据库中DDR1的水平。结果表明DDR1与Ⅰ型胶原呈正相关(图1E-F)。根据Ⅰ型胶原和DDR1表达情况,将患者分为三组Col1+DDR1+(n = 54)、Ⅰ型胶原/DDR1双高表达;Col1+DDR1-或Col1-DDR1+(n = 33),Ⅰ型胶原或DDR1单高表达;Col1-DDR1-(n = 36),Ⅰ型胶原/DDR1双低表达。与其他组相比,Col1+DDR1+组的总生存时间和无病生存时间最短(图1G)。总之,临床样本中Ⅰ型胶原和DDR1之间的关系表明,在HCC患者中,Ⅰ型胶原和DDR1的协同作用导致了较差的临床结果,可能在HCC的发生和发展中起着重要作用。
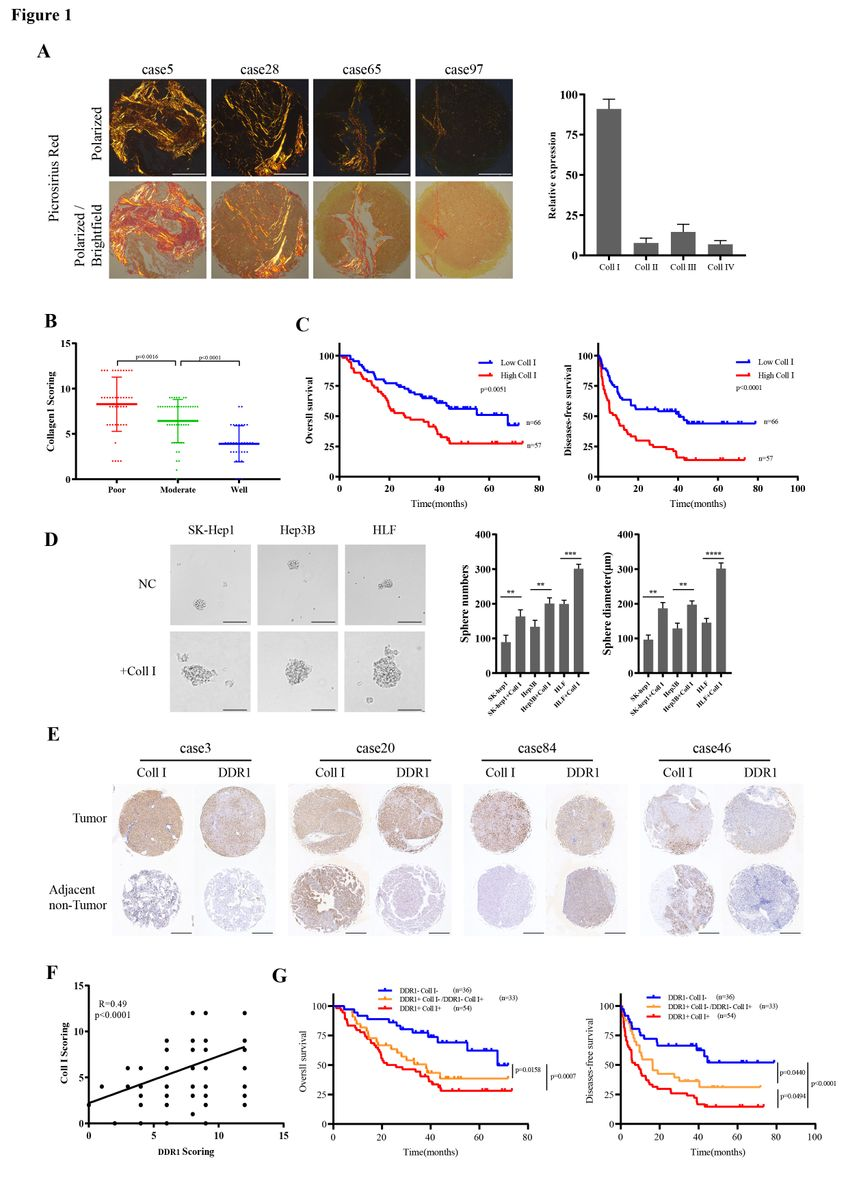
图1 I型胶原和DDR1在临床肝癌患者中的临床意义
2、胶原I-DDR1信号增强肿瘤干细胞特征
为验证体外DDR1对肝癌细胞干性的影响,作者进行sphere-forming assays。结果发现,与相应培养的贴壁细胞(non-CSCs)相比,DDR1蛋白水平在HCC球(CSCs)中显著上调(图2A)。DDR1作为维持干细胞自我更新潜能的关键转录因子和膜蛋白,过表达DDR1促进SOX2、NANOG和EPCAM的mRNA表达。I型胶原刺激进一步放大了这种效应。然而,过表达DDR1激酶死亡突变体(DDR1-K618A)和胶原结合缺陷突变体(DDR1-R105A)并没有达到这种效果。TCGA数据库中DDR1表达与CD133呈正相关,组织芯片的IHC验证了这一点(图2B-C)。此外,DDR1过表达或I型胶原刺激诱导球形成效率、CD133阳性细胞数、单细胞克隆形成和对sorafenib或doxorubicin的耐药性显著增加。相反,过表达DDR1-K618A和DDR1-R105A突变体未能表现出相同的结果。相比之下,DDR1缺失显著降低了这些CSC相关的生物学效应(图2D-G)。
在体内,作者使用异种移植模型来检测DDR1在肝癌细胞中的作用。DDR1敲低成球细胞形成的皮下瘤明显小于scramble细胞形成的皮下瘤(图3A)。IHC结果显示DDR1、Ki67和CD133的蛋白水平在乱序肿瘤中高于DDR1敲低肿瘤(图3B)。为进一步研究DDR1在肿瘤发生发展中的作用,作者通过皮下注射NOD/SCID小鼠细胞,在NOD/SCID小鼠细胞中加入或不加入上调的DDR1细胞进行有限稀释实验。DDR1过表达显著增强肿瘤形成能力,增加干细胞频率(图3C-E)。上述研究表明DDR1在体外和体内促进肝癌细胞干性和肿瘤发生,依赖于其激酶活性和胶原刺激。

图2 DDR1在体外增强HCC细胞系的干性
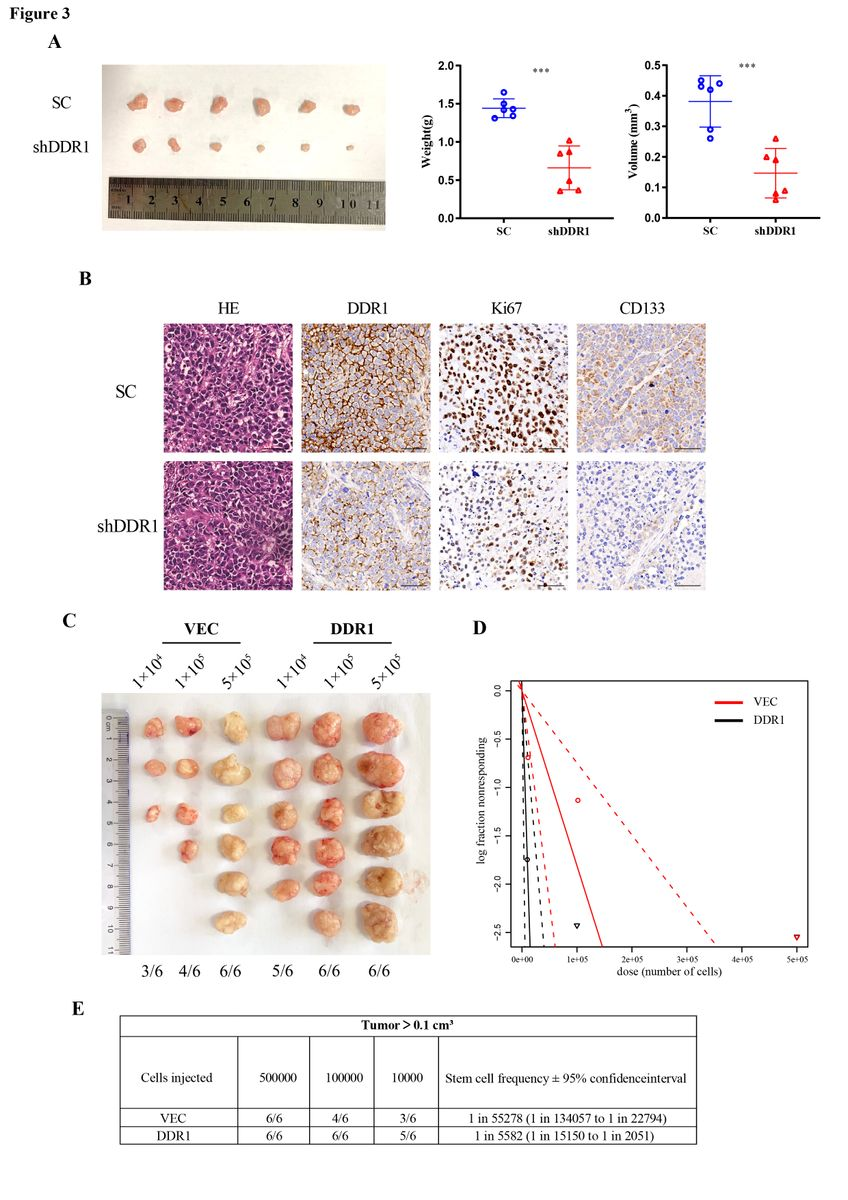
图3 DDR1在体内增强HCC细胞系的干性
3、胶原诱导的DDR1激活是由CD44协同促进的
为研究DDR1在肝细胞癌中的分子机制,作者使用IP/MS方法研究了其相互作用的伙伴。用FLAG-DDR1或FLAG-vector转染SK-Hep1细胞,用抗FLAG抗体免疫沉淀。作者发现CD44(CSCs标记物)是DDR1潜在的相互作用蛋白之一(图4A)。免疫共沉淀(Co-IP)和谷胱甘肽S -转移酶(GST) pull-down实验实验结果表明DDR1与CD44存在相互作用和结合(图4B-C)。此外,免疫荧光和激光共聚焦检测外源性DDR1和CD44在293T细胞中的空间共定位。在HLF细胞中观察到类似的内源性DDR1和CD44表达(图4D)。随后,作者进行了有/无I型胶原蛋白激活的co-IP实验,发现胶原蛋白I增加DDR1与CD44的相互作用(图4E)。由于CD44可以作为辅助受体介导受体内化、激活、降解或调节受体激酶活性,作者推测CD44是否可以调节I型胶原诱导的DDR1活化。Co-IP实验表明,CD44敲低降低了DDR1的酪氨酸磷酸化(图4F)。过表达CD44以时间依赖的方式促进Ⅰ型胶原诱导的DDR1的磷酸化。在HLF细胞中敲低DDR1则减弱这种作用(图4G)。结果提示CD44促进Ⅰ型胶原诱导的肝癌细胞DDR1的活化。CD44在肝癌中的功能是否依赖于DDR1,作者在CD44过表达的HLF细胞中敲低DDR1,在CD44敲低的Hep3B细胞中过表达DDR1。DDR1敲除部分降低了肝癌细胞的成球率、单细胞克隆形成率、CD133阳性的干细胞样细胞比例以及CD44过表达导致的化疗耐药。DDR1的过表达部分增强了I型胶原内CD44缺失所降低的CSCs特性(图5A-D)。CD44过表达细胞形成的皮下肿瘤的体积和重量明显大于空载体或CD44/shDDR1细胞形成的皮下肿瘤(图5E)。以上证据表明DDR1是CD44介导的肝癌细胞干性信号所必需的关键蛋白。

图4 CD44与DDR1相互作用,促进DDR1磷酸化
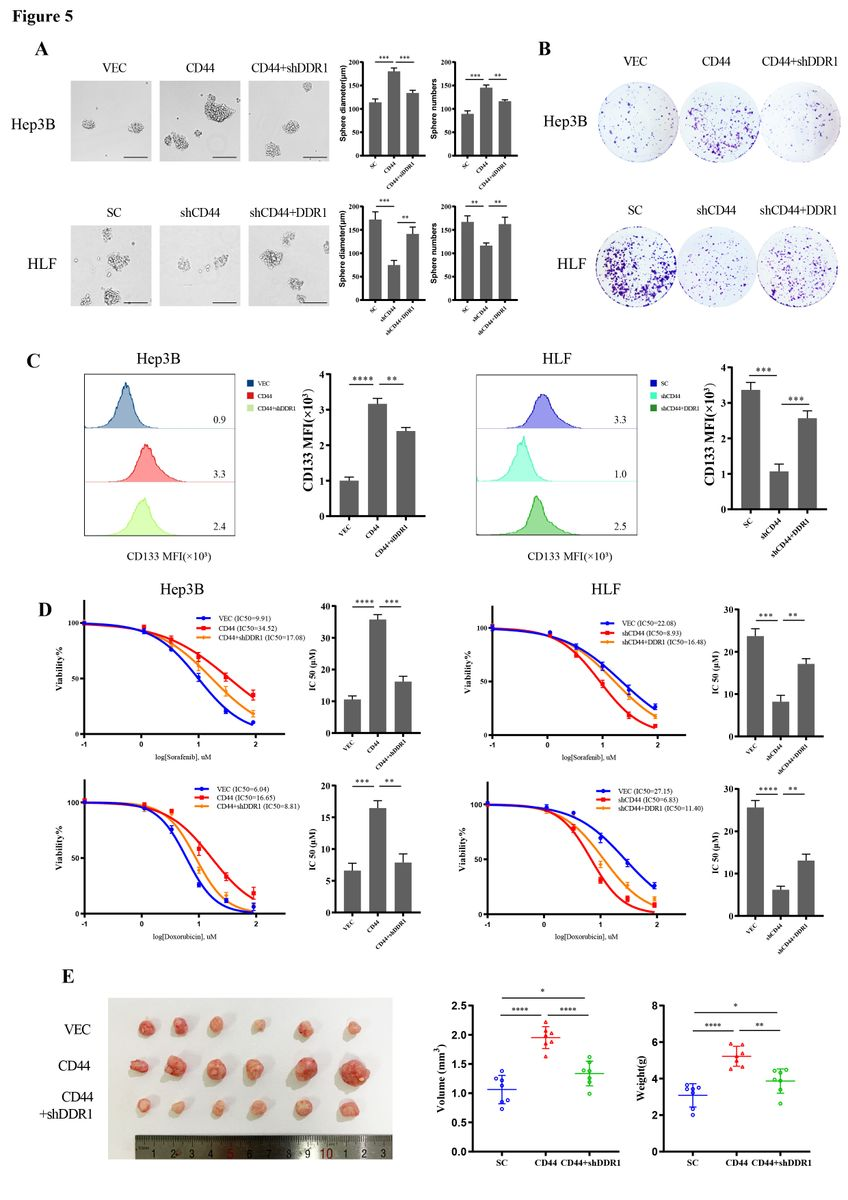
图5 体内外CD44与DDR1的交互作用增强了HCC细胞系的干细胞性
4、DDR1通过促进PP2AA募集到MST1/2而使Hippo信号失活
为确定DDR1影响HCC细胞干性的途径,作者对DDR1敲低的HCC细胞和对照细胞进行了RNA测序。KEGG通路分析发现DDR1缺失显著改变了Hippo信号通路(图6A)。基于TCGA数据库,DDR1与YAP、CTGF、BCL2、AXL呈正相关。Hippo信号与肿瘤干性密切相关,作者检测了DDR1对YAP/TAZ(Hippo通路核心蛋白)下游基因表达的影响。结果显示,在Hep3B细胞中过表达DDR1后,CTGF、CYR61、BCL2和AXL的mRNA水平上调。胶原蛋白I的存在进一步增强了这些作用。相反,DDR1敲低显著降低CTGF、CYR61、BCL2和AXL的表达(图6B)。双荧光素酶报告实验提示DDR1增强了Ⅰ型胶原中YAP/TEAD反应元件的活性(图6C)。核质分离和免疫荧光实验表明,DDR1过表达促进YAP易位进入细胞核(图6D-E)。Western blotting显示,I型胶原刺激的DDR1磷酸化降低了MST1磷酸化,增强了YAP的激活,而DDR1敲除则表现出相反的效果(图6F)。这些结果表明胶原I-DDR1信号通路可诱导YAP活化。
protein phosphatase 2 scaffold subunit A alpha(PP2AA; PPP2R1A)作为经典的上游磷酸酶,可以使MST1/2去磷酸化,从而使Hippo信号通路失活。作者分析了与DDR1相互作用的蛋白。PP2AA是DDR1潜在的相互作用蛋白(图4A)。募集实验表明DDR1以胶原依赖的方式促进PP2AA向MST1的募集(图6G)。PP2AA缺失减弱了胶原IDDR1信号诱导的MST1和LAST1去磷酸化,导致YAP激活(图6H)。这些结果表明,PP2AA是胶原I-DDR1信号诱导YAP活化所必需的。
在临床样本中,作者评估了39例HCC患者组织样本中p-DDR1、CD44和YAP蛋白水平。结果显示,肝癌组织中p-DDR1、CD44和YAP水平呈正相关(图6I)。基于I型胶原的IHC染色,将样本分为I型胶原阳性(Ⅰ型胶原+)和I型胶原阴性(Ⅰ型胶原-)表达组。作者随后进行了多色免疫荧光(IF)来分析这三种蛋白的共定位(图6J)。如上所述,在I型胶原沉积过程中,p-DDR1和CD44水平与YAP的表达密切相关。
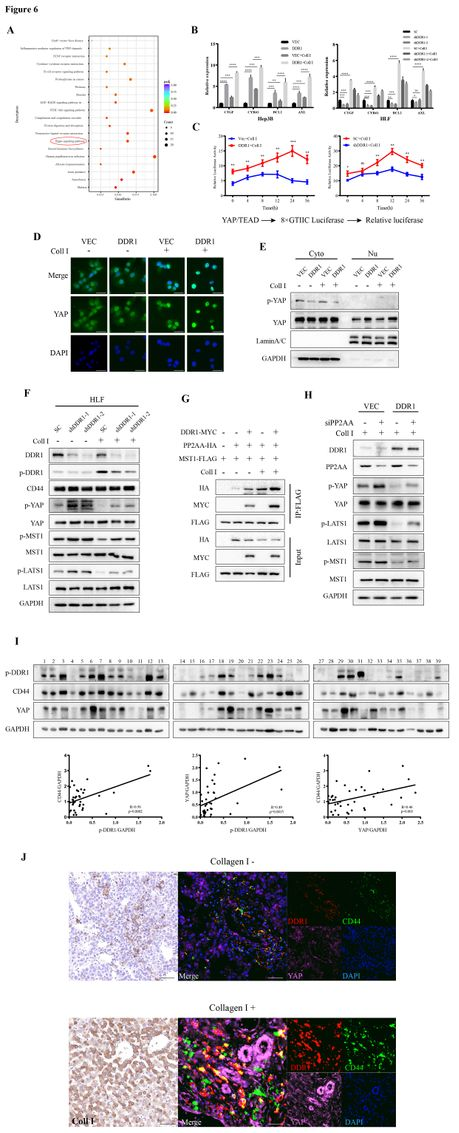
图6 DDR1通过灭活YAP阻碍Hippo信号传导
5、联合抑制DDR1和YAP在肝癌细胞干性中具有协同作用
为验证DDR1是否通过YAP发挥作用,作者使用DDR1抑制剂(7rh)和YAP抑制剂(verteporfin; VP)进行体外和体内实验。7rh是一种ATP竞争性口服DDR1特异性小分子抑制剂。Verteporfin(VP)是YAP/TAZ的抑制剂,在FDA批准的小分子化合物库中被鉴定,并被报道在空间上阻碍YAP和TEAD之间的相互作用。单独使用7rh或VP处理分别减少了成球效率、克隆形成和CD133 + 细胞比例的细胞数量,并减少了移植瘤的体积和重量。与单药相比,7rh和VP联合处理进一步减弱了这些效应(图7A-D)。IHC结果显示,与7rh或VP处理的肿瘤相比,Ki67和CD133在scrambled肿瘤中染色更强烈。联合组肿瘤中Ki67和CD133表达最低(图7E),联合治疗显示出良好的抗肿瘤治疗效果。
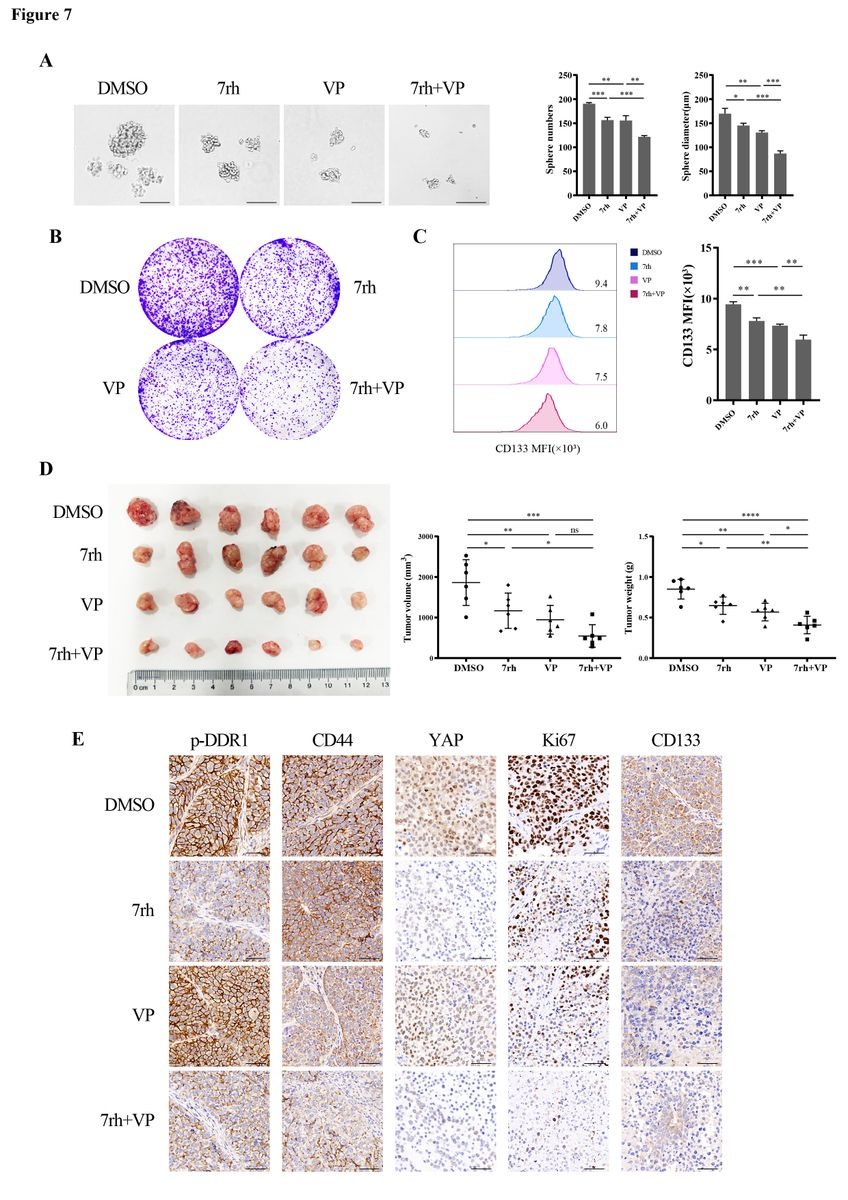
图7 DDR1和YAP信号共同抑制体外和体内肿瘤增殖
6、临床放射组学预测模型
在组织芯片的患者中,作者获得了92张T2WI图像,共有65例患者最终纳入本次回顾性研究。预测模型依赖于Ⅰ型胶原IHC评分。将患者分为高、低两组。采用受试者工作特征(ROC)曲线分析评估模型性能。结果显示,基于14个特征的模型在验证数据集上获得了最高的AUC(图8A)。此时,对于测试数据集,模型的AUC和预测精度分别为0.717和0.700。临床诊断统计及所选特征见图8B。
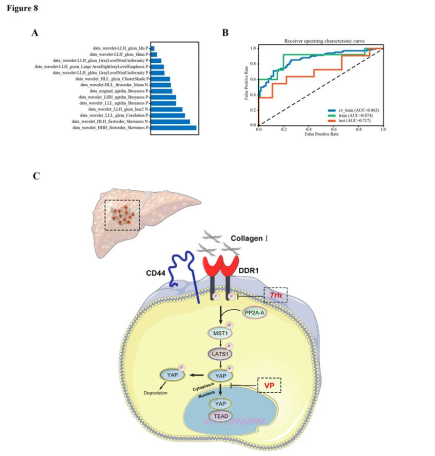
图8 预测胶原I表达的放射组学模型
结论
总之,本研究结果表明,CD44介导的胶原I-DDR1信号作为肿瘤激励因子,通过募集PP2AA激活YAP来促进HCC细胞的干细胞性。在HCC组织中,胶原I和DDR1表达的增加预示着预后不良,因此可以作为HCC有希望的生物标志物和新的治疗策略。
参考文献
Xiong YX, Zhang XC, Zhu JH, Zhang YX, Pan YL, Wu Y, Zhao JP, Liu JJ, Lu YX, Liang HF, Zhang ZG, Zhang WG.(2023). Collagen I-DDR1 signaling promotes hepatocellular carcinoma cell stemness via Hippo signaling repression. Cell Death Differ. doi: 10.1038/s41418-023-01166-5.






