多组学联合分析揭示胃癌中HER2的代谢异质性
栏目:最新研究动态
发布时间:2023-07-24
通过应用转录组学、蛋白质组学和代谢组学等多组学策略,构建了一种新的基于HER2相关代谢途径的胃癌人群分类方法......
实验方法:收集胃癌临床样本并进行非靶向代谢组学分析,生信分析转录组测序数(>10000泛癌样本)和蛋白组数据(392例胃癌样本)。
目前可用的预后工具和重点治疗方法导致胃癌(GC)的治疗不尽人意。深入了解HER2协同表达的代谢途径可能为肿瘤内在的精准医疗提供新的见解。本研究应用转录组学、蛋白质组学和代谢组学等多组学策略,构建了一种新的基于HER2相关代谢途径的胃癌人群分类方法。
技术路线:

主要实验结果:
1、泛癌中ERBB2的综合特征突出了它在肿瘤微环境中的关键作用
本文主要强调ERBB2表达与GC之间的密切联系,特别是在免疫和代谢性状方面。TCGA数据库ERBB2 mRNA水平在包括GC在内的大多数恶性肿瘤中显著升高(图1A-B),并且较长的无病间隔期与ERBB2表达的上调密切相关(图1C-G)。此外,G3和G4胃癌患者的ERBB2表达低于G1和G2胃癌患者,这表明ERBB2表达较低与胃癌患者预后较差有关;尽管ERBB2表达与GC的分期和复发之间没有明显的相关性,但ERBB2被认为是免疫微环境和GC代谢重塑的关键调节因子(图2A-B)。此外,ERBB2的表达与胃癌中许多典型的免疫通路,如抗原处理和呈递、细胞因子受体相互作用、趋化因子信号通路、自然杀伤(NK)细胞介导的细胞毒性和toll样受体信号通路呈负相关(图2A)。然而,ERBB2的表达与GC中许多典型的代谢途径正相关,如硫代谢、鞘脂类代谢、组氨酸代谢、糖酵解/糖异生(GG)代谢、甘油磷脂代谢和丙氨酸、天门冬氨酸和谷氨酸(AAG)代谢(图2B)。
1、泛癌中ERBB2的综合特征突出了它在肿瘤微环境中的关键作用
本文主要强调ERBB2表达与GC之间的密切联系,特别是在免疫和代谢性状方面。TCGA数据库ERBB2 mRNA水平在包括GC在内的大多数恶性肿瘤中显著升高(图1A-B),并且较长的无病间隔期与ERBB2表达的上调密切相关(图1C-G)。此外,G3和G4胃癌患者的ERBB2表达低于G1和G2胃癌患者,这表明ERBB2表达较低与胃癌患者预后较差有关;尽管ERBB2表达与GC的分期和复发之间没有明显的相关性,但ERBB2被认为是免疫微环境和GC代谢重塑的关键调节因子(图2A-B)。此外,ERBB2的表达与胃癌中许多典型的免疫通路,如抗原处理和呈递、细胞因子受体相互作用、趋化因子信号通路、自然杀伤(NK)细胞介导的细胞毒性和toll样受体信号通路呈负相关(图2A)。然而,ERBB2的表达与GC中许多典型的代谢途径正相关,如硫代谢、鞘脂类代谢、组氨酸代谢、糖酵解/糖异生(GG)代谢、甘油磷脂代谢和丙氨酸、天门冬氨酸和谷氨酸(AAG)代谢(图2B)。
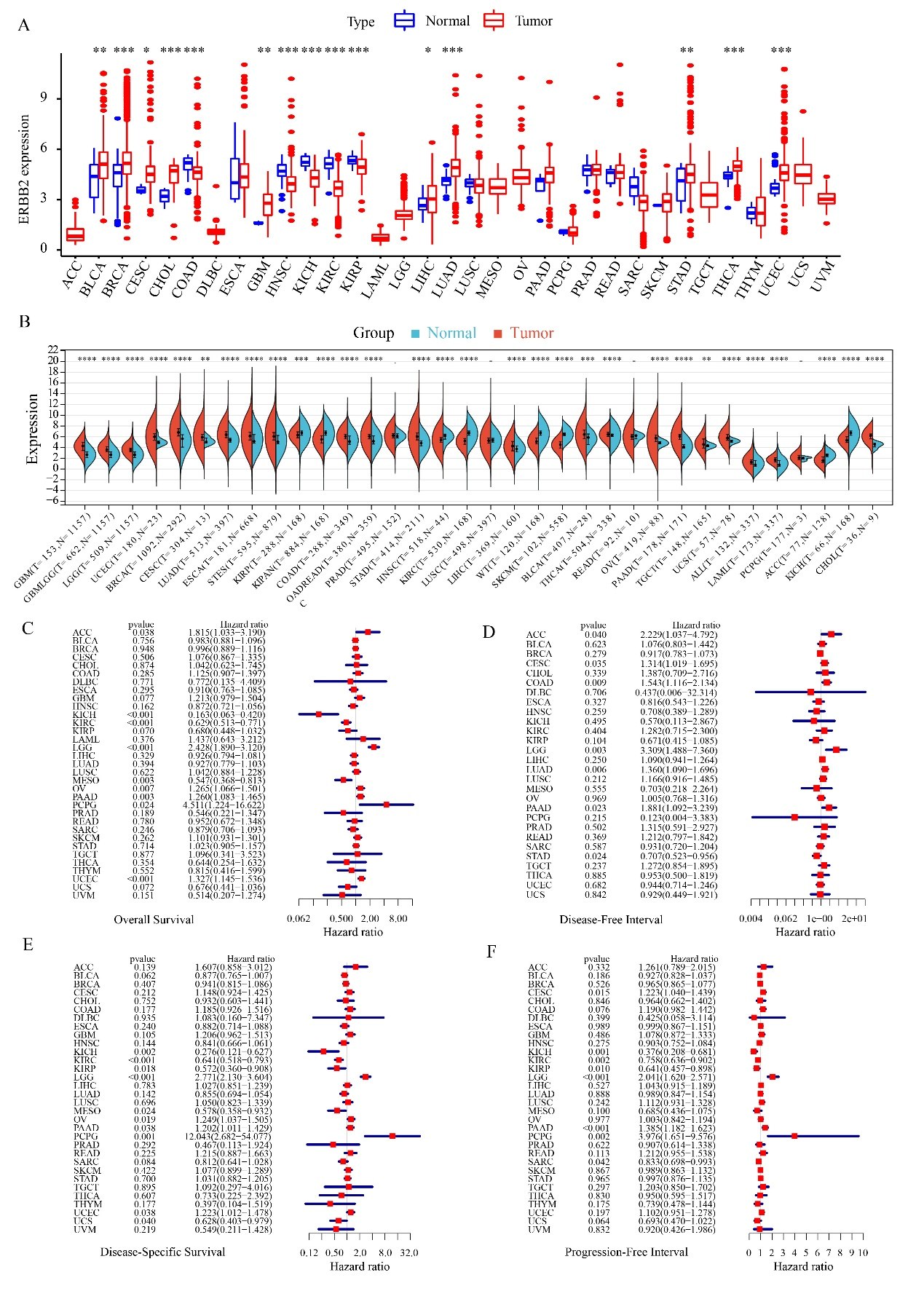
图1 ERBB2在泛癌中的表达
2、转录组和蛋白质组分析显示ERBB2和HER-2与胃癌患者的免疫状态和代谢特征显著相关
基于TCGA-STAD和TCPA-STAD队列,整合了胃癌患者的转录组和蛋白质组表达谱,使用ssGSEA算法计算每例患者的免疫细胞浸润(ICI)丰度和免疫功能评分。Spearman相关分析显示,ERBB2基因及其蛋白产物HER2与胃癌患者的免疫状态存在显著的负调控关系(图2C-D)。此外,利用MsigDB对经典的免疫和代谢通路进行了鉴定。系统的分析了胃癌中ERBB2与这些免疫和代谢通路调节之间的复杂关系(图2E-F)。ERBB2参与GC中多种免疫途径的调控,包括抗原提呈、T细胞和b细胞受体信号通路、细胞周期、趋化因子信号通路、细胞因子相互作用、NK细胞介导的细胞毒性、转化生长因子β信号通路和toll样受体信号通路(图2E)。此外,ERBB2在GC的代谢途径中起着关键作用,包括AAG、α -亚麻酸、精氨酸和脯氨酸、谷胱甘肽、甘油脂、组氨酸、嘧啶和GG代谢(图2F)。
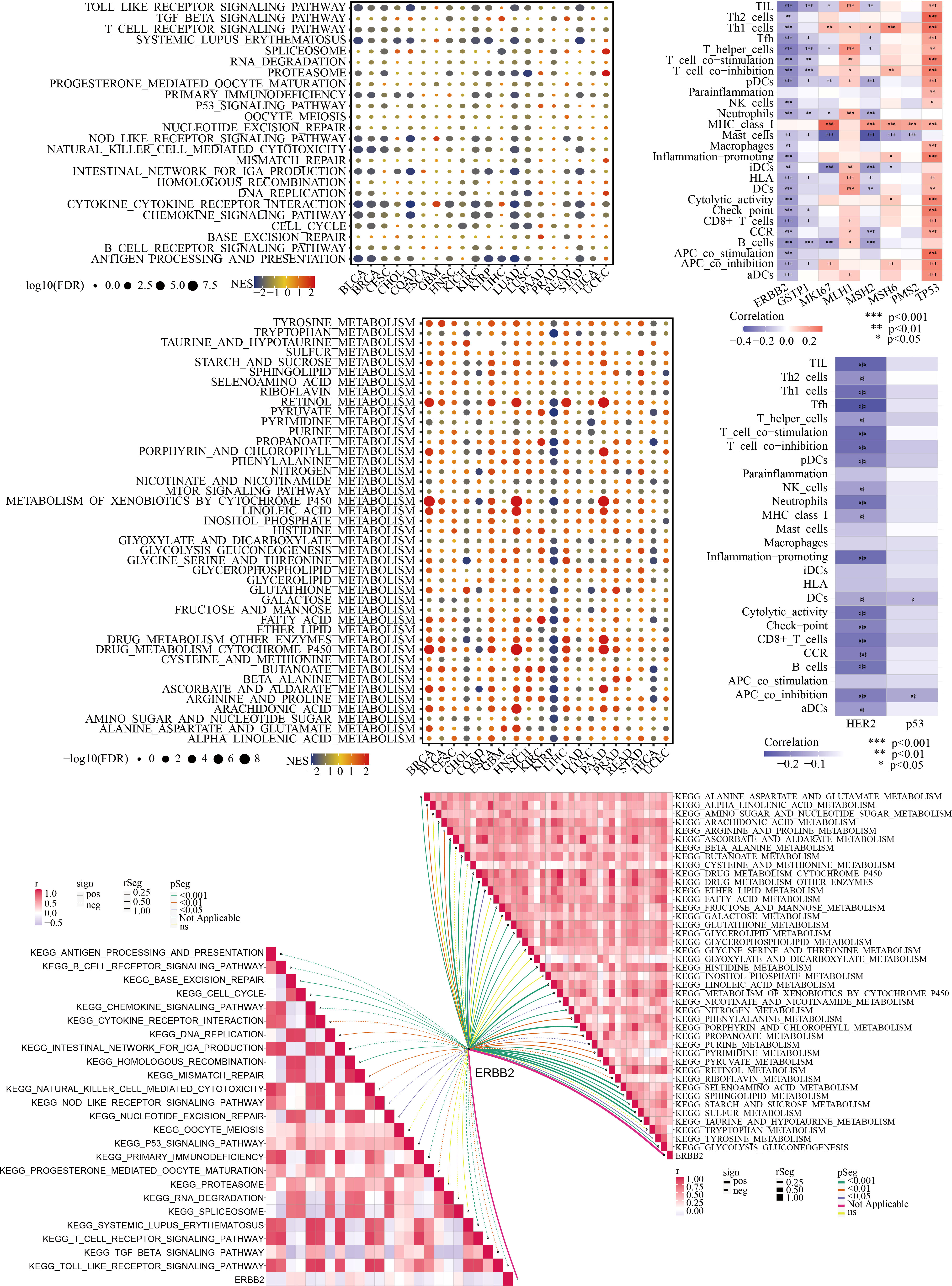
图2 ERBB2/HER2与泛癌(尤其是胃癌)免疫微环境及代谢重塑的关系
3、胃癌肿瘤发生过程中的代谢景观变化
使用112名GC患者和健康人的血液样本,质谱鉴定了1284种代谢物,其中丰度显著差异的代谢物有859个,在GC中上调的有129个,下调的730个(图3A)。其中,许多氨基酸在肿瘤中高表达且含量丰富,包括l-胱氨酸、n -乙酰谷氨酸、n -乙酰- l-丙氨酸和l-天冬氨酸。
对代谢物进行WMCNA分析,获得24个代谢物模块。light cyan、midnight blue和black模块与HER2表达显著相关,根据即MM > 0.7和MES > 0.15,在这三个模块中鉴定出34个高连接代谢产物并进行进一步分析。这34种代谢物在不同HER2表达亚群中的表达分布和51个GC样本的临床特征如图3B所示。采用Pearson相关分析建立MMI网络,突出上述34种HER2共表达代谢物的重要作用(图3C)。这些代谢物进一步提交到MetaboAnalyst 5.0和MBROLE 2.0平台,以识别与HER2表达密切相关的潜在代谢途径,结果显示糖酵解/糖异生(GG)和丙氨酸-天冬氨酸-谷氨酸(AAG)代谢与HER2表达密切相关(图3D-E)。GG代谢与AAG代谢的详细关联见图3F。
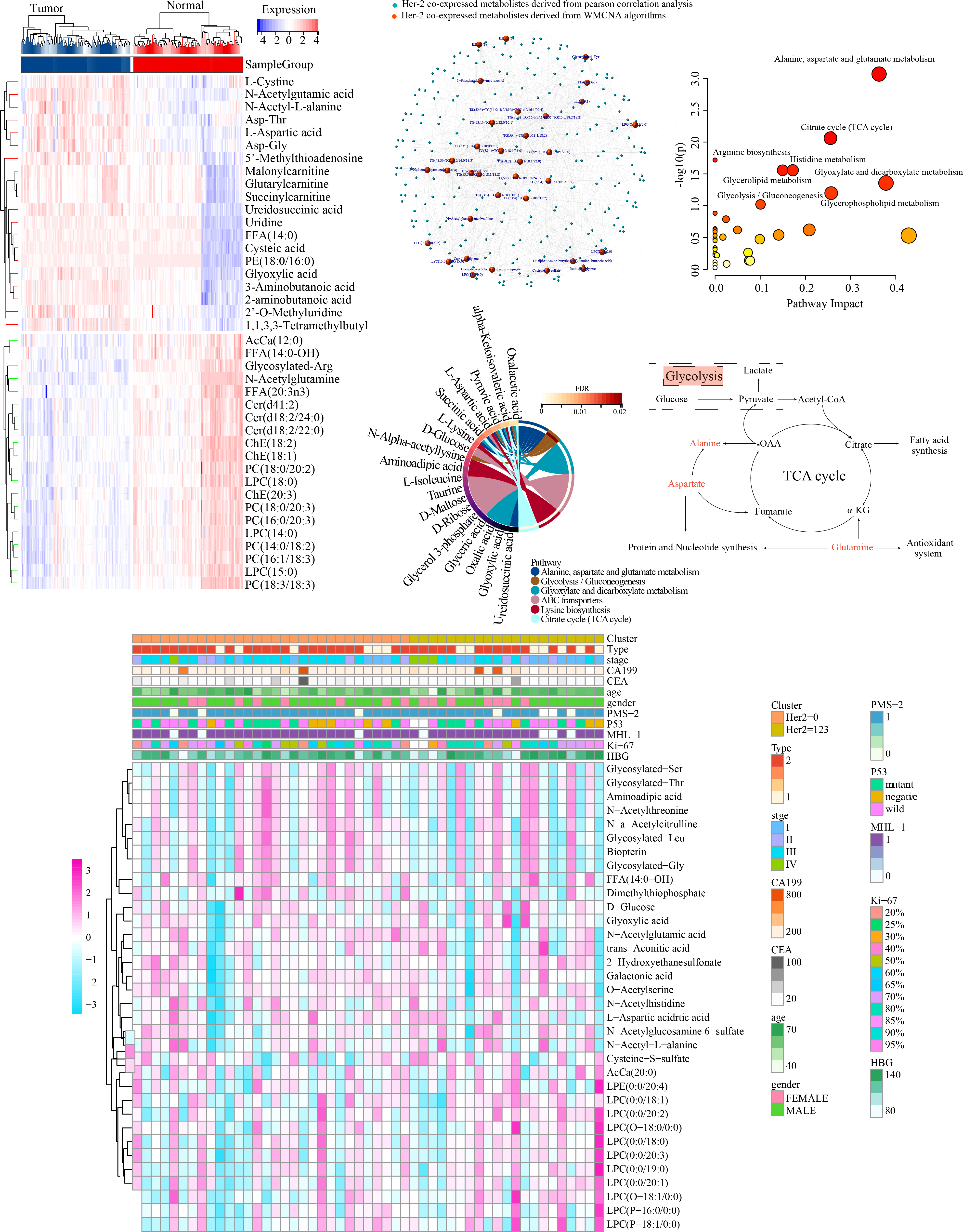
图3 GC代谢图的特征和HER2共表达代谢物的鉴定
4、GG和AAG代谢相关基因表达的双重分析确定GC的四个不同代谢亚群
根据AAG和GG代谢相关基因的表达谱对GC进行分类。计算每个样本中共表达GG和AAG代谢相关基因的中位表达水平,并用于指定与这两种途径特别相关的四种代谢谱:静态、GG、AAG和混合亚型(图4A)。GG和AAG代谢相关基因在代谢亚群中的表达谱如图4B所示。总生存期和疾病特异性生存期分析显示,四个代谢亚组的预后差异显著,说明代谢亚型的分类具有临床意义(图4C-D)。GG代谢亚型ERBB2表达低于其他三种亚型(图4E)。为确定新建立的代谢亚型的表达模式是否可以作为之前众所周知的免疫亚型之间差异的基础,研究了队列中每个样本的各种GC免疫亚型。如图4F描述了不同代谢亚型之间肿瘤分期和分级的分布。GG亚型中炎症表型的比例较高,这可能是其不良预后的原因之一。
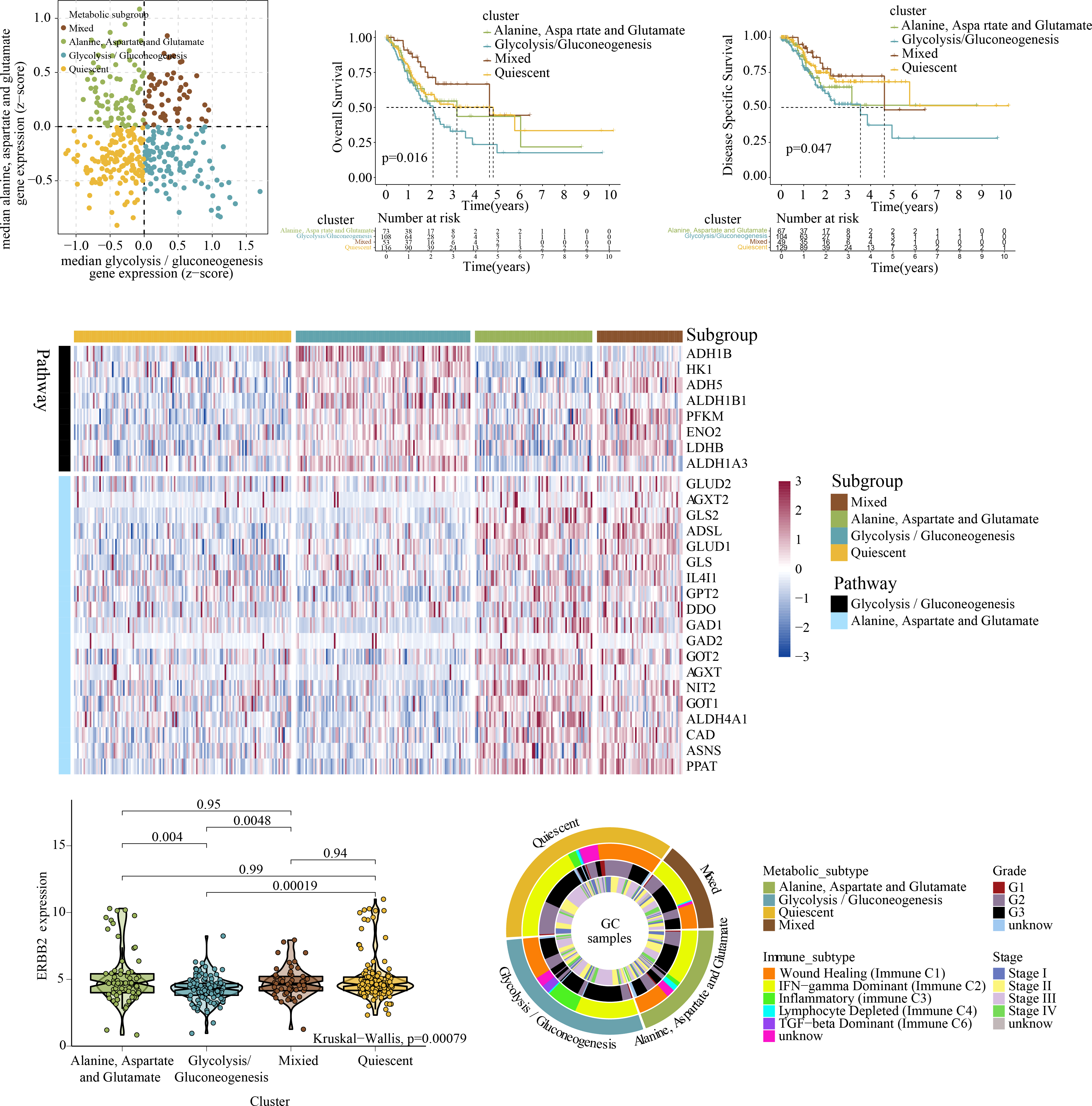
图4基于丙氨酸-天冬氨酸-谷氨酸和糖酵解/糖异生代谢相关基因表达的GC代谢亚型分类
5、不同代谢亚型的特定分子功能和肿瘤免疫微环境
基于GG和AAG建立的4个亚型之间的突变和基因表达谱具有显著差异,并且不同代谢亚型的特定分子的功能注释也存在显著差异,如图5A所示,不同圆圈表示的不同亚型的功能有较大差异。为进一步检查肿瘤微环境中免疫细胞浸润的丰度,使用各种算法来估计不同代谢亚型的ICI水平。ESTIMATE和ImmuneCellAI算法均显示GG亚型检测到较高的ICI评分(图5B-C)。同样,其他ICI评估算法(如TIMER、CIBERSORT、QUANTISEQ、MCPCOUNTER、XCEL和EPIC)表明,GG亚型中参与固有和适应性免疫应答的细胞(包括巨噬细胞、CD8+ T细胞、CD4+ T细胞和B细胞)的浸润显著较高(图5D)。此外,GG亚型的免疫检查点基因表达水平较高(图5E)。GG亚型免疫细胞的高浸润可能是局部免疫功能被检查点抑制的一种代偿现象,这可能是GG亚型预后不良的原因。

图5系统分析不同代谢亚型的特异性分子功能和肿瘤免疫微环境
6、靶向药物敏感性分析及免疫治疗预测
代谢重塑对预测化疗反应有深远的影响。使用R软件包确定每个样本的流行化疗药物和靶向药物的IC50值。如图6A所示,GG亚型对波那提尼(p<2.2e-16)、贝沙罗汀(p=6.3e-15)、二甲基草酰甘氨酸(p<2.2e-16)、匹克替尼(p<2.2e-16)、伊马替尼(p=1e-09)、帕唑帕尼(p=2.4e-13)、PD173074(p = 1.4e-13)、克唑替尼(p = 4.5e-10)和舒尼替尼(p = 1.6e-09),表明该亚型的患者可能对这些化疗药物极为敏感。然而,混合亚型患者对顺铂(p = 0.015)、多柔比星(p = 1.6e-12)、埃博霉素B(p = 3.1e-07)、吉西他滨(p = 1.7e-12)、甲磺酸奥巴妥(p = 1.2e-10)和替菲尼(p = 3.5e-06)更为敏感(图6B)。
如图6C所示,使用ImmuneCellAI进行的分析表明,静止型和AAG亚型具有更有利的免疫治疗反应,这表明具有这些亚型的GC患者可能从免疫检查点阻断治疗中获益。同样,使用TIDE进行的分析表明,静止型和AAG亚型的排除分数较低,表明具有这些亚型的GC患者不太可能抵抗免疫治疗(图6D)。此外,使用TCIA进行的分析显示,PD-1阻断、CTLA4阻断和联合阻断可能对静止型亚型的患者更有利(图6E-G)。
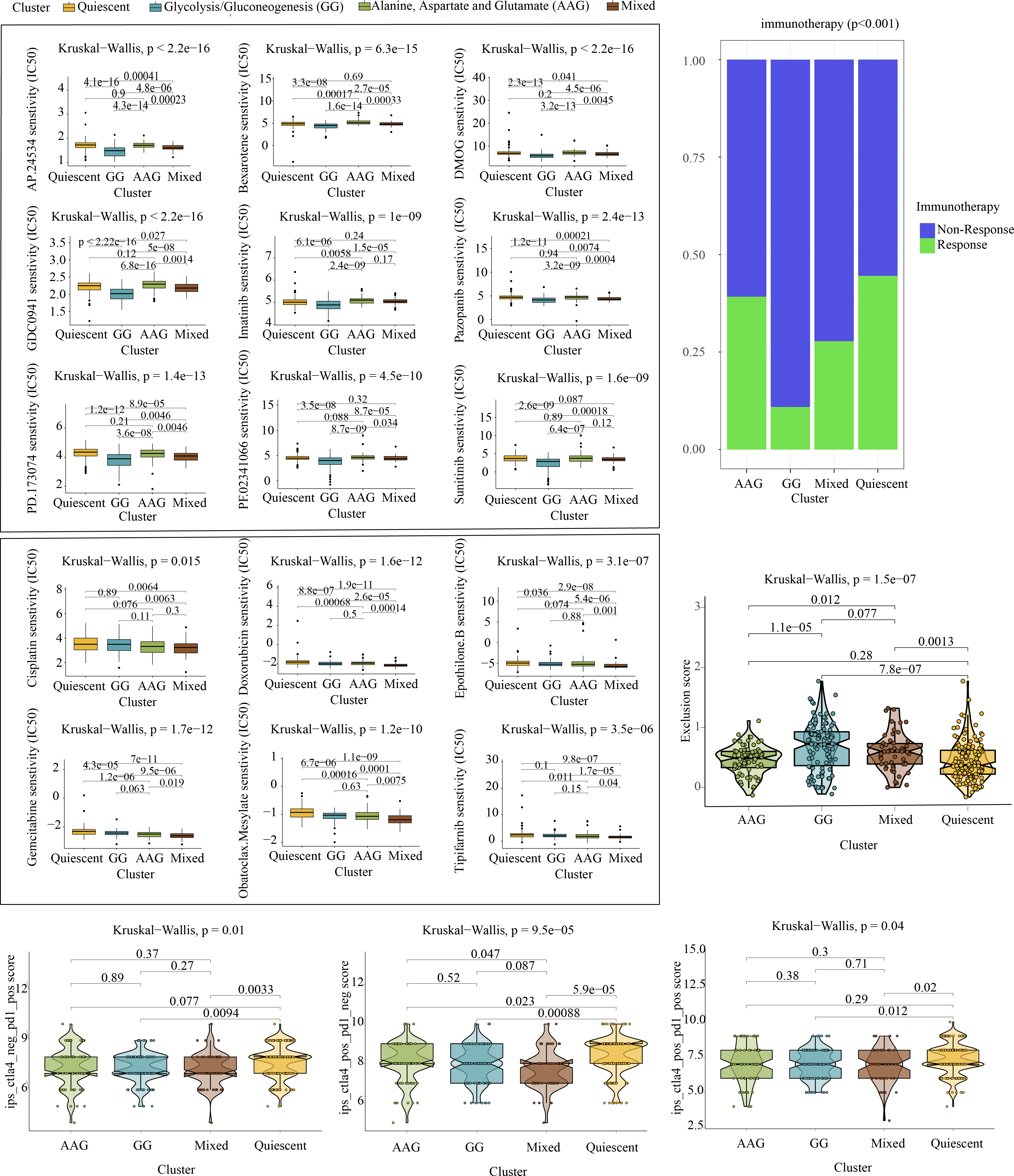
图6化疗预测和免疫治疗反应评估
总之,转录组和蛋白质组分析强调HER2水平与GC患者的免疫状态和代谢特征密切相关。代谢组学分析强调了AAG以及GG代谢与GC的HER2水平之间的共同表达关系。采用的多组学整合策略,根据HER2相关的代谢途径,成功确定了四种具有不同代谢特征的GC人群。GG亚型的特点是ERBB2表达较低,炎症程度较高,预后较差。混合亚型具有相反的特征,预后最好。GG和混合亚型对化疗高度敏感,而静止期和AAG亚型更可能从免疫检查点抑制剂中获益。
参考文献:
Yuan Q, Deng D, Pan C, Ren J, Wei T, Wu Z, Zhang B, Li S, Yin P, Shang D. Integration of transcriptomics, proteomics, and metabolomics data to reveal HER2-associated metabolic heterogeneity in gastric cancer with response to immunotherapy and neoadjuvant chemotherapy. Front Immunol. 2022 Aug 4;13:951137. doi: 10.3389/fimmu.2022.951137. PMID: 35990657;






