腹膜高脂肪环境通过激活NSUN2介导的ORAI2 m5C修饰促进胃癌细胞腹膜转移
腹膜转移(PM)是胃癌(GC)的重要转移方式。它与预后不良有关。PM的潜在分子机制仍然难以捉摸。m5C是一种转录后RNA修饰,参与许多肿瘤的进展。然而,其在GC腹膜转移中的作用尚不清楚。在我们的研究中,转录组结果表明NSUN2在PM中的表达显著上调。PM NSUN2高表达的患者预后较差。机制上,NSUN2通过m5C修饰调控ORAI2 mRNA的稳定性,从而促进ORAI2的表达,进而促进胃癌的腹膜转移和定植。YBX1通过与ORAI2 m5C修饰位点结合,起到“阅读器”的作用。GC细胞摄取网膜脂肪细胞中的脂肪酸后,转录因子E2F1上调,进而通过顺式元件促进NSUN2的表达。总之,这些结果揭示了腹膜脂肪细胞为GC细胞提供脂肪酸,从而通过AMPK通路促进E2F1和NSUN2的升高,上调的NSUN2通过m5C修饰激活关键基因ORAI2,从而促进GC的腹膜转移和定植。本文于2023年5月发表于Oncogene(IF= 8.756)上。
技术路线

结果:
1)NSUN2在GC腹膜转移中高表达,并与GC腹膜转移相关
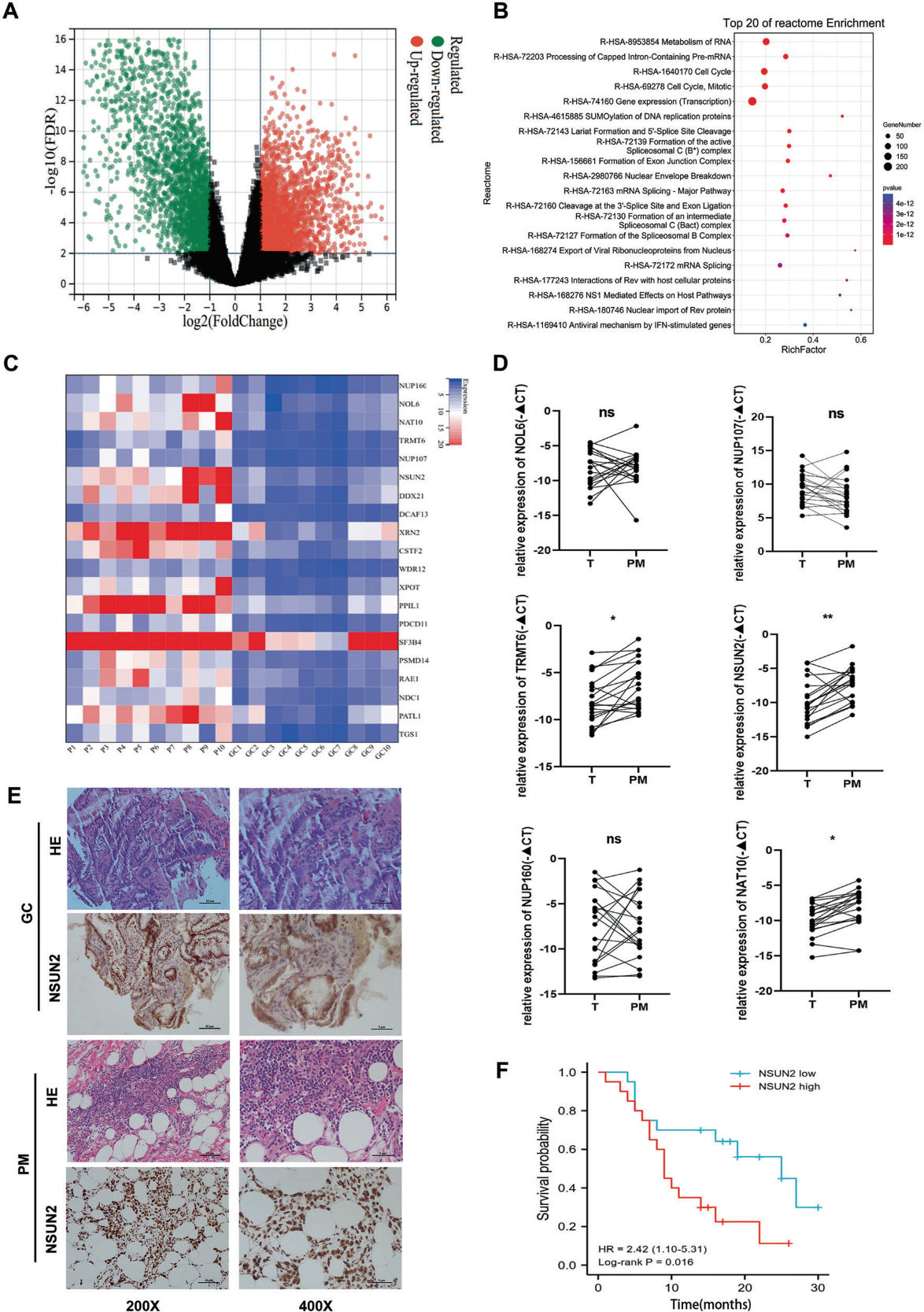
为了探索胃癌腹膜转移的潜在分子机制,我们通过高通量测序分析,在10对腹膜转移组织和相应的原发肿瘤组织中测量mRNA表达水平(图1A)。取TCGA中胃腺癌数据和腹膜转移转录组测序数据的交集,得到2078个差异表达基因。然后根据这些差异表达基因进行Reactome富集分析。有趣的是,这些高表达基因在RNA代谢途径中显著富集(图1B),这表明胃癌腹膜转移的RNA表达谱与原发肿瘤有明显不同。然后通过qPCR验证腹膜转移转录组测序数据中RNA代谢途径中差异表达最显著的基因NOL6、NUP107、NUP160、TRMT6、NAT10和NSUN2的表达情况(图1C)。NSUN2在20对胃癌组织及相应腹膜转移组织中的mRNA表达差异最为显著(图1D)。10对胃癌腹膜转移组织及匹配的胃癌组织的免疫组化染色也表明NSUN2在胃癌腹膜转移中高表达(图1E)。生存分析表明,腹膜转移中NSUN2高表达的患者预后较差(图1F)。这些结果显示NSUN2在胃癌腹膜转移中高表达并与不良预后相关,提示NSUN2可能在胃癌腹膜转移中起重要作用。
2)NSUN2在体外促进GC恶性生物学行为
为了确定NSUN2与胃癌腹膜转移的关系,我们选择了具有高转移能力的胃癌细胞株HGC-27和MKN-45进行进一步的实验。集落形成、CCK8实验显示,sh-NSUN2显著降低GC细胞的增殖能力。此外,oe-NSUN2增加了GC细胞的能力(图2A, B)。接下来,伤口愈合实验和Transwell实验表明,敲低NSUN2分别抑制了GC细胞的迁移和侵袭。相反,过表达NSUN2可促进GC细胞迁移和侵袭(图2C-E)。下调NSUN2抑制GC细胞粘附腹膜间充质细胞系HMrSV5的能力,当NSUN2过表达时,GC细胞粘附腹膜间充质细胞的数量增加(图2F)。综上所述,这些结果表明NSUN2在体外胃癌细胞的腹膜转移和增殖中发挥了重要作用。

3)转录因子E2F1在GC细胞中促进NSUN2的表达
我们寻找可能导致NSUN2在胃癌腹膜转移中过表达的关键上游调控分子。通过筛选JASPAR数据库,promo数据库和腹膜转移转录组测序数据,我们发现转录因子TFAP2B和E2F1可能参与调节NSUN2表达(图3A)。此外,TCGA还显示,NSUN2与E2F1和TFAP2B呈正相关 (图3B)。然后我们通过qPCR、western blot验证转录因子E2F1可以调控NSUN2的表达,而转录因子TFAP2B不能影响NSUN2的表达(图3D、E)。从图3F可以看出,NSUN2和E2F1主要定位于细胞核,在HGC-27和MKN-45细胞系中,沉默转录因子E2F1后,NSUN2的表达水平降低。这些结果验证了E2F1能够调控NSUN2的表达。通过筛选JASPAR数据库,我们发现转录因子E2F1在NSUN2启动子序列中有3个结合位点。为了进一步研究转录因子E2F1是否可以直接结合NSUN2的启动子序列,我们对JASPAR评分最高的序列(−623~−613)进行了CHIP-qPCR验证。CHIP-qPCR结果验证了我们的假设,即转录因子E2F1可以通过结合预测的顺式元件直接激活NSUN2的表达(图3G)。荧光素酶测定表明,与野生型NSUN2启动子序列相比,NSUN2启动子序列突变体显著抑制了转录活性(图3H-I)。综上所述,这些结果证明E2F1可以作为转录因子促进NSUN2的表达。

4)腹膜高脂环境通过AMPK途径激活转录因子E2F1
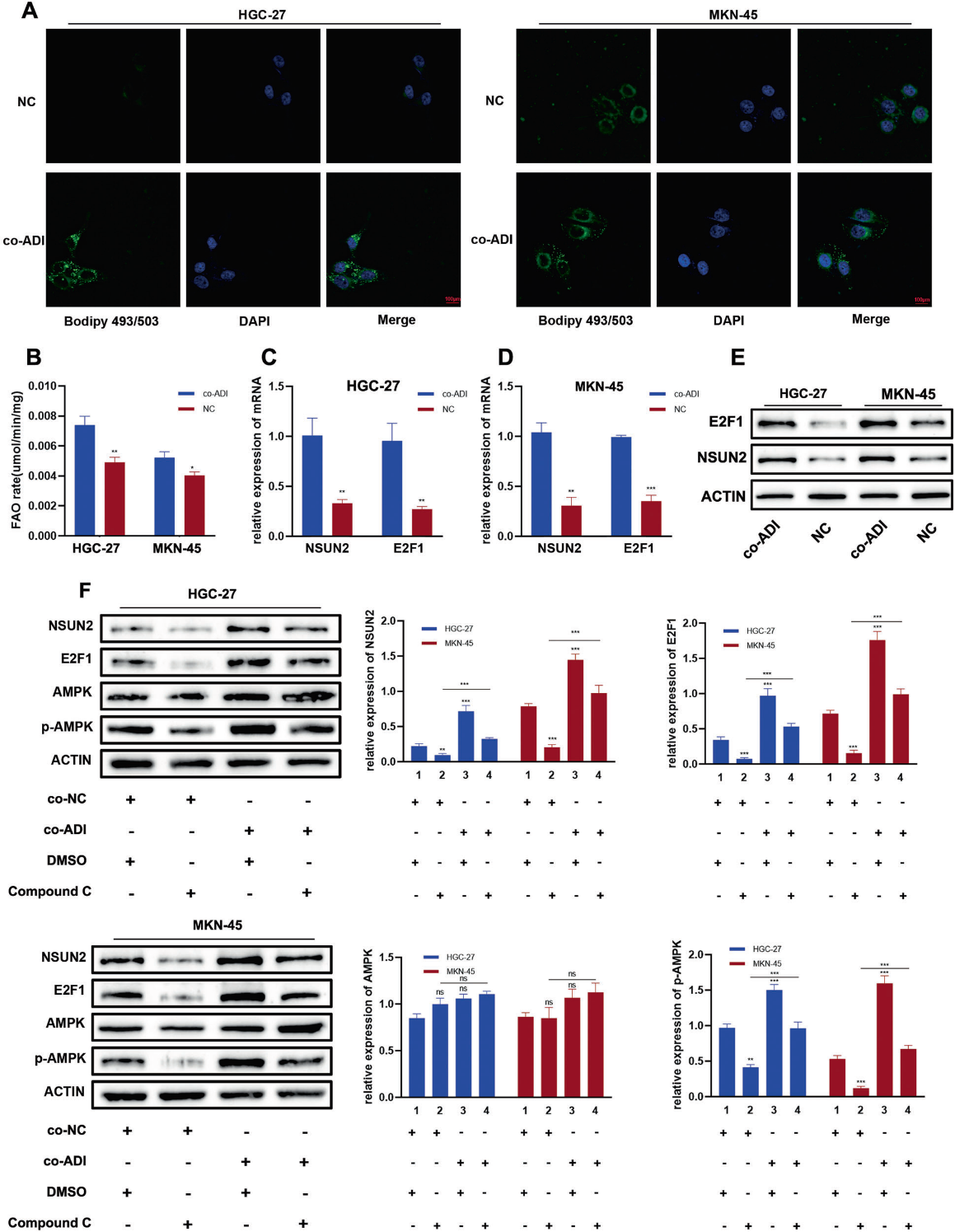
为了研究腹膜脂肪细胞是否通过激活胃癌细胞AMPK通路调控转录因子E2F1,我们从胃癌根治手术患者的网膜组织中提取脂肪细胞。与网膜脂肪细胞共培养48小时后,我们发现胃癌细胞系HGC-27和MKN-45的脂质沉积和β-氧化率增加(图4A, B),伴随着转录因子E2F1及其靶基因NSUN2升高(图4C-E)。在共培养体系中加入AMPK通路抑制剂Dorsomorphin,与脂肪细胞共培养后,转录因子E2F1和靶基因NSUN2的过表达得到部分减弱(图4F)。总之,我们发现网膜脂肪细胞为腹膜转移性胃癌细胞提供脂肪酸,通过激活AMPK通路,进一步促进转录因子E2F1的表达,从而上调NSUN2的表达。
5)NSUN2介导的ORAI2的m5C修饰维持了其稳定性
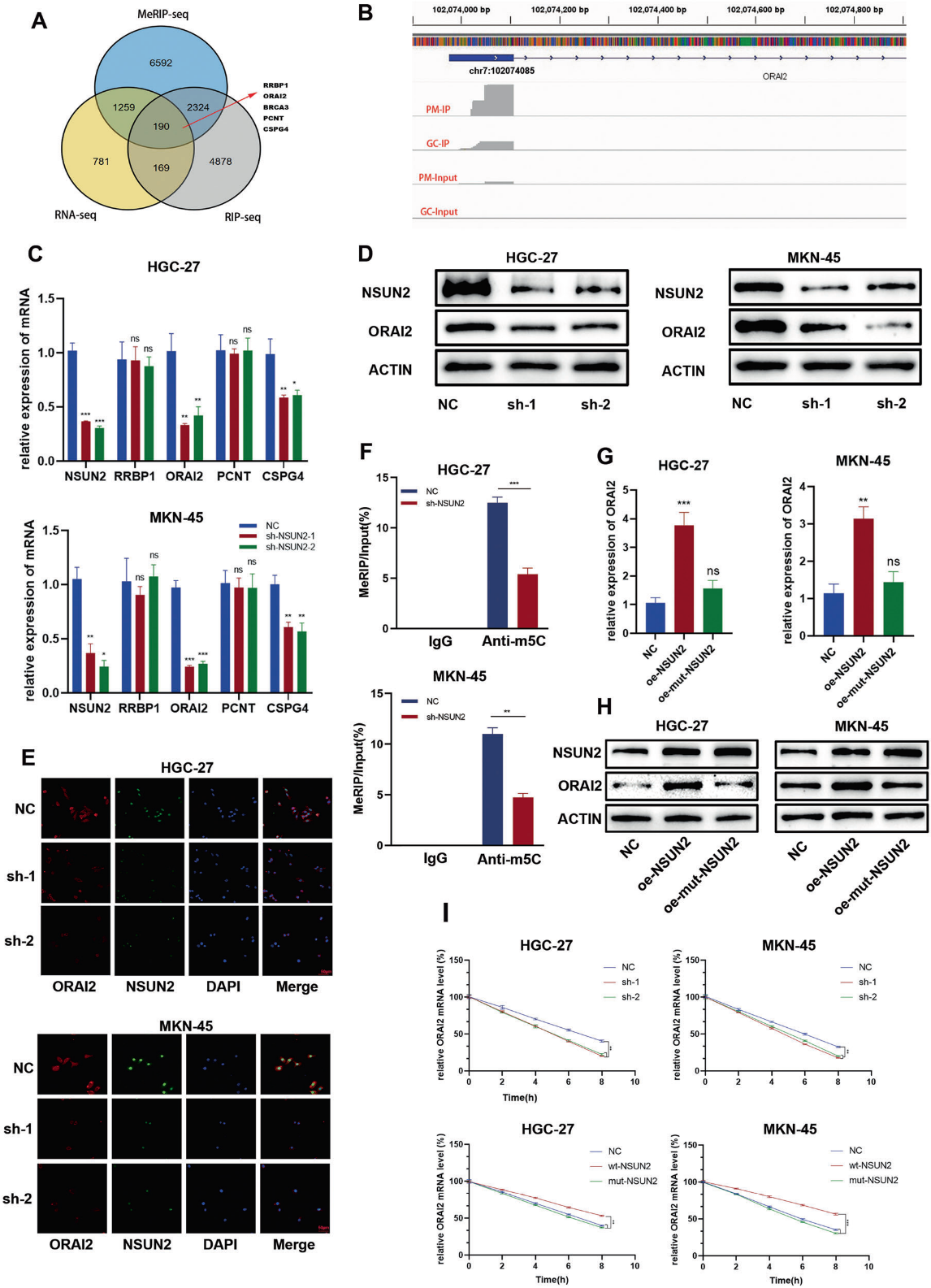
为了进一步确定NSUN2是否通过m5C促进GC的恶性生物学行为,将MeRIP-seq、RNA测序(RNA-seq)和HGC-27细胞中NSUN2介导的RNA免疫沉淀测序(RIP-seq)进行交叉分析(图5A、B),选择RNA-seq中差异表达最显著的4个靶基因(RRBP1、ORAI2、PCNT、CSPG4)进行进一步研究。在这些候选基因中,当NSUN2被敲低时,ORAI2 mRNA表达下调最为显著,CSGP4表达略有下降,而PNCT、RRBP1 mRNA水平不受影响(图5C)。此外,在HGC-27和MKN-45细胞中,ORAI2蛋白水平受到NSUN2的持续调节(图5D、E)。为了进一步研究NSUN2是否通过m5C依赖的方式促进ORAI2的表达。通过MeRIP-qPCR进一步验证NSUN2介导的ORAI2 m5C修饰位点,结果显示,与IgG对照抗体相比,m5C特异性抗体在NSUN2敲除GC细胞上的ORAI2 mRNA富集被显著抑制(图5F)。接下来,为了进一步探究NSUN2是否通过m5C修饰调控ORAI2,构建NSUN2催化位点(半胱氨酸321)突变质粒。与对照细胞相比,在过表达NSUN2的GC细胞中,ORAI2的表达水平显著升高,而催化位点突变体NSUN2的细胞中表达水平则没有升高(图5G, H)。考虑到m5C修饰正向调节ORAI2的mRNA水平,我们进一步研究了m5C修饰是否影响ORAI2的稳定性。结果表明,ORAI2 mRNA水平在NSUN2过表达时高度稳定,而在NSUN2敲除时则相反(图5I)。这些结果证实了NSUN2可以通过m5C修饰稳定ORAI2 mRNA来调节ORAI2的表达。
6)YBX1识别ORAI2的m5C修饰并调控其mRNA稳定性
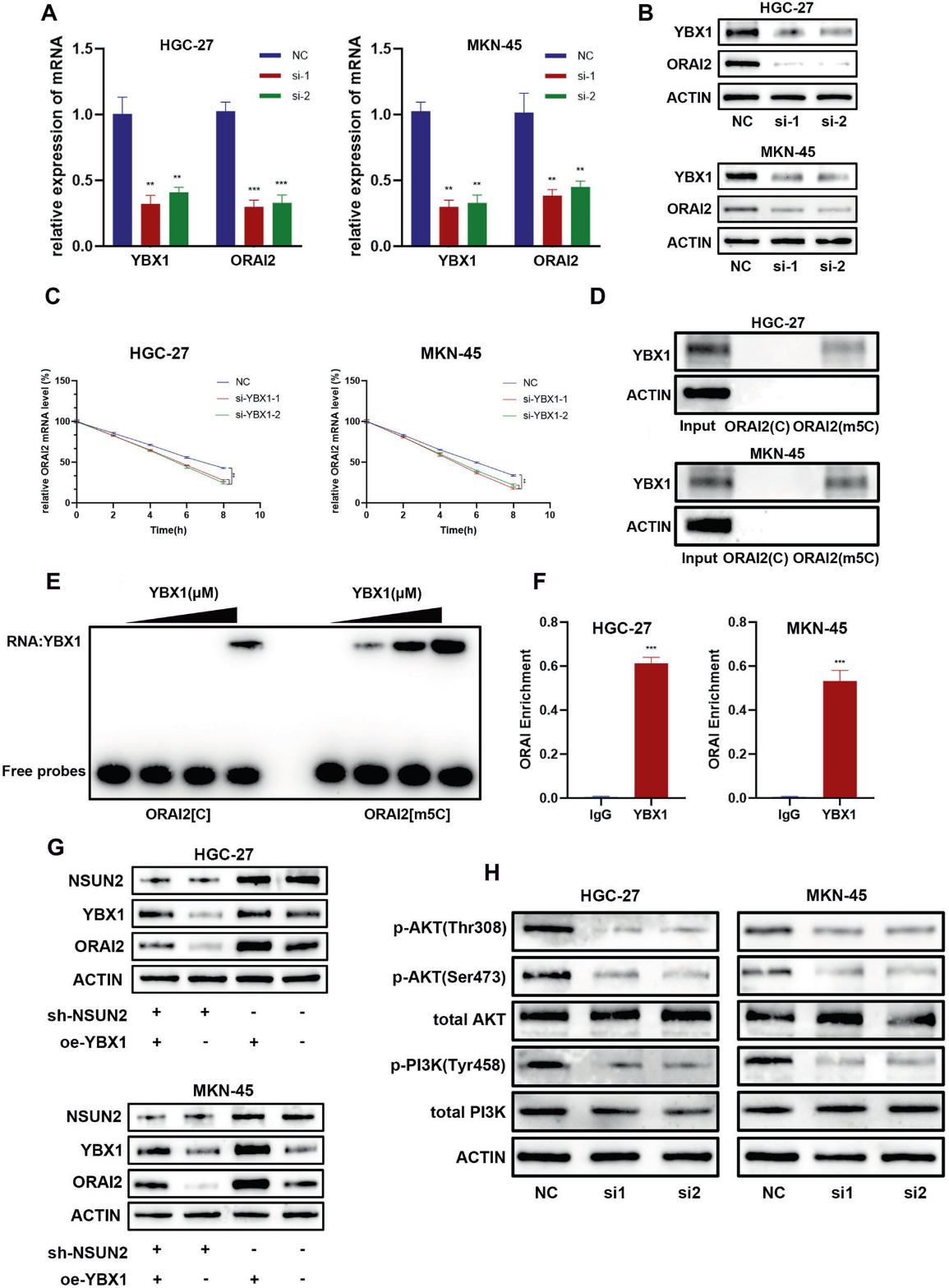
最近有研究报道,YBX1属于m5C阅读器家族,可以通过识别mRNAs的m5C修饰来调控靶基因的稳定性。为了验证YBX1是否可以通过m5C修饰来调节ORAI2的稳定性,当YBX1被敲低时,ORAI2的表达水平下降,同时ORAI2的稳定性下降(图6A-C)。然后使用生物素标记的ORAI2或m5C-ORAI2 RNA探针进行RNA下拉,然后进行western blot验证YBX1可以识别ORAI2的m5C修饰(图6D)。EMSA实验得出了一致的结果(图6E)。RIP-qPCR也证明了YBX1与ORAI2 m5C位点之间的直接相互作用(图6F)。此外,YBX1过表达可以部分挽救NSUN2敲低对ORAI2表达的影响(图6G)。研究表明,肿瘤的腹膜转移主要是由PI3K/AKT通路的异常激活引起的。然后,在GC细胞中沉默ORAI2时,PI3K-AKT通路被抑制(图6H)。这些数据表明,NSUN2介导的m5C修饰通过YBX1依赖的ORAI2 mRNA稳定性来维持ORAI2的表达。
7)NSUN2通过上调ORAI2的表达促进GC恶性过程
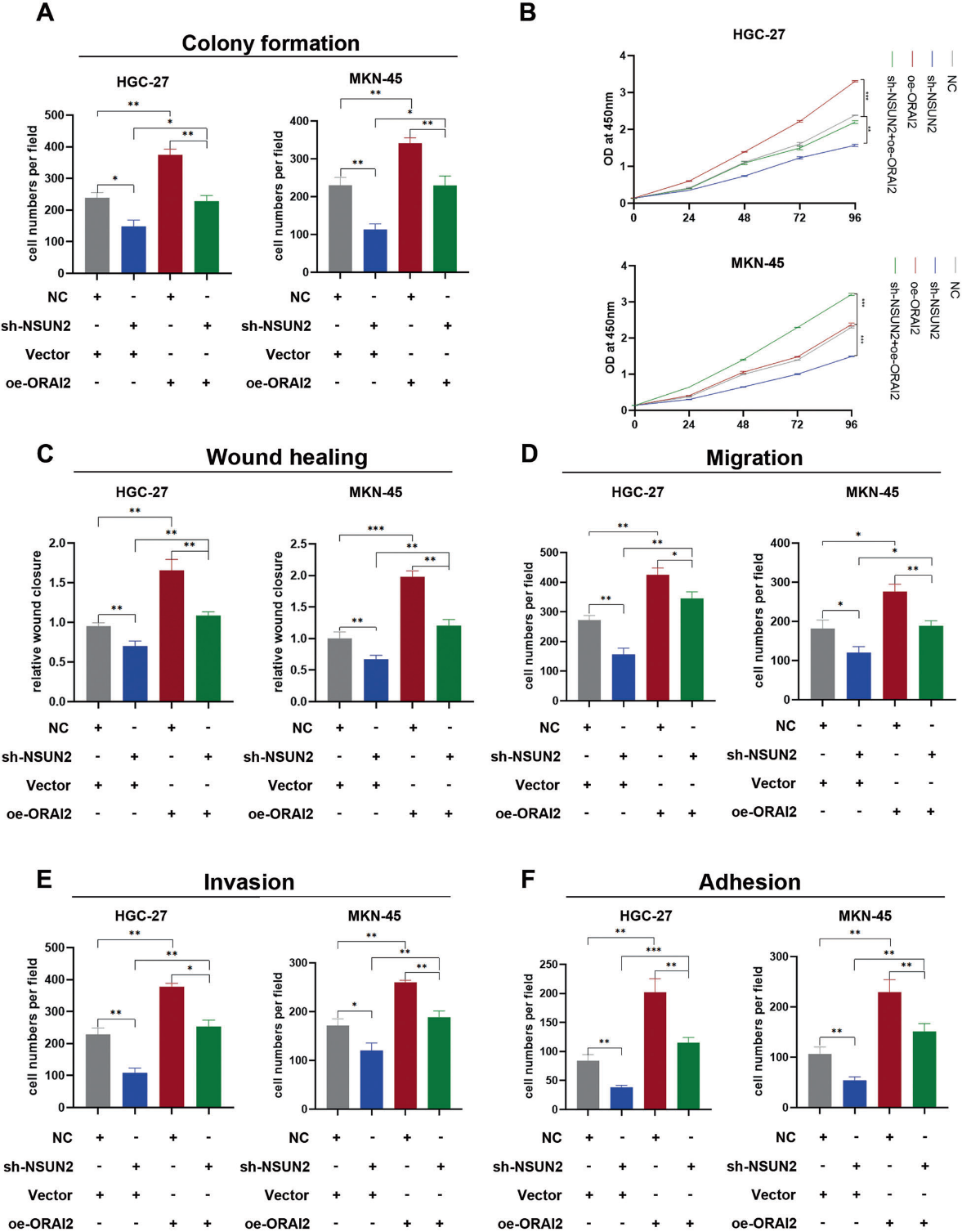
为了进一步探讨NSUN2是否通过ORAI2促进胃癌腹膜转移,我们将过表达的ORAI2质粒转染到NSUN2敲低的细胞株HGC-27和MKN-45中。我们发现,过表达ORAI2可恢复NSUN2敲除细胞系HGC27和MKN45的增殖能力(图7A, B)。此外,ORAI2表达升高可恢复NSUN2敲除细胞系HGC27和MKN45的迁移、侵袭和粘附腹膜间皮细胞能力(图7C-F)。因此,我们发现NSUN2通过上调ORAI2的表达来加速GC恶性生物学行为。
8)NSUN2在体内通过上调ORAI2表达促进腹膜转移
为了进一步探讨NSUN2-ORAI2轴在体内对胃癌腹膜转移的影响,我们将稳定转染了靶向NSUN2 的shRNA或其阴性对照组的HGC27荧光细胞腹腔注射到BALB/c裸鼠体内。通过体内荧光成像,我们发现NSUN2敲低组的腹膜转移程度明显低于对照组(图8A)。NSUN2过表达组BALB/c裸鼠腹膜转移程度更高(图8B)。腹膜转移生态位切片的HE染色也显示,胃癌细胞中NSUN2下调后,转移结节数量显著减少(图8C)。这些结果表明,NSUN2在体内促进了胃癌腹膜转移。我们还发现,ORAI2在NSUN2敲低组的腹膜转移组织中表达下调,通过免疫组化和western blot发现,NSUN2和ORAI2的表达呈正相关(图8C, D)。为了进一步探讨NSUN2介导的ORAI2在胃癌腹膜转移中的作用,我们将四组胃癌细胞腹腔注射到BALB/c裸鼠体内。我们发现,在稳定敲低的NSUN2细胞系中转染ORAI2过表达质粒后,NSUN2促进腹膜转移的能力显著增强(图8E)。这些结果证明ORAI2是体内NSUN2介导的腹膜转移的效应者。

结论
我们的研究证明了高脂肪微环境通过调节NSUN2-m5C-ORAI2-PI3K-AKT信号轴在胃癌腹膜转移和定植中的重要作用。这些发现提示了微环境改变后腹膜转移性胃癌细胞通过RNA表观遗传修饰发生适应性改变,为胃癌腹膜转移提供了治疗靶点。
实验方法
转录组测序,菌落形成,CCK-8,伤口愈合实验,transwell,WB,qRT-PCR,脂质染色,RIP,ChIP,MeRIP,EMSA,动物实验。
参考文献:Liu K, Xu P, Lv J, Ge H, Yan Z, Huang S, Li B, Xu H, Yang L, Xu Z, Zhang D. Peritoneal high-fat environment promotes peritoneal metastasis of gastric cancer cells through activation of NSUN2-mediated ORAI2 m5C modification. Oncogene. 2023 Jun;42(24):1980-1993. doi: 10.1038/s41388-023-02707-5.






