CircZBTB44通过稳定HK3 mRNA结构促进肾癌进展
CircZBTB44 (hsa_circ_0002484)已被确定在肾细胞癌(RCC)组织中表达上调,但其在RCC中的作用和贡献尚不明确。作者证实了RCC细胞中circZBTB44的过度表达。在异种移植小鼠模型中,敲低CircZBTB44抑制了RCC细胞的活力、增殖和迁移,并抑制了肿瘤的发生。异质核糖核蛋白C (HNRNPC)和胰岛素样生长因子2 mRNA结合蛋白3 (IGF2BP3)是circZBTB44的两种RNA结合蛋白。HNRNPC通过m6A修饰促进circZBTB44从细胞核向细胞质的易位,促进了RCC细胞细胞质中IGF2BP3和circZBTB44的相互作用。此外,circZBTB44通过与IGF2BP3结合,在RCC细胞中上调己糖激酶3 (HK3)的表达。HK3对RCC细胞的恶性行为和肿瘤生长具有致瘤作用。在RCC细胞与巨噬细胞共培养中,circZBTB44通过上调HK3促进巨噬细胞M2极化。综上所述,HNRNPC介导circZBTB44与IGF2BP3相互作用上调HK3,在体外促进RCC细胞的增殖和迁移,在体内促进肿瘤发生。本研究结果为RCC的靶向治疗提供了新的思路。本文于2023年4月发表在《Molecular Cancer》IF:41.444期刊。
技术路线:

主要实验结果:
1、circZBTB44在RCC组织和细胞中的表达
作者对GSE100186、GSE108735和GSE137836数据集进行分析,结果显示,CircZBTB44 (hsa_circ_0002484)在RCC肿瘤组织中表达上调(图1A)。随后证实了circZBTB44在RCC细胞中的表达高于人肾近端小管上皮细胞(HK-2),特别是在A498和769-P细胞中(图1B)。CircZBTB44 (chr11:130130750 - 130131824)位于第11号染色体上,与宿主基因ZBTB44外显子2反向剪接(图1C)。从PCR和电泳分析结果来看,circZBTB44仅在cDNA中扩增,在gDNA中未观察到扩增产物(图1D)。此外,作者还发现,与ZBTB44 mRNA相比,circZBTB44对RNase R处理具有抗性,这表明由于其圆形结构,circZBTB44比其线性mRNA更稳定(图1E)。FISH和亚细胞分离实验显示,circZBTB44在RCC细胞的细胞质和细胞核中均有分布,细胞质中circZBTB44较多(图1F-G)。
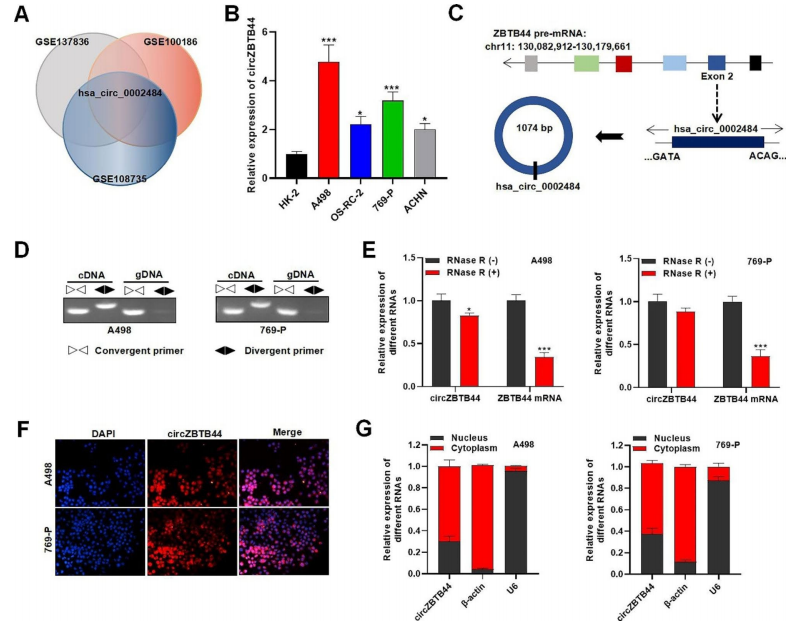
图1 circZBTB44在RCC组织和细胞中的表达
2、CircZBTB44促进体外RCC细胞发育和体内小鼠肿瘤发生
通过一系列功能实验研究circZBTB44对RCC细胞恶性行为的影响。转染si-circZBTB44-1/-2/-3后,RCC细胞中circZBTB44的表达显著降低,ZBTB44 mRNA的表达不受si-circZBTB44的影响。si-circZBTB44-1和sicircZBTB44-2质粒表现出较好的沉默效果,并应用于后续实验(图2A)。然后作者评估了RCC细胞的活力和增殖潜力,发现circZBTB44-2沉默对RCC细胞的体外生长有明显的抑制作用(图2B-C)。此外,相对于对照组,si-circZBTB44-1/-2组中迁移的RCC细胞数量显著减少(图2D)。敲低circZBTB44可减少RCC细胞的创面愈合距离(图2E),表明沉默circZBTB44可显著抑制RCC细胞的迁移能力。研究表明,CircZBTB44在RCC细胞生长和迁移中起癌症启动子的作用。然后作者在体内检测了circZBTB44基因敲低对小鼠肿瘤生长的影响。与对照组相比,si-circZBTB44组小鼠肿瘤组织样本中的circZBTB44水平显著降低(图2F)。si-circZBTB44组与对照组相比,肿瘤大小和重量明显减小(图2G-H)。同样地,沉默circZBTB44后,肿瘤生长速度降低(图2I)。此外,免疫组化染色结果显示,circZBTB44沉默导致Ki-67蛋白表达明显降低,表明circZBTB44在体内刺激肿瘤生长(图2J)。
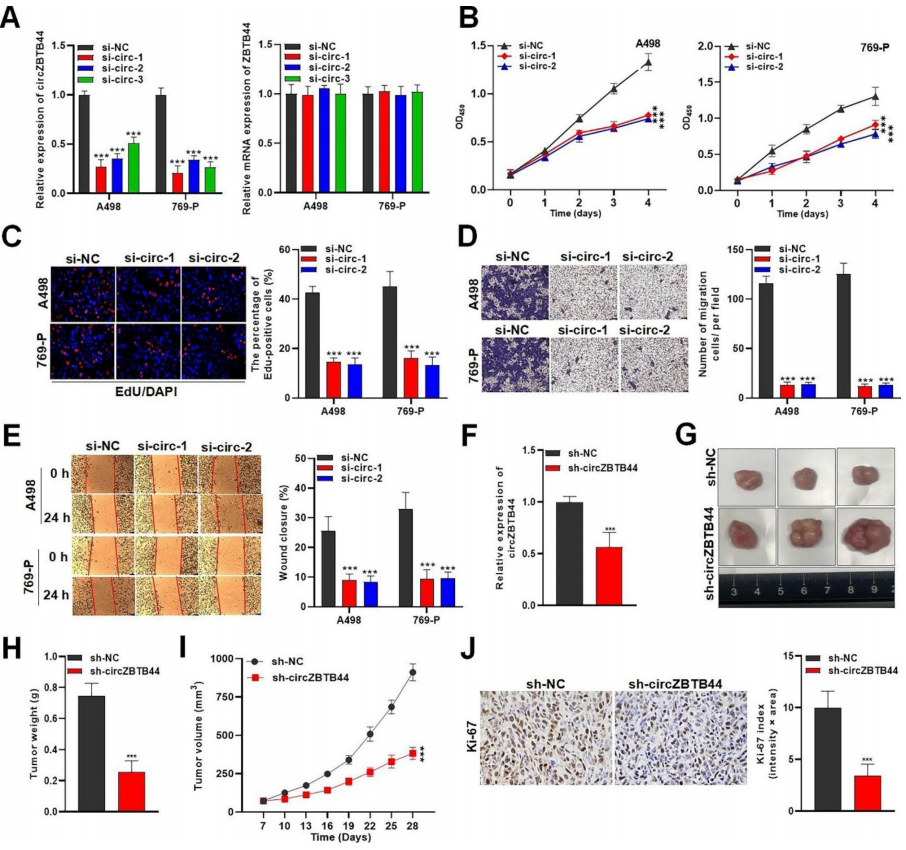
图2 CircZBTB44在体外促进RCC细胞恶性
3、CircZBTB44在RCC细胞中与HNRNPC和IGF2BP3相互作用
作者基于RBPsuite网站的预测和RNA pull-down-ms的结果,进一步探讨circZBTB44在RCC中的调控机制。结果显示HNRNPC和IGF2BP3可能与circZBTB44相互作用(图3A)。接着作者检测了circZBTB44沉默对HNRNPC和IGF2BP3表达的影响,qRT-PCR结果表明,RCC细胞中circZBTB44沉默对HNRNPC和IGF2BP3的表达没有显著影响(图3B)。RNA pull-down实验显示,HNRNPC和IGF2BP3在bio-circZBTB44复合物中大量富集,这表明circZBTB44在RCC细胞中与HNRNPC和IGF2BP3相互作用(图3C)。同样,作者观察到circZBTB44在抗HNRNPC和抗IGF2BP3的沉淀中丰富富集,这证实了circZBTB44与HNRNPC或IGF2BP3之间的相互作用(图3D)。人类蛋白质图谱预测HNRNPC主要分布在细胞核中,IGF2BP3主要位于细胞质中(图3E),免疫荧光实验进一步证实了这一点(图3F)。最后作者评估了HNRNPC和IGF2BP3之间的相互作用,结果显示HNRNPC和IGF2BP3之间没有直接的相互作用(图3G)。
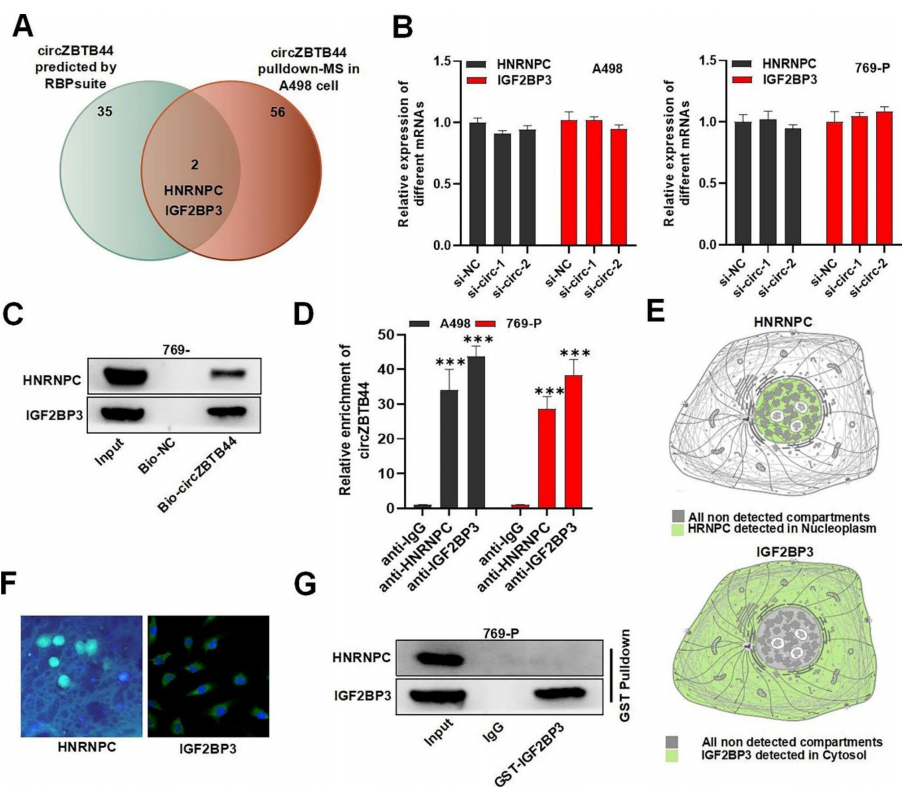
图3 CircZBTB44在RCC细胞中与HNRNPC和IGF2BP3相互作用。
4、HNRNPC增强了circZBTB44和IGF2BP3的相互作用并通过m6A修饰介导circZBTB44向细胞质的易位
HNRNPC是一种N6 -甲基腺苷(m6A)解读器,调控RNA剪接、3’端加工和翻译等RNA加工。假设HNRNPC参与了circZBTB44的调控。qRT-PCR结果验证了siHNRNPC和siIGF2BP3在RCC细胞中转染后, HNRNPC和IGF2BP3在RCC细胞中的表达显著降低(图4A)。MeRIP检测结果显示,circZBTB44在抗m6 A沉淀中显著富集,沉默HNRNPC后抗m6A减少,而在RCC细胞中敲除IGF2BP3后无明显变化,提示HNRNPC影响了circZBTB44的m6 A修饰(图4B)。此外,作者使用SRAMP数据库预测circZBTB44的m6A修饰位点,发现了4个具有高置信度的m6A位点(图4C)。然后对4个m6A位点进行突变,RNA pull- down实验结果表明,HNRNPC在Bio-circZBTB44-s3Mut拉下的复合物中不富集(图4D)。然后检测circZBTB44在细胞质和细胞核中的表达,qRT-PCR结果显示,HNRNPC敲低显著降低了circZBTB44的细胞质分布,提高了circZBTB44在RCC细胞细胞核中的表达(图4E)。作者进一步探讨了HNRNPC对circZBTB44和IGF2BP3相互作用的影响,HNRNPC缺失明显降低了Bio-circZBTB44复合物中IGF2BP3的富集,提示HNRNPC沉默抑制了RCC细胞中circZBTB44和IGF2BP3的相互作用(图4F)。同样,RIP实验结果表明,circZBTB44富集后,抗IGF2BP3的沉淀显著减少(图4G)。总体而言,HNRNPC通过m6A修饰促进circZBTB44向细胞质易位,增强了circZBTB44与IGF2BP3的相互作用。
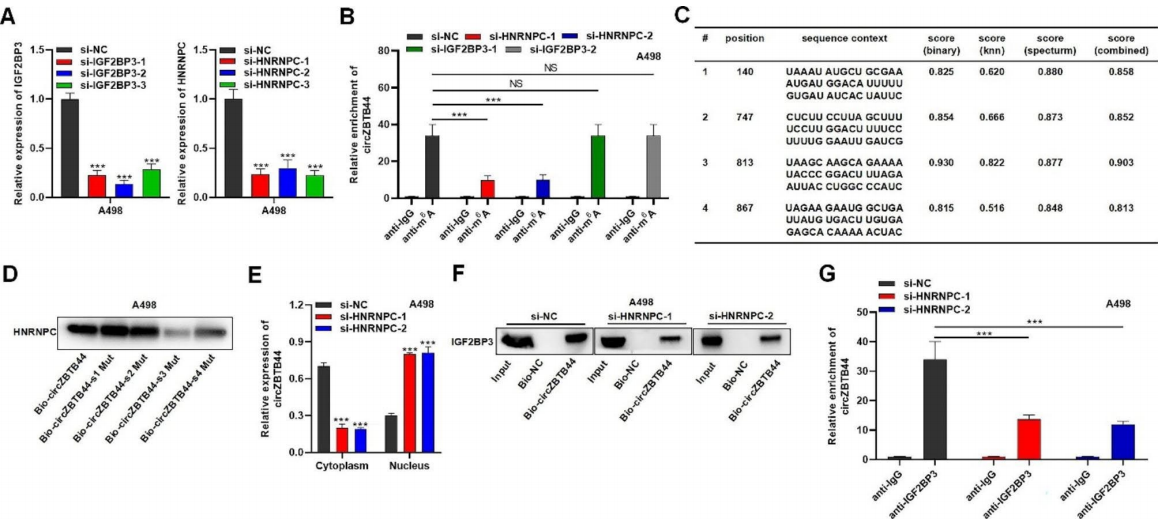
图4 HNRNPC增强了circZBTB44和IGF2BP3的相互作用并通过m6 A修饰介导circZBTB44向细胞质的易位
5、CircZBTB44与IGF2BP3结合调节HK3 mRNA稳定性
IGF2BP3与mRNA结合,调控靶基因表达。因此,作者对circZBTB44/IGF2BP3的下游靶点进行了研究。根据catRAPID数据库预测的结果和之前的研究,发现HK3很可能与IGF2BP3结合,并且在RCC中也上调(图5A)。作者检测了circZBTB44敲低对HK3表达的影响,在circZBTB44沉默的RCC细胞中,HK3显著下调(图5B)。在HK3 3'UTR复合物中观察到IGF2BP3的富集,这表明在RCC细胞中IGF2BP3与HK3 3'UTR结合(图5C)。RIP实验显示,HK3 3'UTR复合物在抗IGF2BP3的沉淀中富集(图5D)。α-amanitin处理并在RCC细胞中沉默IGF2BP3后,HK3 mRNA的稳定性显著降低(图5E)。FISH检测结果显示,circZBTB44、IGF2BP3和HK3在RCC细胞的细胞质中共定位(图5F)。RIP实验显示,在circ ZBTB44沉默的RCC细胞中,抗IGF2BP3沉淀中HK3 3'UTR的富集显著减少(图5G)。qRT-PCR分析证实了circZBTB44的过表达效率(图5H)。作者还观察到,在RCC细胞中,IGF2BP3敲除后,HK3的表达下调,并通过过表达circZBTB44而被逆转(图5I)。
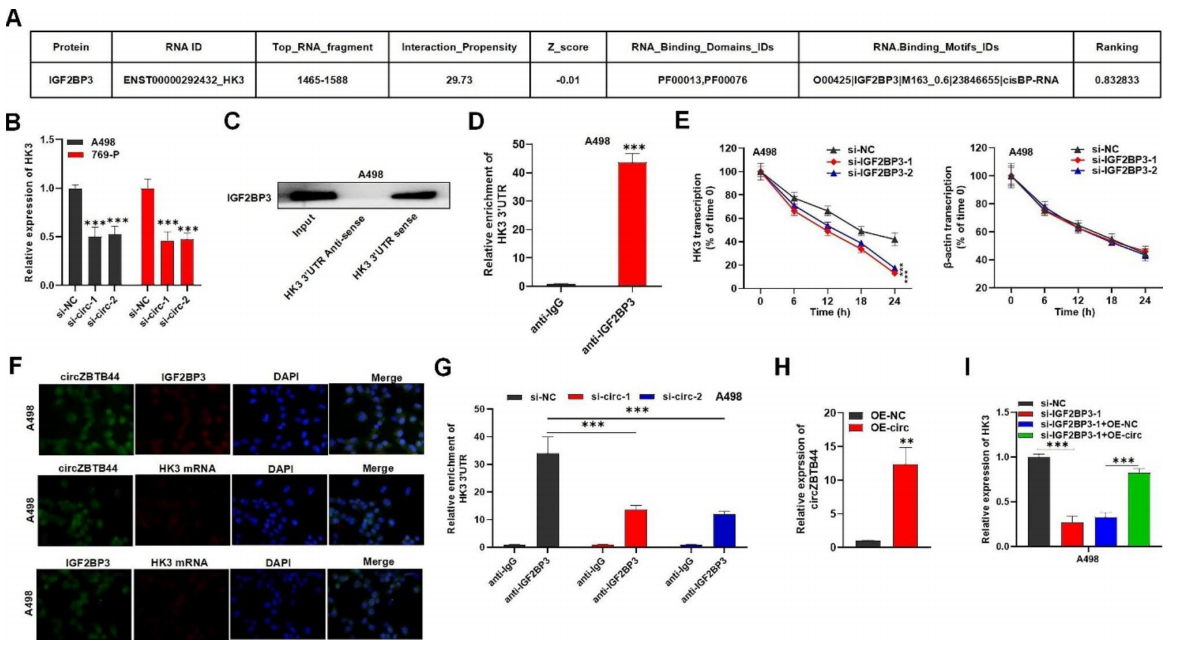
图5 CircZBTB44与IGF2BP3相互作用调节HK3 mRNA的稳定性。
6、HK3在体外和体内均促进RCC的生长和转移
作者研究了HK3对RCC细胞发生的影响。qRT-PCR和western blot分析显示,转染si-HK3-1/-2/-3后,RCC细胞中HK3的表达显著降低(图6A)。研究表明,HK3敲低可显著抑制RCC细胞的生存能力和增殖能力(图6B-C)。此外,相对于对照组,si-HK3-1和si-HK3-2组的RCC细胞迁移能力显著降低(图6D-E)。利用荷瘤小鼠模型评估HK3缺乏对RCC肿瘤发生的影响,qRT-PCR和western blot分析显示,sh-HK3组小鼠肿瘤组织中HK3的表达明显下调(图6F-G)。与对照组相比,缺乏HK3导致小鼠肿瘤重量和体积显著减少(图6H-I)。此外,小鼠肿瘤组织中的Ki67蛋白因HK3缺乏而减少,这表明HK3敲低抑制了体内RCC的肿瘤发生(图6J)。
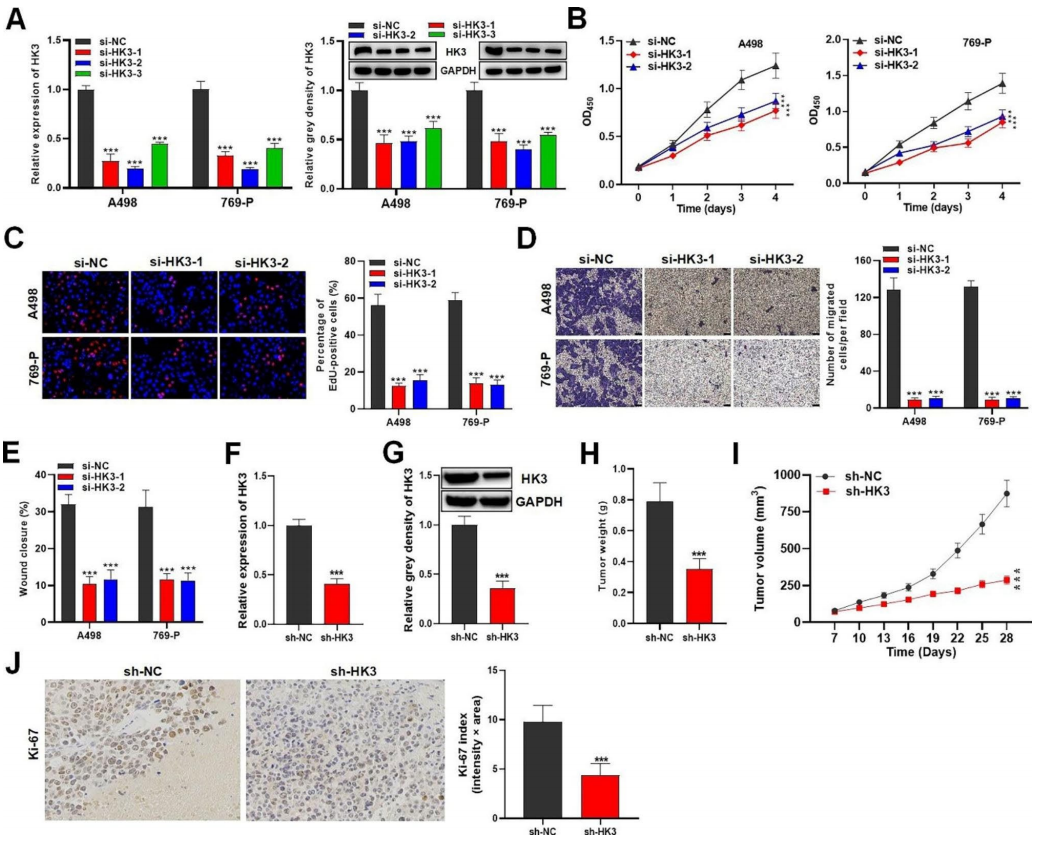
图6 HK3在体外和体内均促进RCC的生长和转移
7、CircZBTB44通过上调HK3促进RCC生长和转移
作者进行了救援试验,以检验HK3是否在circZBTB44对RCC进展的调节中发挥作用。利用pcDNA3.1/ HK3载体过表达HK3,通过qRT-PCR验证转染效率(图7A)。作者发现circZBTB44诱导RCC细胞活力下降,并且HK3过表达后EdU阳性细胞比例明显恢复(图7B-C)。沉默circZBTB44后,迁移的RCC细胞数量和RCC细胞的伤口愈合距离减少,发现这与HK3上调相抵消(图7D-E)。此外,circZBTB44缺失诱导的异种移植物肿瘤重量、体积和生长速度的下降被HK3过表达显著逆转(图7F-G)。与sh-circ+oe-NC组相比,circZBTB44敲低组小鼠肿瘤组织中Ki67蛋白表达降低,HK3过表达升高(图7H)。
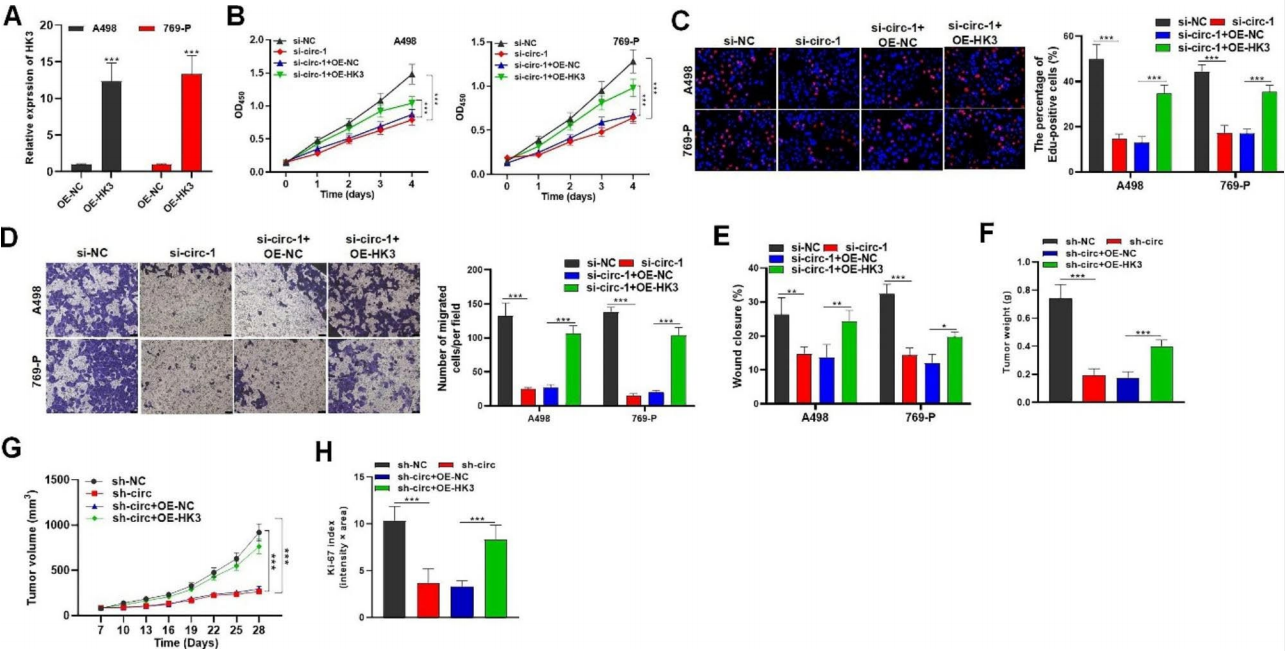
图7 CircZBTB44通过上调HK3促进RCC生长和转移
8、CircZBTB44通过上调HK3促进巨噬细胞M2极化
前人研究表明,HK3通过刺激浸润的单核细胞或巨噬细胞表面标记物的丰度,促进RCC细胞的免疫逃逸。因此,作者探索circZBTB44是否通过调节HK3来调节单核细胞或巨噬细胞的M2极化。M0巨噬细胞与RCC细胞共培养诱导TAMs (图8A)。流式细胞术显示,circZBTB44沉默显著降低了CD86+CD206−巨噬细胞的比例,升高了CD206+CD86−巨噬细胞的比例,这一现象被HK3过表达逆转(图8B)。在与RCC共培养的巨噬细胞中检测M1相关基因(CD86、TNF-α)和M2相关基因(CD206、ARG-1)的表达。结果显示,circZBTB44沉默降低了CD206和ARG-1的表达,增加了CD86和TNF-α的水平,而HK3过表达可显著拯救CD206和ARG-1的表达(图8C-D)。

图8 CircZBTB44通过上调HK3促进巨噬细胞M2极化
实验方法
生物信息学分析,RNase R消化实验,qRT-PCR,Western blot,Rescue assays,RNA干扰,过表达,细胞迁移实验,细胞划痕实验,EdU化验,细胞活力测定,免疫荧光染色,荧光原位杂交(FISH),甲基化RNA免疫沉淀(MeRIP),免疫组化(IHC),RNA pull-down,GST pull-down,RNA免疫沉淀(RIP),异种移植小鼠模型,RCC细胞与巨噬细胞共培养,流式细胞术。
参考文献:
Li TS, Gu Y, Xu BC, Kuca K, Zhang J, Wu WD. CircZBTB44 promotes renal carcinoma progression by stabilizing HK3 mRNA structure. 2023, April, 22(1): 77. https://doi.org/10.1186/s12943-023-01771-5.






