蛋白精氨酸甲基化修饰调控病毒感染后的MAVS激活
信号适配体MAVS在病毒感染后形成类似朊病毒的聚合体,以激活先天的抗病毒免疫反应。然而,MAVS的自发聚集可导致自身免疫性疾病。防止MAVS在静止细胞中自发聚集的分子机制一直是个谜。在此,本研究发现,蛋白精氨酸甲基转移酶9(PRMT9)直接针对MAVS,并催化MAVS在Arg41和Arg43处的精氨酸甲基化。在静止状态下,这种修饰抑制了MAVS的聚集和MAVS的自动激活。病毒感染后,PRMT9与线粒体解离,导致MAVS的聚集和激活。本研究揭示了MAVS上的一种翻译后修饰形式,它可以使MAVS在生理条件下保持不活跃,以维持先天免疫的平衡性。本文于2022年8月发表在《Nature Communications》IF:17.694。
技术路线:

主要实验结果:
1、PRMT9负调控RLRs诱导的IFN-β产生
为确定PRMTs在先天性抗病毒免疫中的潜在功能,将GFP-PRMT1-9质粒与DsRED2-Mito质粒一起转染HEK293T细胞,然后进行模拟感染或感染SeV 8小时,并测量线粒体的定位。共聚焦显微镜显示,PRMT1、PRMT2、PRMT3、PRMT4、PRMT5、PRMT6和PRMT8未能与线粒体共聚焦,且其定位不受SeV感染的影响。而PRMT7在HEK293T细胞中与线粒体共定位,不受SeV感染的影响,只有PRMT9在HEK293T细胞中与线粒体共定位,并在SeV感染后与线粒体分离(附图1)。因此,选择PRMT9用于后续实验。

附图1 PRMT9定位于线粒体
为进一步确认PRMT9的功能,通过CRISP/Cas9技术构建了两个PRMT9敲除的RAW264.7细胞系(图1a)。与siRNA敲除结果一致,在SeV感染或5′-pppRNA转染后,PRMT9敲除的RAW264.7细胞中Ifnb1、Ifnα4和Cxcl10的mRNA表达水平上调(图1b,c)。同样,在RAW264.7细胞中敲除Prmt9也增加了VSV诱导的Ifnb1的表达(图1d)。同时,在PRMT9敲除的RAW264.7细胞中,VSV的复制也减弱了(图1d,e)。
在HEK293T细胞中转染Flag-PRMT9,发现过表达Flag-PRMT9后,SeV或VSV感染后IFNB1 mRNA的表达明显下降(图1f,g)。同时,在过表达Flag-PRMT9的HEK293T细胞中,VSV的复制增加(图1g)。荧光显微镜和流式细胞仪分析的结果表明,PRMT9在HEK293T细胞中的过表达促进了VSV-GFP的复制(图1h)。总的来说,这些数据表明,PRMT9负向调节RLRs诱导的IFN-β信号,促进RNA病毒感染。
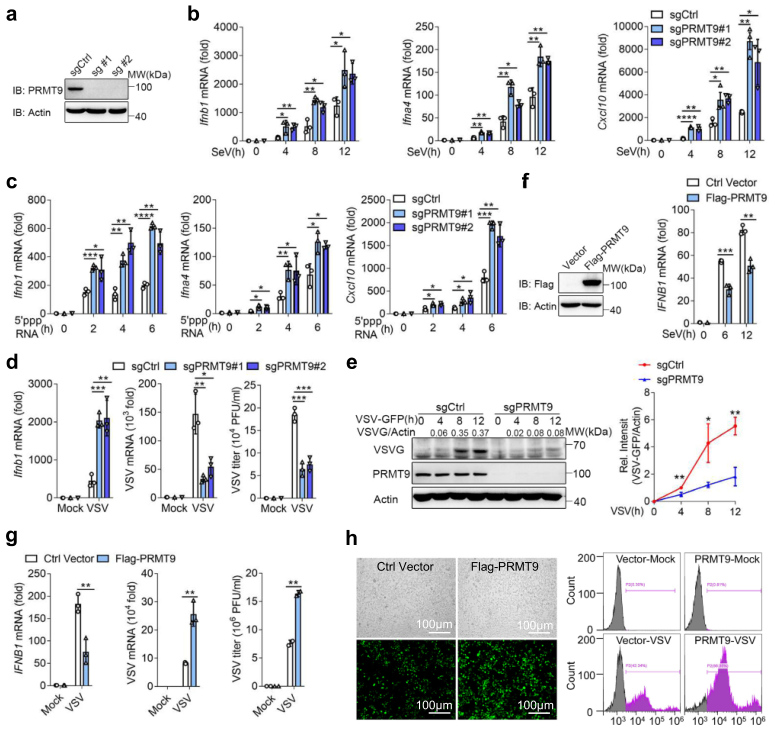
图1 PRMT9负调控RLRs诱导的IFN-β产生
2、PRMT9缺陷增强RLRs触发的IFN -β信号通路
为进一步研究PRMT9在调节病毒感染中的功能,将Prmt9fl/fl小鼠与Lyz2-Cre转基因小鼠杂交,产生髓系特异性PRMT9敲除小鼠。从Prmt9fl/fl Lyz2-Cre(以下简称'Prmt9CKO')和Prmt9fl/fl小鼠(以下简称'Prmt9WT')制备初级腹膜巨噬细胞,然后用SeV、VSV和HSV-1感染或用5′-pppRNA刺激。与PRMT9的siRNA敲除或sgRNA敲除的观察结果一致,用SeV感染Prmt9CKO腹腔巨噬细胞或用5'PPP RNA刺激导致Ifnb1、Ifnα4和Cxcl10 mRNA的表达与Prmt9WT巨噬细胞相比明显增加(图2a, b)。Prmt9CKO巨噬细胞的IFN-β分泌也比Prmt9WT巨噬细胞高(图2a,b)。然而,Premt9WT巨噬细胞和Premt9CKO巨噬细胞在HSV-1感染诱导的I型IFNs和Cxcl10表达水平方面没有观察到差异(图2c)。结果显示,感染VSV后,Ifnb1 mRNA水平在Prmt9CKO巨噬细胞中增加,而VSV mRNA、VSV滴度和VSV蛋白在Prmt9CKO巨噬细胞中明显下降(图2d,e)。总之,可以得出一个结论:PRMT9对RLRs诱导的IFN-β信号传导有负向调节作用。
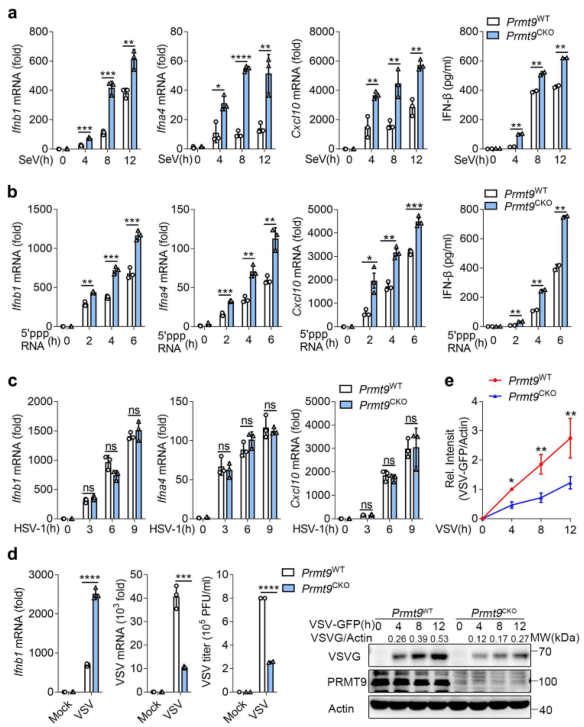
图2原代腹腔巨噬细胞PRMT9缺陷增强RLRs触发的IFN -β信号通路
3、在体内PRMT9抑制先天抗病毒响应
为确认PRMT9在RNA病毒感染中的生理功能,通过尾静脉注射的方式让Prmt9CKO小鼠感染VSV。如图3a所示,感染VSV后,Ifnb1在Prmt9CKO小鼠肺部、肝脏和脾脏的表达水平明显高于Prmt9WT小鼠的器官。此外,ELISA结果还显示,VSV感染24小时后,Prmt9CKO小鼠血清中IFN-β蛋白的水平比Prmt9WT小鼠明显增加(图3b)。此外,VSV滴度的Plaque检测和VSV mRNA的qRT-PCR分析证实,与Prmt9CKO小鼠相比,VSV在肺部、肝脏和脾脏的复制明显减弱(图3c, d)。此外,发现Prmt9CKO小鼠对VSV感染的敏感性低于Prmt9WT小鼠,但对HSV-1感染的敏感性不高(图3e,f)。HE染色的结果显示,Prmt9WT和Premt9CKO小鼠在没有感染VSV的情况下,肺部没有明显的差异,与VSV感染后的Prmt9WT小鼠相比,PRMT9的缺乏减轻了炎症细胞浸润、组织水肿和肺部纤维化(图3g)。总之,这些结果表明,PRMT9的缺失增强了体内对RNA病毒的抗病毒先天免疫反应。
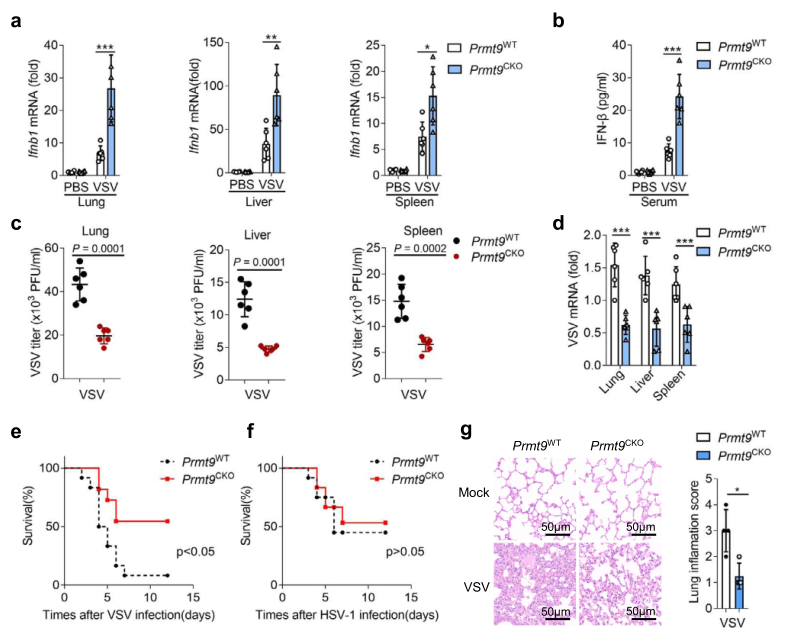
图3 在体内PRMT9抑制先天抗病毒响应
4、病毒感染期间PRMT9负调控MAVS介导的信号通路
为研究PRMT9在调节MAVS介导的信号通路中的作用,将Flag-PRMT9质粒转染到HEK293T细胞,然后用SeV感染。免疫印迹分析结果显示,与空载体相比,转染PRMT9表达质粒的HEK293T细胞中SeV诱导的TBK1、IRF3和IκBα的磷酸化水平下降(图4a,b)。来自Prmt9WT和Premt9CKO小鼠的腹膜巨噬细胞,然后用SeV和HSV-1感染或用5'pp RNA刺激。发现,感染SeV或用5'pp-RNA刺激后,Prmt9CKO巨噬细胞中TBK1、IRF3和IκBα的磷酸化水平高于Prmt9WT巨噬细胞(图4c, d)。相比之下,感染HSV-1后,TBK1、IRF3和IκBα的磷酸化在Prmt9CKO巨噬细胞中没有表现出差异(图4e,f)。据报道,在磷酸化后,IRF3将二聚体化并转入细胞核。因此,从SeV感染的巨噬细胞中分离出细胞质和核的部分,测量IRF3的核转位。发现在感染SeV后,Prmt9CKO巨噬细胞中IRF3向细胞核的转移比Prmt9WT巨噬细胞的转移要大(图4g,h)。此外,共聚焦显微镜的结果显示,PRMT9在HEK293T细胞中的过表达削弱了IRF3向细胞核的转位(图4i)。总之,这些数据表明,PRMT9通过抑制MAVS介导的信号传导抑制IFN-β的产生和先天抗病毒免疫。
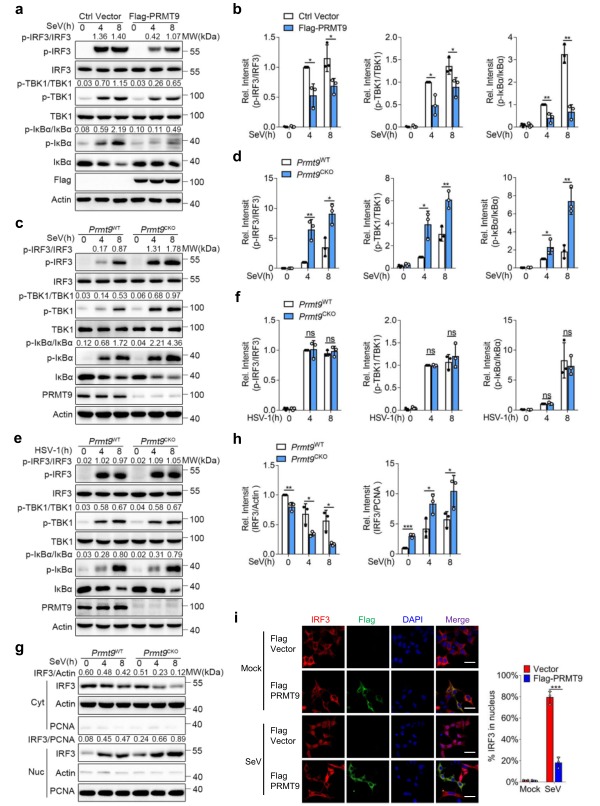
图4 PRMT9负调控MAVS介导的信号通路
5、PRMT9靶向MAVS
为确定受PRMT9调控的目标,将与先天抗病毒免疫有关的主要信号蛋白的过表达质粒与PRMT9表达的质粒和IFN-β启动子荧光素酶报告一起转染到HEK293T细胞。发现由RIG-I、MDA5或MAVS介导的IFN-β启动子荧光素酶报告的激活被PRMT9过表达所抑制(图5a)。同时,由TBK1介导的IFN-β启动子荧光素酶报告的激活不受PRMT9过表达的影响(图5a)。cGAS/STING诱导的IFN-β启动子的激活不受PRMT9过表达的影响(图5a),这与数据显示PRMT9不能调节对DNA病毒感染的抗病毒免疫反应相一致。进一步发现,HEK293T细胞中由RIG-I、MDA5或MAVS介导的IFNB1表达水平也受到PRMT9表达的抑制,而,由TBK1或IRF3介导的IFNB1表达水平在PRMT9过表达后没有受到影响(图5b)。这些数据表明,PRMT9可能以MAVS为目标,调节IFN-β信号和抗病毒反应。
为进一步验证,将HA-cGAS、HA-RIG-I、HA-MAVS、HA-TBKI、Myc-MDA5和Myc-IRF3与GFP-PRMT9一起转染到HEK293T细胞中,研究其相互作用。共同免疫沉淀和Western印迹分析的结果表明,PRMT9与MAVS相互作用,但与cGAS、RIG-I、MDA5、TBKI和IRF3没有相互作用(图5c)。用重组蛋白体外pull down的结果显示PRMT9和MAVS之间有直接的相互作用(图5d)。免疫荧光结果也显示PRMT9和MAVS之间存在明显的共定位(图5e)。此外,发现病毒感染后,内源性PRMT9和MAVS之间的相互作用减弱了(图5f)。总之,这些数据表明,PRMT9通过靶向线粒体上的MAVS抑制了抗病毒的先天免疫。
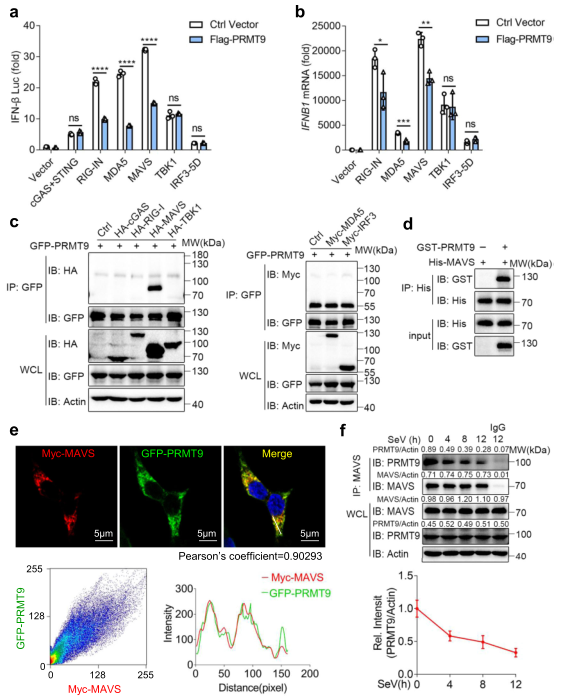
图5 PRMT9靶向MAVS
6、PRMT9催化MAVS的R41和R43位点的精氨酸甲基化
接下来研究PRMT9是否能催化MAVS的精氨酸甲基化。首先将GFP-PRMT9表达质粒与HA-MAVS一起转染到HEK293T细胞。Co-IP和WB结果显示,PRMT9增强MAVS的SDMA水平(图6a,左)。据报道,PRMT9能催化SAP14527的SDMA,因此,用HA-SAP145质粒做阳性对照(图6a,右)。由于有三种类型的精氨酸甲基化是由精氨酸甲基转移酶催化的,所以对MAVS的甲基化类型进行了研究。从小鼠中分离原发性腹膜巨噬细胞,用SeV感染。Co-IP和WB的结果显示,在没有SeV感染的MAVS中形成了MMA和SDMA,但没有形成ADMA(图6b)。值得注意的是,SeV感染后MMA和SDMA的形成逐渐减少(图6b)。为进一步确定PRMT9的甲基化精氨酸功能,通过Co-IP和WB检查内源性MAVS的SDMA。与PRMT9过表达的结果一致,在Prmt9CKO和Prmt9WT小鼠的腹腔巨噬细胞中敲除PRMT9大大减少了MAVS的甲基化(图6c)。总的来说,这些数据表明PRMT9在RLRs途径中调节MAVS的甲基化。
据报道,Gly260突变使PRMT9变成一种无催化活性的形式。为验证PRMT9介导的MAVS甲基化是否取决于其甲基转移酶的活性,将WT PRMT9或PRMT9突变体G260E与MAVS一起转染到HEK293T细胞。结果表明,WT PRMT9可以增加MAVS的甲基化水平,而PRMT9的酶突变体G260E则失去了诱导MAVS甲基化的能力(图6d)。SeV感染减少了PRMT9介导的MAVS甲基化(图6d)。将WT PRMT9和PRMT9突变体G260E重新引入Prmt9CKO巨噬细胞并测量MAVS甲基化,发现在Prmt9CKO巨噬细胞中表达mPRMT9可以恢复MAVS甲基化,而表达mPRMT9突变体G260E则没有这种效果(图6e)。这些数据表明,PRMT9通过其甲基转移酶活性催化了MAVS的甲基化。
为直接研究PRMT9催化MAVS的精氨酸甲基化,制备His-MAVS和GST-PRMT9的重组蛋白,并进行体外蛋白精氨酸甲基化试验。发现在体外甲基化系统中,当PRMT9存在时,MAVS的甲基化程度增加(图6f)。综上所述,这些数据证明PRMT9促进了MAVS的精氨酸甲基化。
为确定MAVS中被PRMT9调节的潜在精氨酸残基,用重组的MAVS和PRMT9蛋白进行体外甲基化试验,然后用液相色谱-质谱(LC-MS)分析来识别被甲基化的精氨酸残基。在检测中,MAVS的R41和R43残基被确定为潜在的甲基化部位(图6g)。接下来,R41和R43精氨酸残基被突变为赖氨酸,并检查MAVS在MAVS KO HEK293T细胞(MAVS-/-)中的甲基化状态。发现PRMT9可以促进MAVS(WT)的甲基化,而,MAVS(R41K)、MAVS(R43K)和MAVS(R41K,R43K)突变导致MAVS甲基化在PRMT9的存在下明显减少(图6h)。WB结果显示,PRMT9可以促进MAVS(WT)的甲基化,而PRMT9介导的MAVS甲基化在MAVS(R41K)、MAVS(R43K)和MAVS(R41K, R43K)中大大降低(图6i)。进一步,用S-[3H-Met]腺苷蛋氨酸作为甲基供体进行体外甲基化试验。结果显示,在重组PRMT9蛋白的存在下,His-MAVS的放射性大大增加(图6j),而MAVS(R41K)、MAVS(R43K)和MAVS(R41K,R43K)的放射性水平与MAVS(WT)相比明显下降(图6j)。总之,这些数据表明,PRMT9催化了MAVS在R41和R43残基上的精氨酸甲基化。
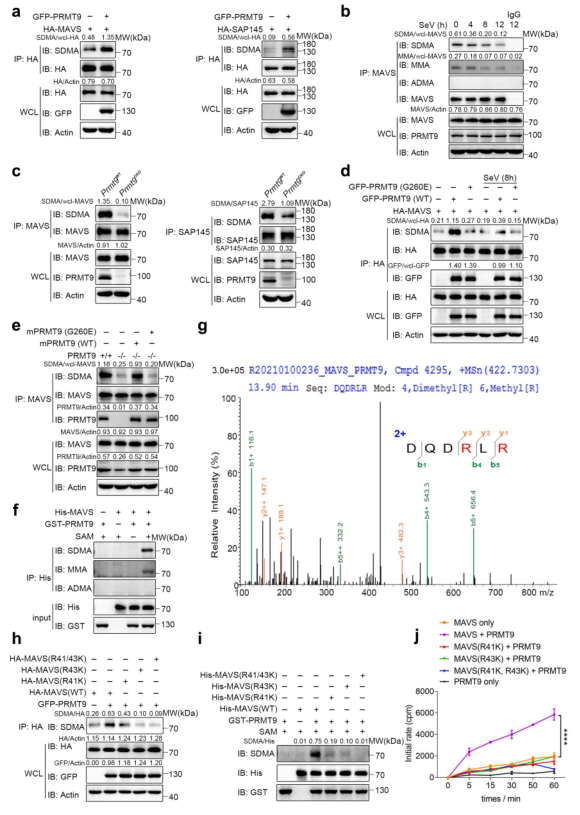
图6 PRMT9催化MAVS的R41和R43位点的精氨酸甲基化
7、PRMT9介导的MAVS甲基化抑制MAVS聚集和激活
RNA病毒感染诱导MAVS迅速形成类似朊病毒的聚集物,导致I型IFN和其他炎症细胞因子的强烈诱导。在本研究中,对PRMT9介导的MAVS甲基化是否抑制MAVS的聚集进行了调查。首先将GFP-PRMT9表达质粒或GFP-PRMT9(G260E)和HA-MAVS转染到HEK293T细胞中,并通过半变性洗涤剂琼脂糖电泳(SDD-AGE)测量MAVS的聚集。如图7a,过表达MAVS可以促进MAVS聚集的形成。与PRMT9的抑制作用相一致,发现PRMT9过表达的HEK293T细胞中MAVS的聚集比转染对照载体的细胞要少(图7a)。值得注意的是,PRMT9(G260E)的过表达不能减少MAVS的聚集(图7a)。进一步测量SeV感染诱导的MAVS聚集,该感染由Premt9CKO和Premt9WT小鼠的腹膜巨噬细胞制备。发现SeV感染可以诱导巨噬细胞中的MAVS聚集(图7b),而PRMT9的缺乏大大增加了感染后Prmt9CKO巨噬细胞中MAVS聚集的形成(图7b)。值得注意的是,即使没有SeV感染,在Prmt9CKO巨噬细胞中也可以检测到低水平的MAVS聚集(图7b),表明PRMT9介导的MAVS甲基化可以阻止MAVS在正常条件下自主激活。
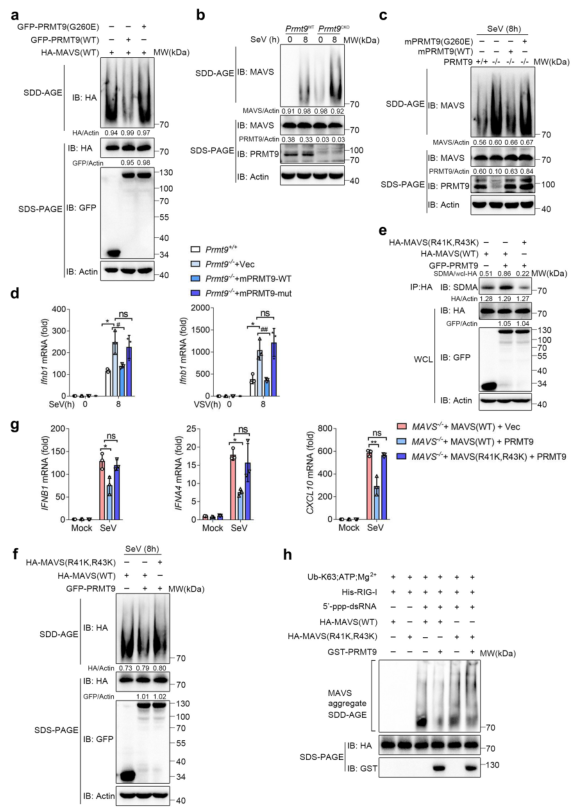
图7 PRMT9介导的MAVS甲基化抑制MAVS聚集和激活
实验方法:
CRISPR–Cas9构建PRMT9敲低小鼠,细胞和病毒培养,PRMT9和MAVS敲低细胞构建,质粒和转染,RNA提取和质控,ELISA,荧光素酶报告基因实验,Co-IP,IF,病毒感染和滴度实验,蛋白表达和纯化,组织病理染色,体外甲基化试验,体外放射性实验,体外MAVS的扩大和激活
参考文献:
Bai X, Sui C, Liu F, Chen T, Zhang L, Zheng Y, Liu B, Gao C. The protein arginine methyltransferase PRMT9 attenuates MAVS activation through arginine methylation. Nat Commun. 2022 Aug 26;13(1):5016. doi: 10.1038/s41467-022-32628-y. PMID: 36028484






