你还不知道怎么选关键基因吗?生信 加简单的实验验证轻松发高分
溃疡性结肠炎(UC)是一种慢性非特异性炎症性疾病,一般局限于结肠粘膜和粘膜下层。最近的研究表明,铁死亡可能参与UC的过程。然而,UC中的铁死亡机制仍有待于进一步研究。本研究基于生物信息学挖掘到UC中铁死亡相关的关键基因LCN2,进一步功能实验证实LCN2是调节UC中铁死亡形成的一个关键因素,为铁死亡在UC中的重要作用提供了额外的证据。本研究于2023年3月发表在《Inflammatory Bowel Diseases》IF:7.29期刊上。
技术路线

主要实验结果:
1、鉴定WGCNA模块的关键基因和DEGs及其功能分析
利用UC的GEO数据进行WGCNA分析,获得13个模块,其中navajowhite、darkolivergreen模块和临床指标高度相关(图1A)。利用GSE87466数据集鉴定DEGs,共获得910个DEGs,UC组有575个上调和335个下调(图1B)。DEGs和上述两个模块的交集是878个基因(图1C)。
对上述获得基因进行功能分析。GO的生物过程富集分析表明,这些基因主要富集与免疫相关通路相关的功能,包括“对细菌源分子的反应”、“体液免疫反应”和“对LPS的反应”(图1D)。细胞成分分析主要富集于“质膜外侧”和“质膜外侧”(图1E),MF分析主要富集于“趋化因子受体结合”和“趋化因子活性”(图1F)。KEGG分析发现这些基因主要途径是细胞因子-细胞因子受体相互作用”(图1G)。最后,进行了GSEA分析,结果主要富集在“IL−17信号通路”(图1H)。
在对浸润进行免疫学分析后,发现UC组与对照组在免疫细胞百分比上有显著差异(图1I)。UC的存在与具有记忆激活的T细胞CD4、滤泡辅助性T细胞、γ δ T细胞、巨噬细胞M0、巨噬细胞M1、活化的树突状细胞、活化的肥大细胞和中性粒细胞水平显著升高相关。相反,UC患者表现出明显较低水平的T细胞CD8,T细胞CD4记忆静息状态,T细胞调节性(Tregs), NK细胞活化,单核细胞,M2巨噬细胞和肥大细胞静息状态。

图1筛选溃疡性结肠炎相关基因
2、选择和验证与临床表型和免疫细胞高度相关的铁死亡相关DEGs
将上述878个基因与铁死亡相关基因取交集,得到UC中9个铁死亡相关DEGs。为进一步探索其机制,从STRING数据库中构建一个PPI网络,并在cytoscape中的MOODE插件上进行了验证,颜色越深,相关性越高(图2A)。随后分析了与铁死亡相关的DEG与免疫基因的相关性(图2B)。结果显示,铁死亡相关DEGs均与免疫基因存在不同程度的相关性,尤其是LCN2。最后,可视化铁死亡相关的DEGs在UC组和正常组中的表达,发现除了BSG,它们在UC组中均高表达(图2C-2K)。
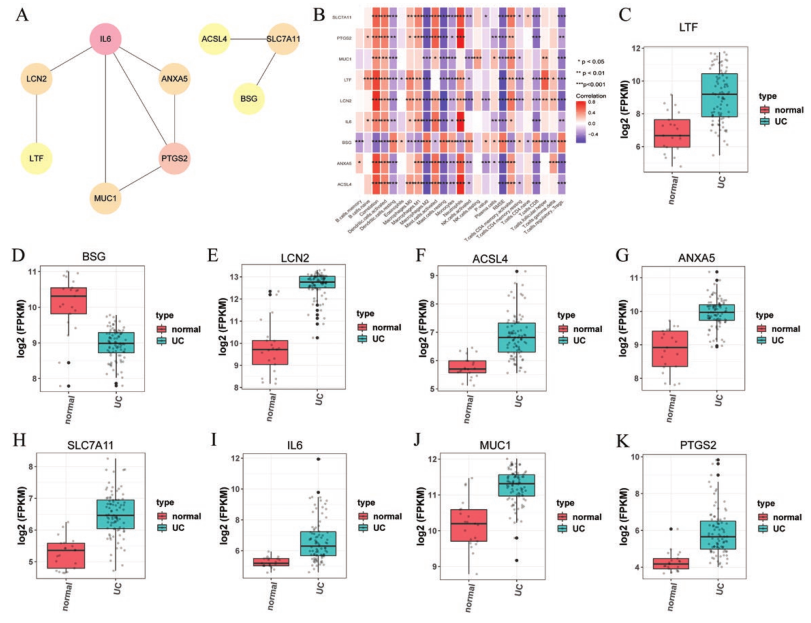
图2 PPI网络与凋亡相关DEGs的表达
3、LCN2是随机森林模型中最具决定性的基因
由于一些基因已经被证明与铁死亡相关,最终选择LCN2,BSG,ANXA5和MUC1进行随机森林模型构建。GSE87466的内部验证验证结果为阳性,表现为极高的置信水平(AUC = 1)和无可挑剔的分类性能(图3A)。这些结果表明,GSE87466是一个可靠和有效的分类器。基于测试集GSE47908的评估,有明显的高水平置信(AUC = 0.94;图3B)。同时,还可以看到测试集GSE47908中的4个基因在UC组和正常组中存在显著差异表达(图3C)。在测试集和训练集模型中,LCN2对模型的作用最大(图3D-E)。ROC曲线分析LCN2在验证集和测试集的诊断性能均显示出较好的AUC值(图3F-G)。以上表明LCN2是随机森林模型中最具决定性的基因。因此,选择LCN2用于后续分析。
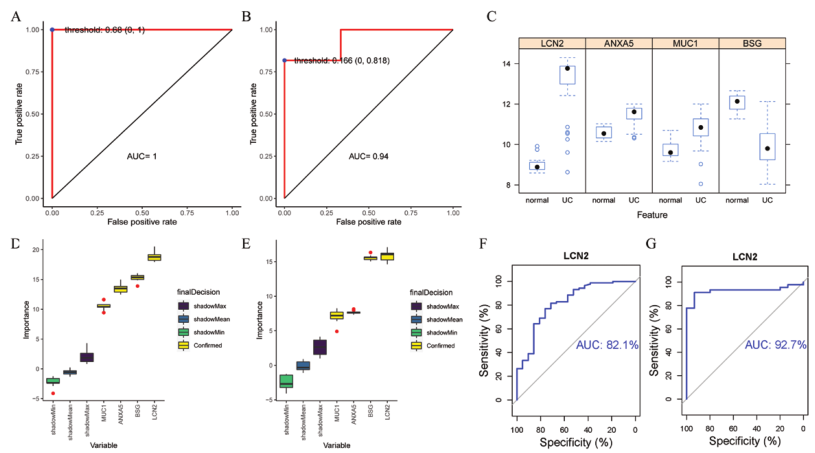
图3 UC的4个基因的随机森林预测模型
4、UC中发生铁死亡和LCN2高表达
通过构建LPS/IFN-γ诱导iBMDM呈M1样巨噬细胞的炎症模型模拟结肠炎的炎症过程,探讨LCN2基因在UC中的作用。如图4A所示,LPS/IFN-γ刺激引起的脂质过氧化水平增加,这一趋势可以被Fer-1预处理逆转。为进一步验证UC病理过程中铁死亡的存在,使用FerroOrange探针检测Fe2+含量的变化,LPS/IFN-γ刺激可诱导细胞内铁含量的积累,而Fer-1处理可恢复细胞内Fe2+水平(图4B)。此外,观察到LPS/IFN-γ刺激后ACSL4、COX2和LCN2蛋白水平显著上调,而GPX4和FTH1表达下降(图4C)。这些结果表明LPS/IFN-γ可以诱导iBMDM模拟的肠炎模型中铁死亡的进展并增加LCN2的表达。
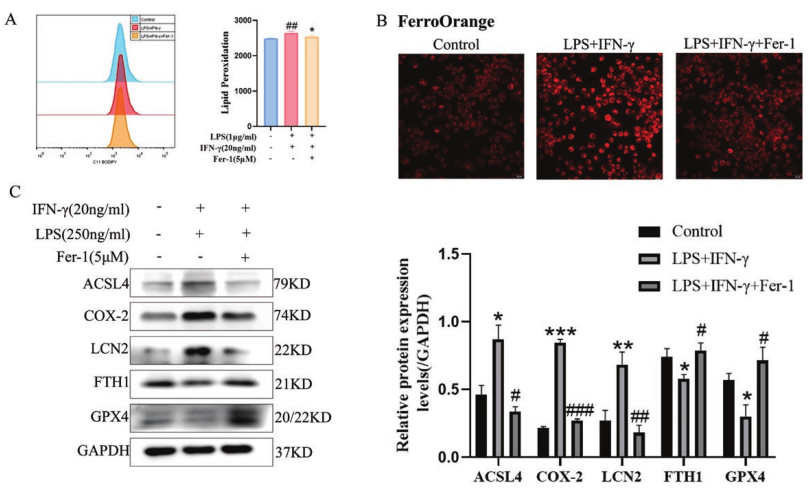
图4 LPS/IFN-γ刺激iBMDM极化并模拟结肠炎的炎症过程
5、LCN2沉默抑制UC铁死亡
为探究LCN2在UC铁死亡中的作用,在iBMDM和Caco-2细胞中敲低LCNE2的表达(图5A)。结果显示敲低LCN2可降低LPS/IFN-γ刺激iBMDM细胞和LPS刺激Caco-2细胞诱导的脂质过氧化水平(图5B)。采用共聚焦显微镜或多功能微孔检测系统检测Fe2+含量。如图5E所示,与对照组相比,LCN2敲低降低LPS/IFN-γ处理的iBMDM细胞和LPS刺激的Caco-2细胞中亚铁含量的增加。此外,在炎症模型中,LCN2敲低降低ACSL4和COX-2蛋白水平,而SLC7A11、GPX4和FTH1蛋白水平升高(图5C-D)。同样,UC模型中ACSL4和FTH1的表达被LCN2敲低逆转(图5C-D)。综上所述,敲低LCN2可以抑制UC中的铁死亡,从而延缓UC的进展。

图5 敲低LCN2抑制UC细胞的铁死亡
6、LCN2介导的铁死亡导致DSS诱导的UC
为进一步验证LCN2作为UC的铁死亡相关因子的存在,用Fer-1预处理小鼠,并让小鼠自由饮用含有3%DSS的饮用水,诱导UC模型。结果如图6A-C所示;DSS组表现出明显的UC症状,包括体重明显下降,DAI评分明显增加,结肠长度明显缩短。然而,使用Fer-1后,明显扭转了这些变化。H&E染色结果显示,DSS组表现出明显的炎症细胞浸润、粘膜损伤和其他病理症状,Fer-1可以缓解这些症状(图6D)。免疫组化结果显示,Fer-1缓解了DSS诱导的UC中紧密连接蛋白(Occludin、ZO-1、Claudin-1)的表达减少(图6E)。这表明靶向铁死亡形成是治疗UC的一个很有前途的途径。
此外,结果显示,在DSS诱导的UC中,GPX4的表达被下调,而ACSL4和LCN2的表达被上调,这些变化可以被Fer-1抵消(图6F)。总之,LCN2与UC中的铁死亡密切相关,抑制铁死亡可以减少LCN2的表达,改善UC小鼠。
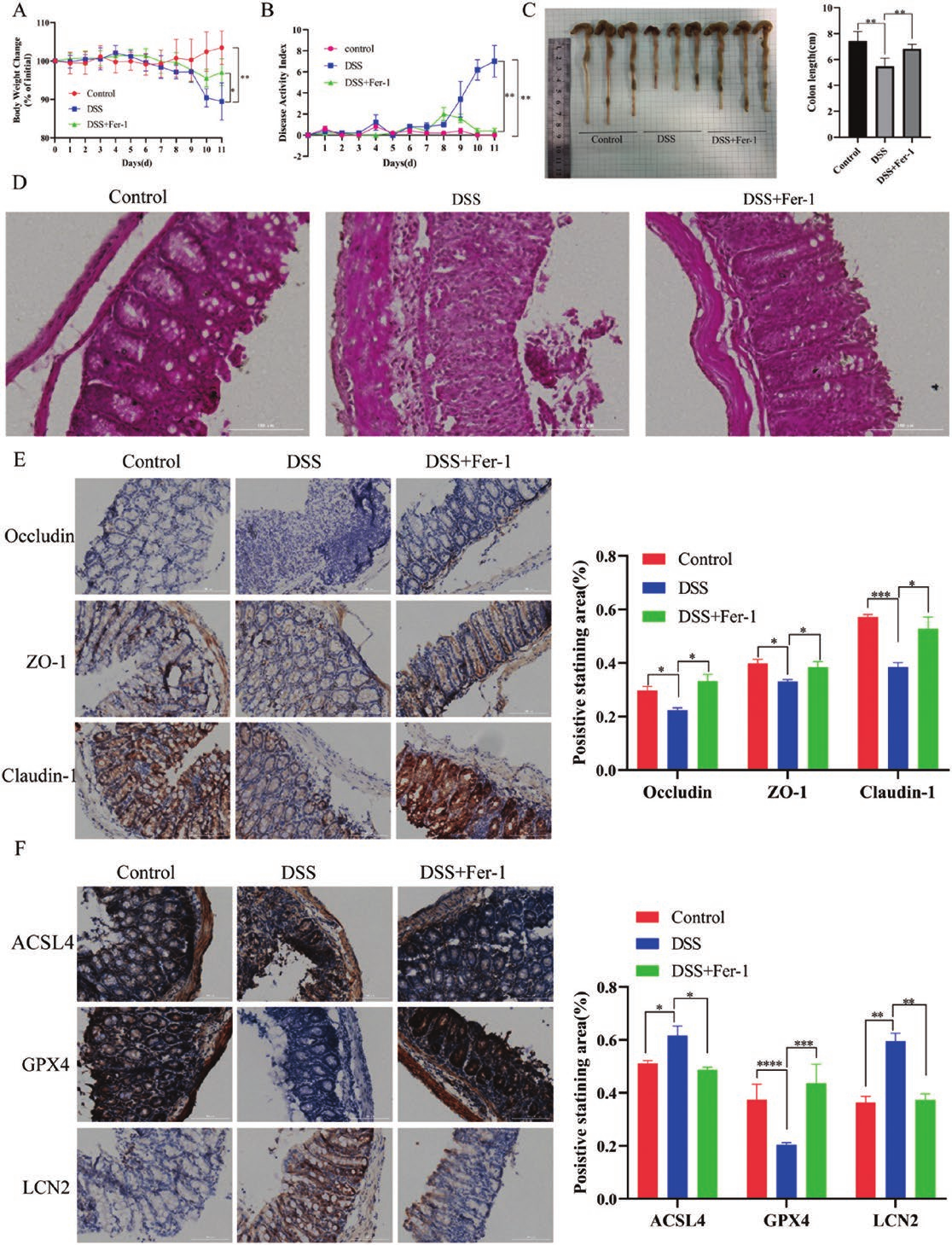
图6 LCN2介导的铁死亡参与DSS诱导的UC
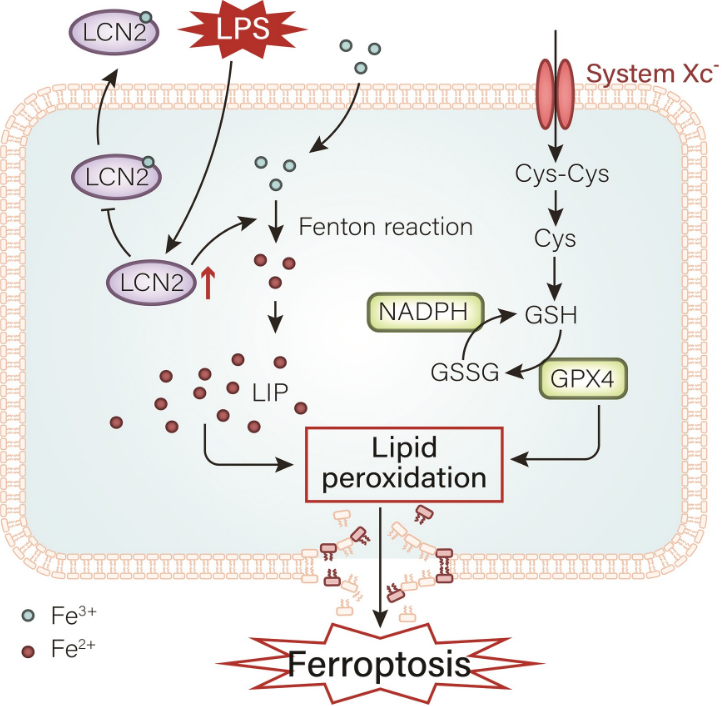
总之,在这项研究中,作者发现在LPS/IFN-γ诱导的巨噬细胞极化的炎症模型和DSS诱导的UC小鼠模型中,LCN2高度表达,并与UC铁死亡的发生密切相关。更重要的是,沉默LCN2抑制了巨噬细胞极化的炎症模型和LPS刺激的Caco-2细胞UC模型中的铁变性事件。研究表明,LCN2是调节UC中铁死亡形成的一个关键因素,而抑制LCN2会抑制UC中的铁死亡形成。
实验方法:
GEO数据下载,WGCNA分析,GSEA分析,DEG鉴定和功能富集,CIBERSORT分析,PPI分析,构建随机森林模型,细胞培养和转染,脂质过氧化实验,WB,铁离子浓度检测,UC动物建模,HE染色,IHC
参考文献:
Deng L, He S, Li Y, Ding R, Li X, Guo N, Luo L. Identification of Lipocalin 2 as a Potential Ferroptosis-related Gene in Ulcerative Colitis. Inflamm Bowel Dis. 2023 Mar 31:izad050. doi: 10.1093/ibd/izad050. Epub ahead of print. PMID: 37000707.






